一种新的犬胆管及十二指肠管插管模型的制作及可行性分析
邱智寅 艾晓杰 陈 琼 (上海交通大学农业与生物学院/上海市兽医生物技术重点实验室,上海市闵行区 0040;科文斯医药研发 (上海) 有限公司,上海市浦东新区 08;上海医药工业研究院,上海市浦东新区 00)
药物代谢是指药物进入机体内吸收入血,并分布到各组织器官,经肝、肾等代谢后,通过胆汁、粪、尿等途径排泄(消除)的过程[1];同时,药物除了通过胆汁、粪、尿等途径排泄外,还可通过呼吸道、唾液、乳汁、汗液等途径排泄[2-7]。在临床前和临床早期阶段,研究药物在体内的排泄过程,鉴定其代谢产物,比较推断其吸收和分布,能客观地了解候选药物对机体的作用,有助于筛选出活性高、安全性好的新药[8]。笔者以比格犬为试验对象,在参考借鉴现有药理学和药效研究中比格犬胆管插管和代谢模型的基础上,研究制作了一种新的比格犬单向和双向插管模型——犬胆管及十二指肠管插管模型,旨在提供一种新的模型用于药物代谢研究和新药筛选。现对该新模型的制作方法及可行性进行总结分析,以供参考借鉴。
1 材料与方法
1.1 试验材料
1.1.1 动物材料
选用5只6~7月龄、体重为7.5~7.9 kg的雄性健康比格犬[购自北京玛斯生物技术有限公司,许可证号SCXK(京)2016-0001],编号1~5。试验前比格犬穿马甲、佩戴伊丽莎白项圈适应1周以上,手术按照Institutional Animal Care and Use Committee(IACUC)规范操作,由技术员和兽医共同照料、护理。
1.1.2 其他材料
器械:腹壁牵开器、手术刀、敷料钳、止血钳、有齿镊、组织镊、巾钳、持针钳、手术剪、眼科镊、显微剪、显微镊、创巾、纱布,部分器械需高压灭菌消毒45 min(蒸汽压力108 kPa,温度121 ℃)。
设备及耗材:手术室、手术台、无影灯、保温垫、心电监测仪、注射泵、剃毛刀、无菌手套、肠溶缝线、缝针、不可吸收缝线、BICCS T导管等,部分设备及耗材需用0.2%过氧乙酸溶液灭菌消毒,并用紫外消毒灯照射30 min以上。
1.2 试验方法
1.2.1 术前准备
术前比格犬要求禁食16 h以上,并提前将手术台温度设置在37 ℃。先对比格犬肌肉注射阿托品0.03 mg/kg,皮下注射拜有利8 mg/kg及通立定4 mg/kg镇静镇痛;然后肌肉注射舒泰50 2.5 mg/kg麻醉,犬仰卧绑定,并拉出舌头,于双前肢头静脉植入留置针,静脉注射丙泊酚2 mL/(kg·h)维持麻醉,静脉注射乳酸林格氏液(LRS)10 mL/(kg·h)维持体液,涂眼药膏防止眼部干涩;然后对术部进行剃毛,用碘酊常规消毒,用75%酒精脱碘,然后铺上创巾;最后用心电监护仪动态监测犬的生理指征。
1.2.2 手术过程
沿剑突下1 cm腹部中线纵向切开腹壁18~30 cm;于肝门处找到左侧的肝总管和右侧的胆囊管,选择在肝管与胆管的汇入胆总管的Y型段下方插管,见图1;以肠钳固定十二指肠,将纱布垫于肝脏及十二指肠间;在Y型下4~5 cm处插管,用止血钳钝性分离总胆管及周边组织,将T型导管的胆囊端留5~7 cm,末端剪成斜面;在T型导管胆管远端和近端段放置2个缝线预节,见图1中的位置1和2;用显微剪在胆管端剪开1个小口,以眼科镊将T型导管斜口缓缓插入胆管,至总胆管Y型口前,以缝线用方结来固定导管的1号和2号位置;胆汁流进T型管后可用止血钳使胆汁停止流入;在胆管通往肠端用不可吸收的缝线预打2个节,见图1中的位置3和4;同样,插入T型管的肠端,并用方结固定,确保导管末端位于十二指肠远端,且不折叠打结;用生理盐水测试十二指肠导管是否通畅,然后将T型导管和大网膜进行缝合固定,用缝线将十二指肠缝合到腹壁固定,将T型导管穿出肌肉层,连续缝合腹壁肌肉层;用手术刀柄钝性分离左胸壁与肌肉层至第7肋处,开口(约3 cm),用来安装导管装置,见图2;在开口处缝合导管,并连接导管及肠管至导管装置,以生理盐水测试导管是否通畅,然后在肌肉层缝合固定T型导管,最后缝合切口。
术后停止注射丙泊酚,并将犬移至加热垫上保温,监测其体征。术犬苏醒(约10 min) 后,停止注射乳酸林格氏液并带上伊丽莎白项圈,穿上马甲,随即放回笼舍。
1.2.3 术后护理
术后对犬进行消炎及镇痛药物治疗,连续7 d口服甲硝唑片10 mg/kg、拜有利片5 mg/kg,若缝合部位有炎症或化脓,可适当延长给药时间。每天以碘酊清洗缝合部位及导管外出口,涂抗菌药膏 (百多邦),保持皮肤伤口清洁干燥。当缝合部愈合后移除颈部项圈并拆线。
1.2.4 胆汁采集及胆盐回补
采集胆汁时,更换图2的左胸皮肤导管装置,胆汁即可被引出体外,并可进行胆盐补充,采样时,犬可在笼内活动。胆汁丢失会影响犬的正常消化及吸收,因此需要补充胆盐,可喂食含有牛磺胆酸钠的0.05%生理盐水溶液,以0.6 mL/(kg·h)流速导入肠腔内。

图1 T导管及放置位置
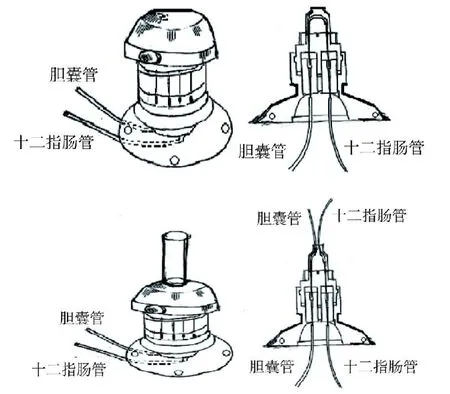
图2 BICCS T导管装置
1.3 模型评价
可从以下几方面对犬胆汁排泄试验模型进行评价:(1)胆管及肠管测试。一般术后每2~3 d查看1次连接导管套索装置是否有胆汁流出,肠管可先用注入和回抽乳酸林格氏液来检测,如果导管脱落及损坏,须手术调整复位。(2)术后创口观察。观察伤口是否有红肿、化脓等,一旦发现可根据实际情况更换抗生素进行治疗。(3)整体观察和指标测定相结合。整体观察包括观察术犬的一般体征,是否有异常表现、疼痛或不适现象,指标测定则是测定术犬的体重、采食量、血液生化指标、胆汁量等。(4)两周后是否可将状态正常的术犬用于药物的胆汁排泄试验。
2 结果与分析
2.1 一般状况
据手术后观察,在术后3 d内术犬均出现了不同程度的活动减少现象,随后术犬活动开始恢复正常;术后2 d伤口结痂,术部皮肤红肿,术后4 d术部皮肤消肿,术后1周术部皮肤愈合良好,拆线;术后1周内每隔2 d进行1次胆管及肠管测试,均保持通畅。另外,手术后5只犬的整体状况和采食情况均为正常。
2.2 体重变化
术犬体重在术后3 d内均有不同程度的降低,5只犬中,有2只犬的体重下降0.3 kg,降幅分别为4.1%、3.7%,有3只犬的体重下降0.2 kg,降幅分别为2.6%、3.0%、2.6%。术后7 d,有1只犬的体重增长0.1 kg,有2只犬的体重恢复至术前,有2只犬的体重仍未恢复至术前。术后14 d,有3只犬的体重超过术前,有1只犬的体重与术前持平,仍有1只犬的体重较术前下降0.1 kg。经分析,该术犬的体重下降可能与手术相关。
2.3 采食变化
术犬在手术当天因禁食及手术麻醉,所以未进行采食数据采集。术后2 d,术犬的平均采食量由225 g/d下降到130 g/d,降幅为57.7%;术后3 d、4 d、5 d,术犬的采食量逐渐增加,平均采食量分别达到术前的65.3%、75.1%、84.4%,术后6 d采食量恢复至术前水平,术后7~14 d术犬的平均采食量均比术前高。经分析,术后犬的采食量降低与术犬活动减少、疼痛等有关。由图3可知,术犬随着身体逐渐恢复,采食也恢复正常。

注:-1 d表示术前1 d,2 d表示术后2 d,以此类推
2.4 血液生化指标
由表1可知,术后犬的血液生化指标有较明显的变化。其中,丙氨酸氨基转移酶(ALT)从术前1 d的32 U/L上升至术后7 d的55 U/L,上升幅度为71.88%;天冬氨酸氨基转移酶(AST)从术前1 d的34 U/L上升至术后7 d的57 U/L,上升幅度为67.65%;术后7 d AST/ALT的比值>1,说明手术对比格犬的肝脏有损害;术后14 d,AST及ALT的数值均低于术前,表明动物恢复正常;肌酸激酶(CK)从术前1 d的134 U/L上升至术后7 d的359 U/L,上升幅度为167.91%,术后14 d又降低至123 U/L;总胆红素(TBIL)从术前1 d的<0.1 mg/dL上升至术后7 d的0.4 mg/dL,术后14 d又降低至术前水平;经分析,CK及TBIL的数值升高是由插管、手术、抗生素使用导致的。
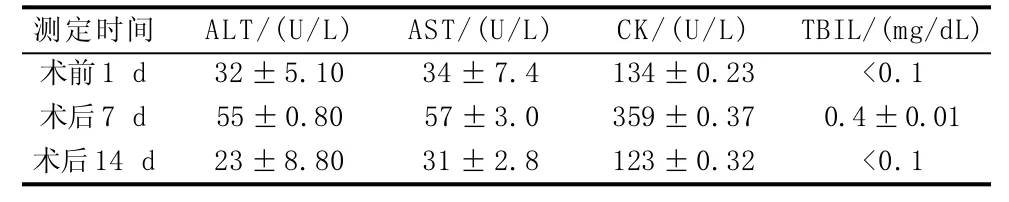
表1 手术前后比格犬血液生化指标比较
2.5 胆汁排泄量
从术后8 d开始每天收集胆汁1次,连续收集7 d。导出的胆汁为棕黄色、质粘稠,经统计分析,每天胆汁排出量间差异不显著。见表2。

表2 术后比格犬胆汁排出量统计
2.6 评 价
根据试验观察和检测分析,术后14 d术犬的生理状况、体重、采食量、血液生化指标及胆汁量等各项指标均恢复至正常水平,可用于药物的胆汁排泄试验。
3 结论与讨论
本试验探索并建立了新的比格犬单向和双向插管模型——犬胆管及十二指肠管插管模型,术后术犬出现了术部红肿、侧卧、流涎、反应迟缓、活动减少等现象,且血液生化指标(丙氨酸氨基转移酶、天冬氨酸氨基转移酶、肌酸激酶和总胆红素)较术前有所升高,经分析,这是由于麻醉、手术受创、术后疼痛及抗生素使用等引起的;但该造模手术时间短、创伤小,术后动物活动不受限制,且能保持正常的生理机能和代谢水平,各项生化指标也逐日恢复,术后14 d术犬的各项指标即可恢复至术前正常水平。因此,该模型可在临床前药代动力学研究中进行应用,且其符合动物福利及伦理的要求,也符合未来国内临床前药动学研究动物试验的发展趋势和潮流。

