氨基胍通过减轻内质网应激改善糖尿病小鼠认知功能
方 洁,邓雅欣,王鹏宇,陈 曦,邵德翠,汪萌芽
(皖南医学院 1.细胞电生理研究室;2.启明星小组,安徽 芜湖 241002)
近年来,糖尿病(diabetes mellitus,DM)患者的人数持续增长,据估计到2030年全球糖尿病患者人数将达到4.39亿[1]。 2型糖尿病(type 2 diabetes mellitus,T2DM)占糖尿病发病率的90%以上,它可以损害神经系统致患者认知能力下降[2-3]。晚期糖基化终产物(AGE)是导致DM的重要因素,体内积聚过多的AGE可引起糖尿病的各种并发症。氨基胍(AG)作为AGE的抑制剂通常用于治疗糖尿病大鼠的心血管疾病[4]。目前有学者开始将AG用于治疗糖尿病大鼠的认知障碍,研究表明AG可改善糖尿病大鼠的认知功能,但其具体机制仍在不断探索中[5-6]。离子型谷氨酸受体(iGluR)参与神经退行性疾病和精神疾病的发展过程[7],α-氨基-3-羟基-5-甲基异恶唑-4-丙酸受体(AMPA受体)作为iGluR的一种亚型,在记忆形成中发挥重要作用。已有研究发现多种因素与糖尿病所致的认知衰退有关,包括内质网应激(ERS)[8]。内质网(ER)与所有真核细胞中脂质和蛋白质的生物合成密切相关,当蛋白质发生错误折叠时可引起ERS[9]。机体产生应激时ERS被广泛激活,并受ER伴侣蛋白葡萄糖调节蛋白78(GRP78/Bip)控制,XBP1s的表达也随之增加[10]。在T2DM中,高水平的AGE可诱导内质网应激(ERS),长期处于ERS状态下,机体胰岛素抵抗进一步加强,从而在糖尿病的发病机制中发挥作用并损害多种器官组织[11-12]。因此,本研究旨在探究ERS在AG改善T2DM小鼠认知功能中的作用。
1 材料和方法
1.1 动物 雄性昆明小鼠40只,体质量18~22 g,由南京青龙山动物繁殖场提供,合格证号:SCXK(沪)2013-0006。
1.2 药品与仪器 链脲霉素(Streptozotocin,sigma公司,货号V900890-1G),氨基胍(Aminoguanidine,sigma公司,货号A7009-100G),GluR1抗体(上海Abcam公司,货号ab109450),GluR2(上海Abcam公司,货号ab106515),血糖仪(强生医疗器械有限公司,ONETOUCH UltraEasy),跳台检测仪(ugo basile公司,实验箱型号Cat.No.47573,触控屏控制器40500-001,相关应用软件4570-010)。
1.3 模型制备与分组 小鼠自由进食适应1周后随机选择10只小鼠作为对照组(Ctrl组)给予正常饮食,其余小鼠(模型组)给予高糖高脂饮食(HFD)。4周后,所有小鼠禁食不禁水12 h,将120 mg/kg STZ溶于pH4.25的0.1 mol/ L柠檬酸-柠檬酸钠缓冲液中并腹腔注射于模型组小鼠,对照组小鼠注射等量的柠檬酸缓冲液。尾静脉取血测量空腹血糖(FPG),注射7 d后FPG≥11.1 mmol/L可视为成功模型(T2DM)[13],继续给予模型组小鼠HFD饮食。每周测量1次FPG,4周后将模型组小鼠随机分为两组,即糖尿病组(DM组,n=9)和氨基胍组(AG组,n=9)。根据文献报道,2型糖尿病成模率一般在80%左右[14],本实验造模小鼠总数30只,实际成模25只,成模后继续饲养过程中因血糖过高死去7只,因体质以及饲养问题对照组小鼠死去2只,最终纳入统计小鼠为对照组8只,氨基胍组9只以及糖尿病组9只。AG组小鼠给予氨基胍(100 mg/kg)灌胃治疗,其余小鼠予以等体积生理盐水灌胃[15-16]。
1.4 跳台实验检测小鼠行为学认知能力 第1天,给予小鼠3 min训练。将小鼠置于平台上,使平台振动(10Hz)。如果小鼠离开平台(即为错误行为)它们将受到电击(0.5 mA)惩罚。训练期间,记录第1次离开平台的时间(潜伏期)和错误的次数。第2天重复第1天的实验,并记录潜伏期和错误次数。在第3天,检测其学习结果。所有的设置都固定不变,只是不给电击,同样记录它们的潜伏期和错误次数[3]。
1.5 Western blot 跳台实验完成后,取出小鼠大脑。左脑分离海马保存于-80℃冰箱用于Western blot。海马组织中加入等量组织裂解液研磨,离心收集上清液。等量上清液加入SDS-聚丙烯酰胺凝胶中进行电泳分离与转膜,膜在含有5%脱脂奶粉和0.1%Tween-20的Tris缓冲盐水(TBST)中封闭1 h,之后放入相应一抗中4℃孵育过夜。用TBST洗涤3次,每次10 min,之后放入对应的二抗中孵育2 h(兔抗或鼠抗)。用TBST再次洗涤3次,每次10 min,暗室曝光。ImageJ 软件对条带光密度值定量分析[17-18]。
1.6 HE染色观察小鼠海马CA1区神经元变化 右脑用于HE染色切片观察,4%多聚甲醛固定右脑,乙醇梯度脱水,包埋在石蜡中。制备石蜡包埋的脑切片(5 μm),并用苏木精-伊红染色,在光学显微镜下以200×和400×放大观察右脑切片[19]。
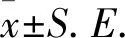
2 结果
2.1 小鼠体质量、血糖的变化 注射STZ前,糖尿病小鼠的体质量与对照组差异无统计学意义。注射STZ两周后,与对照组小鼠相比,糖尿病小鼠的体质量降低(P<0.01)并呈现下降趋势。AG组小鼠体质量高于DM组,但差异无统计学意义(表1)。注射STZ后,糖尿病小鼠血糖值超过20 mmol/L,高于对照组(P<0.01),但AG组与DM组小鼠之间血糖值差异无统计学意义(表1)。
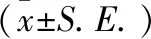

指标组别n注射STZ前注射STZ后2周4周6周8周Ctrl组842.4±0.945.0±1.147.7±1.247.8±1.048.0±1.2体质量/gAG组943.5±1.639.0±1.6∗∗40.4±2.0∗38.5±1.8∗36.5±1.8∗DM组941.7±0.937.0±0.8∗37.9±1.1∗37.0±0.9∗35.4±1.1∗F0.6211.8711.4618.8922.93P>0.05<0.01<0.01<0.01<0.01Ctrl组83.8±0.24.5±0.35.1±0.46.6±0.39.3±0.3血糖/(mmol/L)AG组93.6±0.218.8±2.9∗22.5±2.5∗24.0±1.9∗30.6±1.3∗DM组93.4±0.423.9±2.6∗23.1±2.6∗25.5±1.6∗28.6±1.8∗F0.4317.4720.5647.0277.26P>0.05<0.01<0.01<0.01<0.01
与Ctrl组相比:*P<0.01。
2.2 氨基胍对T2DM小鼠行为学的影响 对小鼠跳台实验的潜伏期(F=6.28,P<0.01)和错误次数(F=2.98,P=0.07)进行单因素方差分析发现:经过两天的训练学习,与Ctrl组(176.36±2.83)s相比,DM组(102.40±26.61)s的潜伏期缩短(P<0.01),与DM组相比,AG组(169.66±5.73)s的潜伏期延长(P<0.01)(图1A)。与Ctrl组相比(0.38±0.26)次,DM组(1.44±0.47)次小鼠的错误次数增多(P<0.05)次,AG组(0.44±0.24)小鼠的错误次数少于DM组(P=0.051)(图1B)。


图1 小鼠跳台实验潜伏期与错误次数的比较
2.3 氨基胍对T2DM小鼠海马神经元细胞的影响 用显微镜200× 和400× 观察HE染色切片,在400×下可观察到Ctrl组小鼠海马CA1区胞质较为丰富,细胞排列较为整齐(图2A、B),AG组小鼠海马CA1区细胞质略有减少,细胞排列较为疏松(图2C、D),DM组小鼠海马CA1区细胞核固缩,细胞质减少,细胞排列混乱(图2E、F)。

A.Ctrl组(200×);B.Ctrl组(400×);C.AG组(200×);D.AG组(400×);E.DM组(200×);F.DM组(400×)。
图2 HE染色观察小鼠海马CA1区神经元变化
2.4 氨基胍对T2DM小鼠AMPA受体表达的影响 对小鼠海马内GluR1(F=2.25,P>0.05)和GluR2(F=5.49,P<0.05)(图3A),蛋白表达水平进行单因素方差分析发现:与Ctrl组相比,DM组中GluR1蛋白表达水平升高(P<0.05)(图3B),GluR2表达水平升高更为显著(P<0.01)(图3C);与DM组相比,AG组AMPA受体表达水平呈下降趋势,但无统计学意义。


图3 Western blot检测小鼠GluR1、GluR2的表达水平
2.5 氨基胍对T2DM小鼠内质网应激表达水平的影响 对小鼠海马中内质网应激Bip(F=6.12,P<0.05)和XBP1s(F=15.92,P<0.01)(图4A)的表达水平进行单因素方差分析发现:与Ctrl组相比,DM组小鼠海马中内质网应激水平较高(P<0.01,P<0.01),经过两周的氨基胍治疗后,与DM组相比,AG组小鼠海马内Bip和XBP1s蛋白的表达水平都下降(P<0.05,P<0.01)(图4B、C)。
图4 Western blot检测小鼠Bip、XBP1s的表达水平
3 讨论
本实验观察了AG对T2DM小鼠认知功能的作用。行为学实验表明经AG治疗后,糖尿病小鼠的学习记忆能力确有改善。HE染色切片上可观察到与DM组相比,AG组的海马CA1区神经元细胞排列更为整齐,细胞质也更为丰富。Western blot结果显示,DM组小鼠AMPA受体、Bip和XBP1s表达水平升高,经AG治疗后,AG组AMPA受体水平呈下降趋势,ERS水平下降,表明AG可通过减轻ERS来改善T2DM小鼠的认知功能。
Yin等研究发现在具有认知缺陷的自发性肥胖KK-AyT2DM小鼠中,GluR1蛋白表达下调而GluR2的表达却上调。他们认为GluR1亚基的减少阻碍了LTP在海马中的表达,而GluR2亚基的上调可能是由于机体通过代偿效应减轻小鼠的认知障碍[20]。也有相关领域的其他研究人员表示AMPA受体水平的上调可能是机体对认知障碍的一种补偿作用[21-22]。Western blot结果显示DM组GluR1和GluR2表达水平较Ctrl组升高,经AG治疗后两者表达水平均呈下降趋势。GluR1和GluR2受体的上调可能是机体代偿的结果,通过AG治疗后机体的代偿性应激状态得以改善并趋于恢复至正常水平。目前已有研究表明ERS与肥胖大鼠认知障碍密切相关[23],减轻ERS可改善糖尿病大鼠的认知功能[24]。Bip和XBP1s是ERS的标志蛋白,我们的实验观察到DM组Bip和XBP1s表达水平升高,通过AG治疗后两者水平都降低,这表明ERS可能是导致糖尿病小鼠认知功能受损的重要因素,而AG可以减轻ERS。AMPA受体作为检测认知的指标之一,其在DM组中的表达上升可能是高水平的ERS激活机体的保护机制从而使AMPA受体代偿性表达升高,但具体的机制仍不清楚。Osborne等人报道认为AMPA受体和NMDA受体失调是饮食所致肥胖小鼠认知障碍的原因之一,并且这种失调的具体机制因研究的不同而有所差异[21]。ERS是复杂的网络调节机制,不同信号通路的激活在细胞存活或死亡的命运选择上完全不同,对于AG如何通过减轻ERS改善T2DM的认知功能以及ERS与AMPA受体的内在联系,我们将在离体海马神经元中进一步阐明其分子机制。
综上所述,本实验结果表明,AG可能通过减轻ERS来改善T2DM小鼠的认知障碍。本实验为氨基胍类药物改善糖尿病认知障碍提供了理论支持,同时通过探究ERS与AMPA受体的表达在其改善机制中的作用也为提高T2DM认知功能提供了一个研究方向。

