氢质子磁共振波谱活体检测结肠癌耐药性及其分子标志物的探索
谢琦,陈惠娴,杜磊,廖炎辉,谭智霖,杨逸铭,吴敏仪,潘奇锋,,吴锦斌,,张鼎旋,
磁共振波谱分析(magnetic resonance spectroscopy,MRS)是利用化学位移理论与磁共振技术相结合,定量分析人体内特定化合物浓度的一种无创伤性MRI检测技术。利用MRS可检测出肿瘤产生多药耐药性前后某些代谢物的变化,对检测肿瘤耐药性改变的分子标志物可能起到重要作用。本研究探索氢质子磁共振波谱(1H-MRS)活体检测人类结肠癌耐药性的可能。
1 材料与方法
1.1 动物模型制作
1.1.1 人类结肠癌SW480/5-FU耐药细胞系的建立[1]
人类结肠癌SW480亲本细胞系(购自中山大学动物中心细胞库)用完全新鲜培养液于37℃,5% CO2孵箱中培养。
采用大剂量冲击法诱人类结肠癌SW480耐药细胞株:SW480亲本细胞处于对数生长期时, 将培养液换为含有6μg/mL 5-FU的培养液,冲击培养24 h撤药,换为正常完全培养液继续培养,1~2 d换液一次,待细胞重新恢复正常增殖,生长至对数生长期时进行传代,传代后继续以此浓度剂量冲击培养诱导耐药细胞株,培养6个月,获得能够在6 μg/mL 5-FU浓度中稳定生长的人类结肠癌SW480耐药细胞株,命名为SW480/5-FU。
MTT比色法检测人类结肠癌亲本SW480、耐药SW480/5-FU细胞IC50,耐药指数(resistance index,RI)=SW480/5-FU IC50∶SW480 IC50=20.594 μg/mL∶4.639μg/mL=4.44。
1.1.2 实验动物模型制作[1]
16只健康的BALB/c裸小鼠,雌性,5~6周,16~18 g,随机分为两组(各8只),用安尔碘消毒后,分别于裸鼠双侧大腿根部皮下注入SW480(不耐药组)与SW480/5-FU (耐药组)细胞悬液(0.2 mL/只,细胞浓度为4×107/mL),定期观察肿瘤生长情况,取最大径大于1.5 cm以上的肿瘤进行磁共振检查。
1.2 荷瘤鼠MR检查[1]
采用SIEMENS公司MAGNETOM Skyra-3.0 T超导型磁共振成像仪与动物线圈(上海辰光)行以下序列检查。
1.2.1 T2WI快速自旋回波
TR/TE=4500 ms/110 ms,层厚2 mm,间隔0,FOV 128 mm,NAS 4,加速因子2,采集矩阵128×128,重建矩阵512×512,行轴位、冠状、矢状位成像,成像时间=2 min 2 s (图1)。
1.2.21H-MRS数据采集
采用PRESS序列,谱线带宽1000 Hz,翻转角90°,手动匀场、抑水;多体素三维容积采集(3-demensional multi voxel,3D MV):TR/TE=1700 ms/135 ms,层厚2 mm (根据肿瘤大小调整),间隔0,FOV 60 mm,VOI 30 mm,采集体素边长10 mm,NAS 8,采集矩阵128×128,重建矩阵512×512,成像时间=9 min 13 s (图2)。
1.2.3 数据处理
1H-MRS所得数据经西门子磁共振成像仪工作站处理,结合T2WI轴位和冠状位定位像,得到图像上能最大范围覆盖肿瘤的采集体素生成MRS谱线图,系统自动计算出所测代谢物的波峰下面积及其与肌酸峰下面积比值。检测的代谢物有:胆碱(choline,Cho)、乳酸(lactate,Lac)、谷氨酸-谷氨酰胺复合物(glumate+gultamine,Glx)、肌醇(inositol,Ins)、肌酸(creatine,Cr)。
1.3 标本的实验研究
BALB/c裸小鼠于磁共振检查完毕后,向其腹腔注射10%水合氯醛处死,切开裸鼠肿瘤部位皮肤,将肿瘤全部掏出,即放入无菌冰生理盐水中,磁共振数据采集侧肿瘤一分为二,一部分放入缓冲4%多聚甲醛,供石蜡包埋切片及细胞凋亡检测;另一部分肿瘤组织放入液氮罐中,供Western blot检测P-gp、MRP1、PKC、γ-GCSh、γ-GCSl、GSHS、GST蛋白表达。
HE染色结果分析:病理切片由两位病理科医师分别按同一标准在偏光显微镜下阅片分析,取两位医师所采集的均值为病理的检测最终结果数值。
Western blot检测由广州杰特伟生物科技有限公司完成。所用抗体:羊抗小鼠IgG/HRP (Abclonal),M D R 1(A 11 7 5 8,A b c l o n a l);M R P 1(A 3 0 2 7,Abclonal);PKC(A0267,Abclonal);GST(2624S,CST);GSS(A1069,Abclonal);GCLM(A5314,Abclonal);GCLC(Ab190685,Abcam)。所检测代谢物胶片扫描入电脑,用凝胶图像处理系统Image J分析条带净光密度值,计算蛋白表达光密度比RIOD。
1.4 统计学分析
采用SPSS 13.0 统计学软件进行统计学处理,数据用±s表示,两组之间比较均采用Mann-Whitney U检验,相关性分析均采用Spearman相关检验,P<0.05表示差异有统计学意义。
2 结果
耐药组与非耐药组分别有8个肿瘤最大径线为1.5 cm以上。
2.1 肿瘤代谢物的1H-MRS检测
肿瘤组织Cho、Lac、Glx、Ins与Cr峰量化结果见表1。耐药组Cho峰、Lac峰、Glx1峰、Glx2峰面积及Ins/Cr峰面积比均较不耐药组增加,两者差异有统计学意义(P<0.05,表1)。
表1 耐药组与不耐药组肿瘤1H-MRS检测面积量化分析结果(±s)Tab.1 Results of quantit ative analysis of 1H-MRS measure area in drug-resistant tumor and drug- response tumor (±s)

表1 耐药组与不耐药组肿瘤1H-MRS检测面积量化分析结果(±s)Tab.1 Results of quantit ative analysis of 1H-MRS measure area in drug-resistant tumor and drug- response tumor (±s)
组别 Cho Lac Ins/Cr Glx1 Glx2 Glx1/Cr Glx2/Cr不耐药组(n=8) 0.94±0.47 0.60±0.14 1.42±0.26 1.38±0.10 0.64±0.21 2.35±0.34 1.18±0.39耐药组(n=8) 2.89±0.92 1.92±0.29 3.99±0.96 2.88±0.62 0.90±0.35 5.36±0.36 1.75±0.53 Z值 2.611 2.611 2.611 1.964 2.193 1.091 1.358 P值 0.008 0.008 0.008 0.049 0.032 0.275 0.222
表2 SW480组与SW480/5-FU组蛋白表达RIOD值的比较(±s)Tab.2 Comparison of RIOD values of protein expression between SW480 and SW480/5-FU (±s)
表2 SW480组与SW480/5-FU组蛋白表达RIOD值的比较(±s)Tab.2 Comparison of RIOD values of protein expression between SW480 and SW480/5-FU (±s)
组别 p53 P-gp MRP1 PKC γ-GCSh γ-GCSl GSHS GST不耐药组(n=8) 0.26±0.07 0.20±0.03 0.15±0.01 0.16±0.02 0.18±0.02 0.15±0.00 0.28±0.33 0.12±0.02耐药组(n=8) 0.39±0.03 0.31±0.08 0.69±0.10 0.86±0.06 0.43±0.26 0.34±0.07 1.37±0.07 0.42±0.07 Z值 1.687 2.611 2.785 2.668 2.643 2.712 2.635 2.627 P值 0.095 0.003 0.005 0.008 0.008 0.007 0.008 0.008
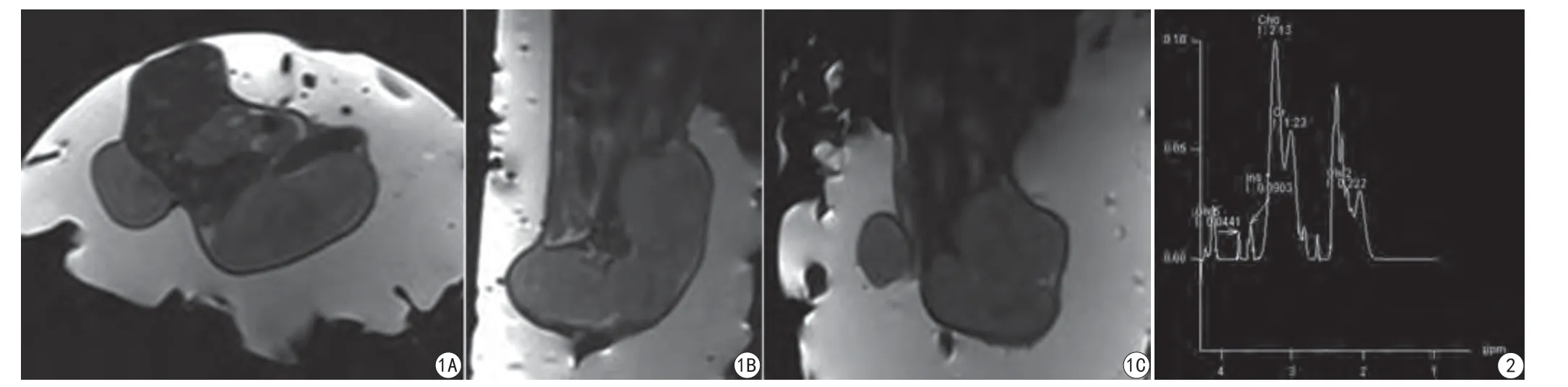
图1 荷瘤鼠肿瘤的T2WI横断位(A)、矢状位(B)及冠状位(C)成像 图2 荷瘤鼠肿瘤的1H-MRS波谱曲线Fig. 1 T2WI transverse (A), sagittal (B) and coronal (C) imaging of tumors in tumor-bearing mice. Fig. 2 1H-MRS spectrum of tumors in tumor-bearing mice.
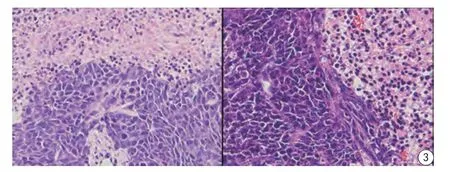
图3 SW480组织切片(左)和SW480/5-FU组织切片(右)Fig. 3 SW480 tissue section (left) and SW480/5-FU tissue section (right).
2.2 肿瘤标本实验检测
2.2.1 肿瘤组织的坏死
HE染色切片显示SW480与SW480/5-FU肿瘤组织坏死区域范围差距不明显;SW480/5-FU细胞核较SW480大,并且细胞间排列更紧密,细胞密度较大(图3)。
2.2.2 肿瘤组织蛋白表达(Western blot)检测
耐药组与不耐药组P-g p、M R P 1、P K C、γ-GCSh、γ-GCSl、GSHS、GST蛋白表达情况见表2。耐药组P-gp、MRP1、PKC、γ-GCSh、γ-GCSl、GSHS、GST表达量均较SW480组增加,两组之间表达差异有统计学意义(P<0.05,表2)。
2.3 肿瘤组织1H-MRS检测代谢物与肿瘤细胞蛋白表达的相关性
肿瘤Cho峰面积与肿瘤P-gp (r=0.636,P=0.048)、MRP1(r=0.821,P=0.004)、γ-GCSh (r=0.841,P=0.002)、γ-GCSl(r=0.799,P=0.006)表达呈正相关。肿瘤Lac峰面积与肿瘤P-gp (r=0.806,P=0.005)、γ-GCSh (r=0.730,P=0.017)表达呈正相关。肿瘤Ins/Cr面积比与肿瘤P-gp (r=0.770,P=0.009)、PKC (r=0.762,P=0.010)表达呈正相关。肿瘤Glx1面积与肿瘤MRP1(r=0.880,P=0.021)、GST (r=0.888,P=0.018)表达呈正相关。肿瘤Glx2面积与肿瘤MRP1(r=0.847,P=0.0 0 2)、γ-G C S h (r=0.6 4 4,P=0.0 4 4)、γ-GCShl(r=0.780,P=0.008)、GSHS (r=0.661,P=0.038)表达呈正相关。
3 讨论
结直肠癌(colorectal cancer,CRC)早期无临床症状,出现症状时,病变常已是中晚期,治疗方法主要以5-氟尿嘧啶化疗为主的综合治疗,但因对化疗药出现耐药性,使结直肠癌的死亡率居高不下。据美国癌症协会估计,死于不同程度的耐药的肿瘤患者占90%。所以,及时检测结肠癌耐药性、调整治疗方案已经成为结直肠癌治疗成功与否的关键因素[2-3]。
目前临床和实验室评价肿瘤耐药性的方法有CCK-8法、MTT法、ATP-TC法、流式细胞监测和TECIA法等[4-5],需要采集肿瘤组织标本,难以用于临床常规监测。肿瘤是一个分化不均质、多形性细胞群体,这些方法仅能反映采集部位肿瘤组织的耐药情况,不能准确反映肿瘤整体的耐药性。部分检查方法需时较长,肿瘤组织离开体内后某些生物代谢物可能发生变化,不能反映体内肿瘤的真实情况。因此,探讨便捷、可靠、能活体评价肿瘤耐药性的方法显得非常必要。
为探讨上述问题,本研究模拟临床化疗中的冲击疗法,对结肠癌SW480肿瘤细胞进行大剂量冲击,经6个月的反复间断在培养液中加入5-FU,获得能够在6 μg/mL 5-FU浓度中稳定生长的人类结肠癌SW480耐药细胞株,RI为4.44。用结肠癌SW480亲本细胞和耐药结肠癌细胞SW480/5-5-FU制作的裸鼠移植瘤模型,后者的肿瘤组织细胞的耐药相关蛋白P-gp、MRP1、PKC的表达明显高于前者,说明研究所获得SW480/5-FU肿瘤组织对5-FU的耐药性真实可靠。
人体组织的化合物在特定的条件下可产生化学位移,1H-MRS可采集这种位移所产生的峰值,并通过计算化合物共振峰的面积或峰高,对组织内某种化合物的含量进行量化分析[6]。1H-MRS是现今已用于临床、可以活体检测组织内代谢物状态的影像学方法,可以检测体内代谢活动所导致的化合物的改变[6-10]。本研究使用1H-MRS活体检测结肠癌SW480亲本和5-FU耐药的荷瘤鼠肿瘤组织代谢物Cho、Lac、Glx、Ins与Cr的改变情况,对比两者代谢物变化的差异。
Cho峰位于3.21 ppm,成分包括胆碱、磷脂酰胆碱、磷酸胆碱类等,反映被检测组织内总的胆碱含量,与磷脂代谢活动密切相关,而磷脂双分子层作为构成细胞膜的基础;测定Cho能间接反映组织细胞膜代谢的活跃程度[6-9]。本研究发现,SW480/5-FU肿瘤组织中Cho面积较亲本SW480肿瘤组织高,两组之间存在显著性差异(P<0.05);HE切片显示SW480/5-FU肿瘤细胞密度明显增高,细胞间隙缩小;肿瘤Cho峰面积与肿瘤P-gp、MRP1、γ-GCSh、γ-GCSl等耐药相关的基因及酶的表达呈正相关。推测可能随着耐药性的增长,肿瘤细胞的代谢活动进一步活跃,细胞膜的转运功能增强同时其合成、分解速率也可能加快,最终致使Cho的增加。
Cr波峰分别存在于3.02 ppm和3.94 ppm处,主要由肌酸和磷酸肌酸。人体三磷酸腺苷(adenosine triphophate,ATP)含量不足时,Cr通过释放高能磷酸键的方式,使ATP能够加速合成以供给能量,Cr的高低反映细胞能量代谢状态。由于其体内Cr的量在各类病理生理情况下均相对稳定,因此常将Cr峰作为参照物,评价其他各种代谢物的改变[6]。Ins波峰位于3.56 ppm处,是细胞内磷脂酰肌醇的前体物质,而磷脂酰肌醇是信号转导通路中的一种途径,参与肌醇-三磷酸循环[6];它是一种与细胞膜的更新和细胞磷脂层结构有关的物质,因此任何一种形式的细胞膜更新的加快或细胞膜磷脂层的破坏都可以导致Ins浓度的升高[11]。Ins常参与PKC的激活,而PKC对肿瘤的侵袭性有调节作用,是耐药相关蛋白。研究表明恶性度高或侵袭性强的原发性脑肿瘤内可发现PKC增高[12]。本研究发现,SW480/5-FU组与亲本SW480/肿瘤组织比较,Ins/Cr面积明显增高(P<0.05),PKC蛋白表达明显增多;肿瘤Ins/Cr面积比与肿瘤P-gp、PKC表达呈正相关。这说明MRS活体监测Ins/Cr的变化可能作为活体检测肿瘤耐药性的分子标志物。
Lac峰出现在1.33 ppm,由于双自旋作用,表现为双尖峰。正常组织一般情况下不出现Lac峰,但在一些情况,如缺血缺氧、炎症、代谢性异常等状态下,可产生大量的乳酸产物而出现Lac峰[6,8]。肿瘤组织代谢旺盛,并且即使在有氧环境下仍然持续的发生糖酵解反应,最终生成大量代谢产物乳酸。而乳酸的聚集与肿瘤多药耐药(multiple drug resistance,MDR)存在密切关系,因临床大多数化疗药物呈弱碱性,大量的乳酸所电离出的氢离子能中和药物中的氢氧根离子,使其不易穿透细胞膜,从而导致肿瘤MDR[13]。此外,肿瘤酸化耐药机制还可能与P-gp有关,Thews等[10]把前列腺癌细胞培养于酸性培养基数小时以后,结果显示P-gp活性加倍,但表达不变,提示酸性条件能诱导P-gp产生更高传输速率。本研究结果显示,SW480/5-FU组织中的Lac峰面积明显高于不耐药的SW480;肿瘤Lac峰面积与肿瘤P-gp、γ-GCSh表达呈正相关。因此,Lac的变化能从活体组织酸碱度的层面作为评价肿瘤耐药性的分子标志物。
Glx峰位于2.1~2.4 ppm及3.65~3.8 ppm处,包括谷氨酸和谷氨酰胺,由于两者存在复合重叠的J偶联共振,常难以区分开[6,8,14]。Glx作为谷胱甘肽(glutathione,r-glutamyl cysteingl+glycine,GSH)的前体物质,参与了细胞氧化还原平衡的调节,Glx峰的增高常见于组织严重缺氧状态[6,8,14]。大量研究证实GSH的增加能使肿瘤细胞抵抗来自放疗或化疗的自由基损伤,导致肿瘤耐药[15]。本研究发现与不耐药组结肠癌移植瘤相比,耐药组移植瘤的Glx1、Glx2峰面积更高,两者之间存在显著性差异(P<0.05);肿瘤Glx1面积与肿瘤MRP1、GST表达呈正相关,肿瘤Glx2面积与肿瘤MRP1、γ-GCSh、γ-GCShl、GSHS表达呈正相关。可见Glx1、Glx2峰可以反映肿瘤细胞耐药相关的谷胱甘肽代谢状态,可能成为活体监测肿瘤耐药性的生物标志物。
本研究尚存在不足:本研究仅观察一种耐药程度SW480/5-FU (RI为4.44)的活体监测情况,下一步将继续培养不同耐药程度的结肠癌细胞,动态观察不同耐药性的磁共振参数变化,以观察相应代谢物与耐药相关性的稳定性和重复性。此外,本研究样本量较小(n=5),尚需扩大样本量重复实验研究,研究肿瘤体积较小,结构成分复杂,固定体素的大小限制使其难以完全排除部分容积效应,可能对结果有一定的影响。
综上所述,1H-MRS检测代谢物中,耐药组移植瘤Cho、Lac、Glx1、Glx2面积及Ins/Cr面积比明显高于不耐药组移植瘤,两者之间差异有统计学意义(P<0.05)。因此,1H-MRS通过检测的肿瘤内代谢物变化,有可能对活体评价结肠癌耐药与否具有重要意义。
利益冲突:无。

