基底动脉弯曲角度与其斑块形成相关性研究
林惠花,杨本强,段阳
机械和血流动力学因素在动脉粥样硬化的发生发展中起着重要的作用[1-4]。早期粥样硬化斑块通常发生在低壁剪切力(wall shear stress,WSS)及高血流阻力处,如弯曲动脉内壁、血管分叉外壁和血管汇合部的顶点处[5-7]。
基底动脉(basilar artery,BA)由双侧椎动脉汇合而成,双侧椎动脉直径差异形成椎-基底动脉连接处血流不对称,这种不对称血流使BA易于向侧方弯曲成角,且弯曲动脉内壁(小弯侧)由于低WSS及高血流阻力容易形成血栓,这种长期慢性过程使BA易于发生动脉粥样硬化和后循环脑干梗死[8-11]。BA位于脑干前部,椎动脉和大脑后动脉均位于脑干后部,BA自然沿其方向表现为向前成角,因此BA可向侧方及前方成角。BA角度(侧角、前角)所代表的BA几何形态变化可能会影响早期粥样硬化斑块形成,并影响BA斑块分布及导致不同区域脑梗死。因此,无BA狭窄的孤立性脑桥梗死患者,将是探索BA角度与其斑块形成相关性研究的最佳对象。高分辨磁共振成像(high resolution magnetic resonance imaging,HR-MRI)可以清晰显示BA管壁及斑块结构,对早期动脉粥样硬化具有较高的分辨率[12]。因此,笔者拟基于HR-MRI、三维时间飞跃法磁共振成像(three dimensions time of flight magnetic resonance angiography,3D TOF MRA)图像,探索BA角度与其斑块形成的相关性。
1 材料与方法
1.1 一般资料
1.1.1 病例选择
连续收集2015年10月至2018年6月我院神经内科收治的经临床及影像检查证实为急性孤立性脑桥梗死患者的临床及影像资料。纳入标准:(1)入院后24 h内行MR检查,包括扩散加权成像(diffusion weighted imaging,DWI)、3D TOF MRA及HR-MRI检查;(2)首次卒中,经DWI检查证实脑桥部位存在急性梗死,且不合并前循环及后循环其他部位梗死;(3) 3D TOF MRA检查显示BA无狭窄;(4)存在一个或多个卒中危险因素,包括高血压、高脂血症、糖尿病、冠心病、吸烟;(5)图像质量好,便于分析。排除标准:(1) BA动脉炎、夹层;(2)可能的心源性栓子来源(房颤、急性心梗、室壁瘤等);(3) MRA检查显示共存的椎动脉或颈内动脉狭窄(≥30%)。所有入组病例均由一名中枢神经放射科主治医师进行选择,由一名主任医师对筛选结果进行复核。入组病例均无病理结果。
研究期间总共纳入急性孤立性脑桥梗死患者153例,排除椎基底动脉狭窄患者49例,血管检查不完善者5例,2例房颤患者,最终共97例患者纳入分析。其中男71例,女26例,年龄34~86岁,平均(61±10)岁。
1.1.2 临床资料
收集所有入组患者入院时卒中危险因素:高血压、高血脂(总胆固醇>5.7 mmol/L或总甘油三酯>1.71 mmol/L)、糖尿病、冠心病、吸烟、高同型半胱氨酸(>20.0 μmol/L)。同时收集患者入院时美国国立卫生研究院卒中量表(National Institute of Health stroke scale,NIHSS)评分及出院改良Rankin量表(modified Rankin Scale,mRS)评分。
1.2 检查方法
GE Discover 750 3.0 T (通用电器公司,美国),配套头部8通道专用线圈(通用电器公司,美国)。所有患者入院24 h内行MR扫描,包括常规MRI平扫(T1WI、T2WI)、DWI、3D TOF MRA、HR-MRI [高分辨率自旋回波(fast spin echo,FSE) T2WI及T1WI]。其相关参数如下:(1) DWI:TR/TE 3400/102 ms,FOV 240 mm×240 mm,矩阵160×160,层厚6 mm,b值=0、1000 s/mm2;(2) 3D TOF MRA序列:TR/TE 22/2.4 ms,FOV 240 mm×240 mm,矩阵256×256,层厚1.2 mm;(3) HR-MRI:T2序列,TR/TE 3400/52 ms,FOV 130 mm×130 mm,矩阵160×160,层厚1.5 mm;T1序列,TR/TE 560/15 ms,FOV 130 mm×130 mm,矩阵160×160,层厚0.8 mm。
1.3 图像分析
1.3.1 基于3D TOF MRA二维投影图像的BA角度测量
(1) BA侧角:在3D TOF MRA的前后位视图测量双侧椎动脉汇合部与BA主干延长线的夹角;(2) BA前角:在3D TOF MRA的侧位视图测量优势椎动脉与BA主干延长线的夹角。优势椎动脉的定义为一侧椎动脉直径较另一侧增粗至少0.3 mm,或者两侧椎动脉直径相当,一侧椎动脉与基底动脉连接更直接(图1A、1B)。BA角度测量由两名神经放射科医生分别测量并取其平均值作为最终结果。
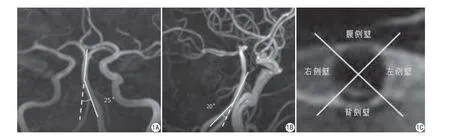
图1 A:3D TOF MRA BA侧角(前后位视图);B:3D TOF MRA BA前角(侧位视图);C:HR-MRI T2WI轴位BA斑块分布图Fig. 1 A: Lateral angle (from the anteroposterior view) on the 3D TOF MRA image; B: Anterior angle (from the lateral view) on the 3D TOF MRA image; C: Location of BA plaques in T2WI axial images of HR-MRI.

表1 两组患者一般资料比较Tab. 1 Comparison of baseline characteristics of patients between the two groups

表2 基底动脉斑块形成相关因素的Logistic回归分析Tab. 2 Logistic regression analysis of factors related to formation of basilar artery plaque

表3 基底动脉斑块分布相关因素的组间比较Tab. 3 Comparison of factors related to distribution of basilar artery plaques
1.3.2 基于HR-MRI图像的BA责任斑块位置
责任斑块的定义应符合以下标准:(1)在脑桥供血区发生梗死;(2)在脑桥梗死相同层面或相邻的上下层面可见BA斑块。以90°角将BA管腔横断面分为腹侧壁、背侧壁、左侧壁及右侧壁4个象限,若斑块同时分布于两个以上部位,以斑块占管壁多的部分确定斑块分布位置(图1C)。因HR-MRI T2WI FSE序列轴位层厚为1.5 mm,因此,斑块长度=责任斑块所在层面×层厚(1.5 mm)。
1.4 统计学方法
采用SPSS 17.0进行统计分析。计数资料以频数表示,计量资料中符合正态分布的采用均数±标准(±s)表示,不符合正态分布的以四分位间距[M(Q1-Q3)]表示。有斑块组与无斑块组的连续性变量比较采用t检验,分类变量比较采用χ2检验,采用多因素二元Logistic回归分析确定BA斑块形成的独立危险因素。BA斑块分布(无斑块、腹侧壁、背侧壁、侧壁)相关因素的组间比较采用单因素方差分析及最小显著差值法(LSD)进行之后的两两多重比较分析。P<0.05为差异具有统计学意义。
2 结果
2.1 BA斑块形成相关因素的单因素及多因素分析
依据有无BA斑块将入组患者分为无斑块组及有斑块组。BA斑块形成相关因素的单因素及多因素二元Logistic回归分析结果详见表1、2。在单因素分析中,BA侧角(前后位视图)、BA前角(侧位视图)、出院mRS评分在有斑块组与无斑块组的组间差异有统计学意义(P<0.05),而年龄、性别、脑卒中危险因素(高血压、高血脂、糖尿病、冠心病、吸烟、高同型半胱氨酸)在有斑块及无斑块的组间差异无统计学意义(P>0.05)。校正其他相关因素后,进行多因素二元Logistic回归分析结果表明,BA侧角及前角是BA斑块形成的独立危险因素(BA前角:OR值=0.095,95%CI=1.032~1.171;BA侧角:OR值=0.132,95%CI=1.053~1.236)。
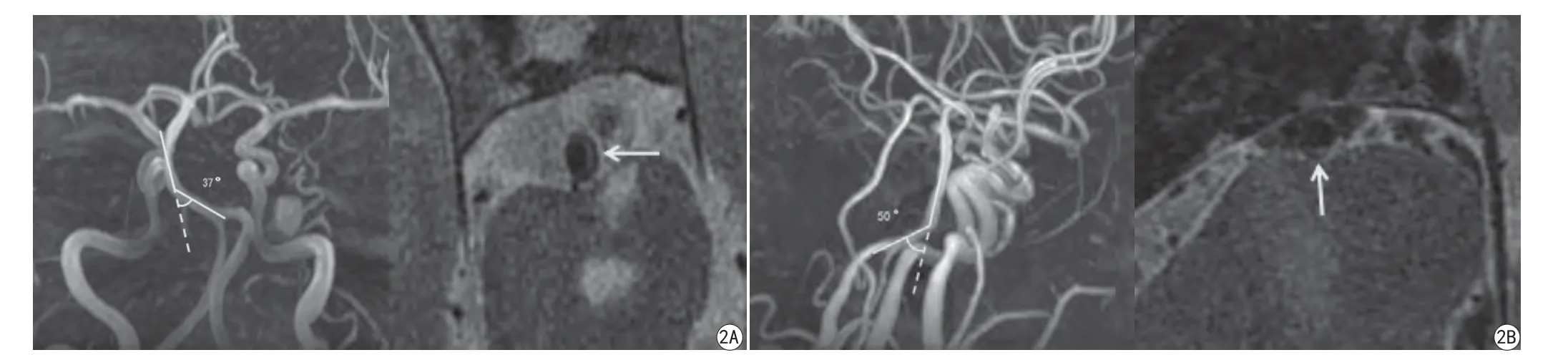
图2 A:基底动脉侧角(前后位视图)越大,斑块越可能在侧壁(小弯侧)形成;B:基底动脉前角(侧位视图)越大,斑块越可能在背侧壁形成Fig. 2 A: Greater the lateral angle (anteroposterior view) may enhance lateral plaque formation (inner curvature); B: Greater the anterior angle (lateral view) may enhance dorsal plaque formation.
2.2 BA斑块分布相关因素的组间比较
根据有无斑块及斑块分布位置,将所有患者分为无斑块组、腹侧壁组、背侧壁组、侧壁斑块组。BA斑块分布相关因素的组间比较结果详见表3。斑块长度在腹侧壁、背侧壁、侧壁斑块的组间比较差异无统计学意义(P=0.924)。出院mRS评分在斑块分布(无斑块、腹侧壁、背侧壁、侧壁)的组间差异无统计学意义(P=0.051)。BA侧角、BA前角在BA斑块分布(无斑块、腹侧壁、背侧壁、侧壁)的组间差异有统计学意义(P=0.002、0.000),在此之后的两两多重比较中,侧壁斑块组的BA侧角大于无斑块组,差异有统计学意义[(27±8)°VS (16±11)°,P<0.001],如图2A。背侧壁斑块组的BA前角大于无斑块组,差异具有统计学意义[(27±9)°VS (16±7)°,P<0.001],如图2B。
3 讨论
本研究结果显示,在急性孤立性脑桥梗死患者中,BA侧角与前角是BA斑块形成的独立危险因素,且BA角度变化与BA斑块分布位置相关。BA侧角(前后位视图)越大,更可能导致BA斑块在侧壁形成;BA前角(侧位视图)越大,斑块更可能在BA背侧壁形成。
3.1 BA斑块形成的血流动力学与机械因素
动脉粥样硬化是一种慢性、炎症、纤维增生性系统疾病,主要发生在大、中型导管动脉[13]。动脉粥样硬化斑块在具有复杂流动模式或低WSS局部区域发展,如弯曲动脉内壁、血管分叉外壁和血管汇合部的顶点处[5-7]。WSS是由切向内皮作用血流引起的摩擦力,血流动力学改变所致的低WSS区与血管危险因子结合,可激活随后的炎症级联反应而导致动脉粥样硬化进展[14-15]。
与大多数具有树枝状的动脉系统不同,BA是唯一由两个动脉(椎动脉)汇合而成的动脉,也是脑干的主要供血动脉。BA在其走行过程中与周围结构的解剖关系而形成角度,BA位于脑干前部,椎动脉和大脑后动脉均位于脑干后部,BA自然沿其方向表现为向前成角。文献报道[16]只有6%~26%的双侧椎动脉管腔直径相等,左侧椎动脉直径常较右侧粗,这种不对称血流产生不均匀机械力引起的慢性过程可能使BA发生侧向移位,BA这种形态改变可能引起动脉粥样硬化及相应部位脑梗死。因此,BA可向前方成角(前角)和向侧方成角(侧角),BA的血流动力学可根据上述BA前角及侧角来解释。文献报道[8]BA前角及侧角可精确定位BA弯曲的低WSS区域,且随访MRA证实,BA粥样硬化斑块在低WSS区进展。
3.2 BA角度变化影响其斑块分布位置
本研究结果显示,BA侧角(前后位视图)越大,斑块越可能在侧壁形成,与既往研究结果一致[8,17],这可以用以下血流动力学机制来解释。(1)BA侧角越大,提示BA弯曲程度越大,弯曲动脉小弯侧由于低WSS可能更容易形成血栓;(2)弯曲BA压迫和牵拉脑桥穿支动脉开口处,更可能导致相应部位脑桥梗死[18]。本研究结果显示,BA前角(侧位视图)越大,BA斑块越可能在背侧壁形成。笔者认为其机制可能是:(1)脑桥旁中央动脉开口于BA背侧壁并直接穿入脑桥被盖,且脑桥被盖部无侧支血管,因此BA前角越大,血流从BA穿行至脑桥被盖的距离越长,长而迂曲的穿支动脉可使组织缺氧更容易发生[19-20];(2)脑桥旁中央动脉几乎呈直角从BA主干背侧壁发出,易于发生灌注不足,且在高血压、糖尿病等脑血管疾病危险因素的作用下易于形成硬化性斑块[21]。
基于以上论点,笔者认为BA前角及侧角所代表的BA几何形状改变影响血管内血流动力学,并可能决定临床前动脉粥样硬化斑块位置。
本研究存在的局限性:第一,本研究为单中心回顾性分析,样本量相对较小,可能存在选择偏倚;第二,未对BA斑块成分及斑块稳定性进行分析;第三,虽然测量了BA角度,但未对血管内血流动力学进行直接研究,未来仍需要非侵入性定量研究血管内血流动力学以阐明BA角度与其斑块形成的深层关联。
总之,BA侧角及前角是BA粥样斑块形成的独立危险因素。BA前角(侧位视图)越大,斑块更可能在BA背侧壁形成。侧角(前后位视图)越大,斑块更可能在BA侧壁形成。
利益冲突:无。

