心脏磁共振评价心尖肥厚型心肌病患者左心房室结构、功能及其相关性研究
王辉,徐磊*,贺毅,董建增
心尖肥厚型心肌病(apical hypertrophic cardiomyopathy,AHCM)是指肥厚部位主要位于心尖部的一种肥厚型心肌病。其最早由日本学者Sakamoto等[1]及Yamaguchi等[2]分别于1976年及1979年提出。AHCM在中国人肥厚型心肌病中的比例高达45%[3],由于超声心动对心尖部的视野欠佳,其诊断心尖肥厚型心肌病AHCM有其局限性,可能会漏诊[4-5]。相对超声心动,心脏磁共振(cardiac magnetic resonance,CMR)对AHCM的检出率更高,且结合心电图检查及特殊的磁共振征象能够更加早期地发现心尖肥厚型心肌病的结构性改变[6-8]。
AHCM引起的主要功能性改变是左心室舒张功能减低[9]。左心室舒张功能可通过超声心动评价二尖瓣流入血流、二尖瓣环组织多普勒速度成像、肺静脉血流速率、肺动脉收缩压及左心房大小和容积[10]来测量,但仅为I,C类证据[9]。近年来,新的研究结果显示,左心房应变力分析是准确评价左心室舒张功能的有效手段,与传统的超声心动参数不同,它随着左室舒张功能下降的严重程度不断变化[11-13]。
本研究的目的是用心脏磁共振评估AHCM患者心脏形态及左心室舒张功能变化,并评估左心室舒张功能与心尖部厚度及左房形态、功能之间的关系。
1 材料与方法
1.1 一般资料
回顾性分析69例AHCM患者和25名对照组受试者,所有病例均来自2015年9月至2018年7月于我院就诊并完成心脏磁共振、心电图及超声心动检查的患者。所有患者于心脏磁共振检查前均签署知情同意书。所有患者AHCM的诊断基于心电图表现及CMR或超声心动的形态学特征。纳入标准:(1)心电图表现为V2-V4导联宽大倒置T波;(2) CMR或超声心动表现为舒张末期心尖部心肌厚度大于15 mm,或舒张末期心尖部心肌厚度与基底部心肌厚度比值≥BR张[9,14];排除标准:(1)有证据(冠状动脉多层螺旋CT血管造影或冠状动脉造影)表明为冠心病患者;(2)高血压;(3)心脏术后;(4)心电图显示宽大倒置T波同时合并传导阻滞;(5)超声心动显示心脏瓣膜疾病。同时,收集相同时期正常人25名作为对照组,对照组的心电图、超声心动图均表现正常,同时无高血压、心衰史、无心绞痛、心肌梗死、冠状动脉重建术或其他已知心肌病,其CMR检查经5年以上心脏磁共振诊断经验的高年资影像诊断医生确诊为正常。
1.2 仪器与方法
所有扫描均在3.0 T西门子磁共振扫描仪(Magnetom Verio)或3.0 T GE磁共振扫描仪(750 W)进行,采用32通道表面相控阵心脏线圈和心电门控技术。患者仰卧位,依次采集横断面黑血序列、多层面电影序列(左心室四腔心、两腔心、左心室短轴及双口位),左心室短轴电影图像覆盖了从二尖瓣环到心尖的整个心室,每个心脏周期有25个期像;首过法心肌灌注及延迟增强序列。延迟增强图像在注射对比剂钆(Gadolinium-DTPA,钆喷酸葡胺,中国,北陆药业)0.2 mmol/kg 10~15 min后采集,序列采用屏气状态下反转恢复序列,采集层面与心脏电影相同,翻转时间在240~300 ms。
1.3 图像后处理及测量
左心室射血分数(left ventrical ejection fraction,LVEF)、左心室心肌质量、左心室心肌厚度采用在商用的工作站CVI42软件上进行(Circle Cardiovascular Imaging,5.63版,卡尔加里,加拿大)。采用左心室短轴位和4腔心或2腔心或3腔心序列进行半自动分析。心内膜和心外膜边界由软件进行自动绘制并由有经验的心脏磁共振医生进行修正,同时由心脏磁共振医生标记右心室插入点,以作为前间隔和下间隔壁的边界。在4腔心或2腔心或3腔心图上标记左心室范围,在绘制心内膜和心外膜边界后,软件自动计算出LVEF。心肌厚度在标准的4腔心和4腔心层面测量。CMR心肌厚度测量均由有5年以上心脏磁共振诊断经验的高年资影像诊断医生完成,测量两次,取平均值作为最终心肌厚度。
采用专用CMR后处理软件(Qmass 7.6, Medis,荷兰)进行左心房应变分析。在确定收缩期和舒张期后,由放射科医生在2腔心序列图像上手工绘制心内边界,注意将左心耳和肺静脉从心房腔内排除(图1A、1B)。自动计算并记录舒张末期左房容积(left atrial end diastolic volume,LAEDV)、收缩末期左房容积(left atrial end systolic volume,LAESV)、左房射血分数(left atrial ejection fraction,LAEF)、左房整体峰值纵向应变(left atrial peak global longitudinal strain,LAPGLS)、左房整体峰值周向应变(left atrial peak global circumferential strain,LAPGCS)及左房面积变化分数(fraction area change,FAC)(图1C)。
1.4 统计学分析
2 结果
共收集AHCM患者77例,其中高血压3例,冠心病2例,房间隔缺损1例,图像质量差1例,心电图缺失1例,最终共纳入AHCM患者69例(男52例),年龄(51.89±14.83)岁。正常对照组25例(男11例),年龄(41.4±9.69)岁。
2.1 左心室结构、功能、左房功能比较
心尖肥厚型心肌病组左心室心尖部厚度、左心室心肌质量、LVEF、LAESV均明显高于正常对照组,LAPGLS及FAC均明显低于正常对照组(图2),两组之间的差异均有统计学意义(P<0.05),而两组之间的LAPGCS差异则没有统计学意义(P>0.05),见表1。
2.2 左心房应变与左室结构、功能及左房结构、功能之间的关系

图1 图像后处理过程。A:舒张末期左心房心内边界勾画;B:收缩末期左心房心内边界勾画;C:左心房应变计算 Fig. 1 Image post-processing. A: Delineation of the intracardiac boundaries of the left atrium at the end of diastolic phase; B: Delineation of the intracardiac boundaries of the left atrium at the end of systolic phase; C: Left atrium strain calculation.
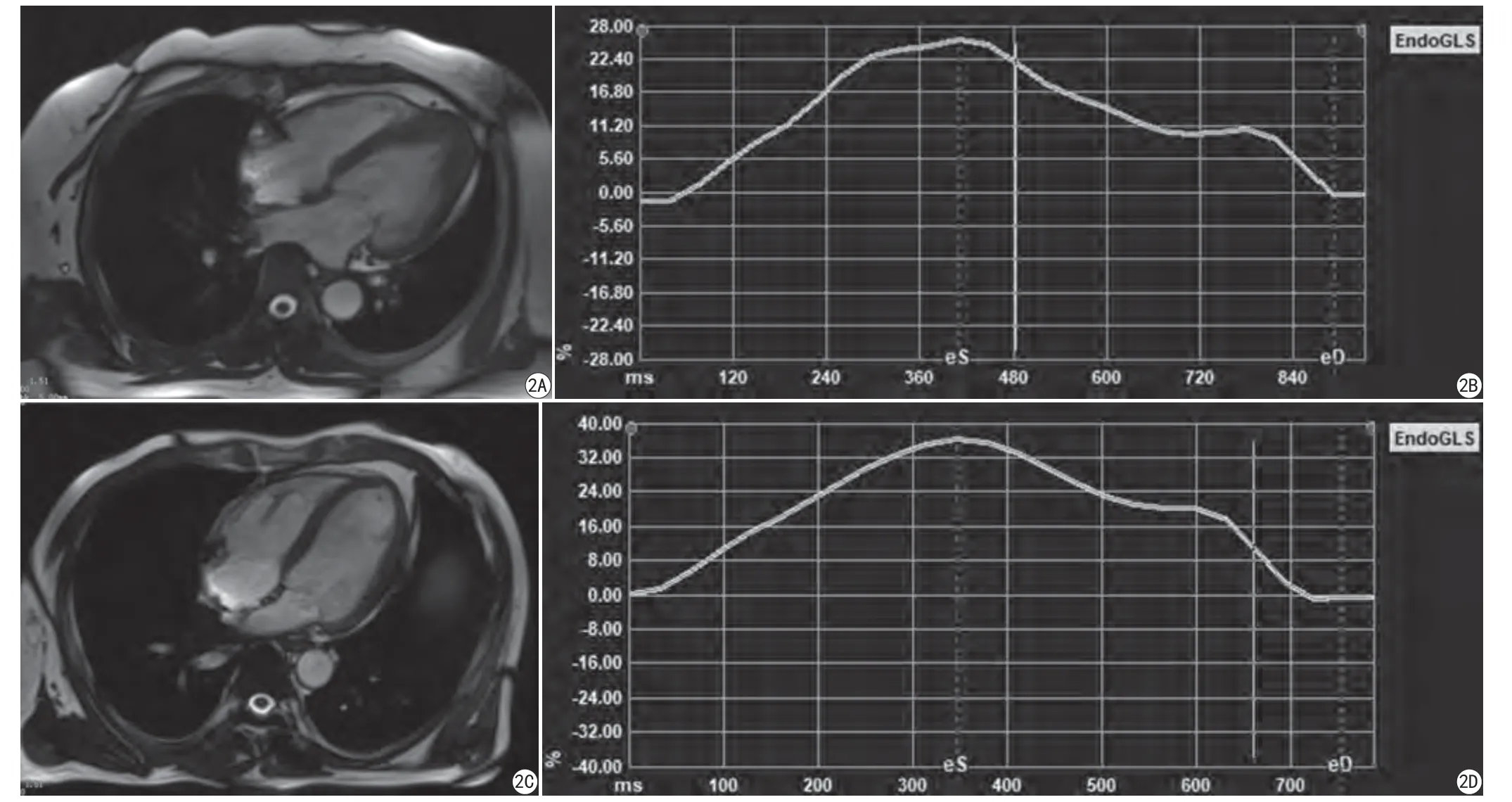
图2 心尖肥厚型心肌病(AHCM)组与对照组心肌厚度及左房整体峰值纵向应变对比。A:AHCM患者4腔心图像;B:AHCM患者左心房整体纵向应变曲线;C:正常对照组4腔心图像;D:正常对照左心房整体纵向应变曲线Fig. 2 Comparison of myocardial thickness and left atrial peak global longitudinal strain (LAPGLS) between the apical hypertrophic cardiomyopathy (AHCM) group and the control group. A: 4-chamber CMR image of AHCM; B: LAGLS curve of AHCM; C: 4-chamber CMR image of control group; D: LAGLS curve of control group.
LAPGLS与LVEF无明显相关性(P>0.05),与左心室心尖部心肌厚度呈弱相关(r=-0.28,P=0.02,图3A),与收缩末期左心房容积呈弱相关(r=-0.27,P=0.03,图3B),与左心房FAC之间极强相关(r=0.92,P=0.00,图3C)。LAPGCS与FAC呈正相关(r=0.77,P<0.01,图4)。

图3 LAPGLS与左心室心尖部心肌厚度(A)、LAESV (B)、FAC (C)相关性散点图Fig. 3 Scatter plot between LAPGLS and thickness of left apical ventricular wall (A), LAESV (B) and FAC (C).
表1 AHCM组与对照组左心室指标比较(±s)Tab. 1 Comparison of left ventricular indexes between AHCM group and control group (±s)

表1 AHCM组与对照组左心室指标比较(±s)Tab. 1 Comparison of left ventricular indexes between AHCM group and control group (±s)
组别 左心室心尖部心肌厚度(mm)心尖部与基底段心肌厚度比值 左心室心肌质量(g) LVEF (%) LAESV (mL) LAPGLS LAPGCS FAC AHCM组 16.38±4.34 1.99±0.43 125.96±37.41 68.93±6.93 81.76±28.33 26.99±11.11 28.13±11.19 35.56±10.22对照组 5.91±1.08 0.89±0.1 85.4±20.07 64.09±6.69 63.07±20.66 38.17±15.48 45.83±33.16 46.56±7.88 t值 11.88 12.42 5.15 3.02 3.02 -3.86 -3.89 -4.88 P值 0.00 0.00 0.00 0.00 0.00 0.00 0.08 0.00
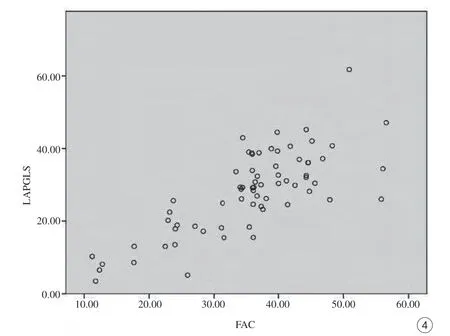
图4 LAPGCS与FAC相关性散点图Fig. 4 Scatter plot between LAGCS and FAC.
3 讨论
3.1 AHCM引起的心脏主要功能改变及其与心肌厚度相关性
AHCM引起的主要功能性改变是左心室舒张功能减低[9],这与本研究结果一致,即AHCM的LAPGLS明显低于正常对照组。然而,本研究结果同时发现,LAPGLS与左心室的心尖部厚度虽然有一定的相关性(P<0.05),但相关性比较差(r=-0.28),且与收缩期左房容积相关性也仅呈弱相关(r=-0.27,P<0.05),这一结果与最近的一项研究结果相符。Chacko等[15]研究同样发现,左心室的最大充盈时间与肥厚型心肌病的心肌厚度呈低度相关(r=0.38,P=0.02);而早期的研究虽然显示肥厚型心肌病左心室舒张功能下降程度与肥厚的心肌厚度相关,但同时也与非增厚的心肌相关[16]。
3.2 AHCM患者左心房功能变化与左心房应变改变之间的关系
左心房的功能可分为3个阶段,首先,作为储存容器,容纳肺静脉回流入左房的血液;进而,作为一个导管,左心房被动地输送血液进入左心室;最后,在左心室舒张的最后阶段,左心房可通过主动脉收缩,从而将血液泵入左心室[17]。LAPGLS可反映前两个阶段(左心房容受功能)尤其是第二个阶段的心房功能[18]。在AHCM患者中,随着左心室舒张功能的下降,LAPGLS可逐渐下降,即左心房接受肺静脉回心血流的能力下降,且作为导管功能被动输送血液至左心室的能力下降。而LAPGCS则反映第3个阶段左心房主动脉收缩能力[18-19];AHCM组与正常对照组之间没有差异,也恰恰说明AHCM影响的主要是左心室舒张功能,进而影响左心房的LAPGLS,而不引起左心房自身的收缩功能下降,即不引起LAPGCS降低。
3.3 左心房FAC与左心室舒张功能之间的关系
本研究结果显示,代表左心室舒张功能的LAPGLS与心尖肥厚型心肌病患者的心尖肥厚程度呈弱相关,而与左心房的FAC呈高度相关(r=0.92,P=0.00)。而代表左心房收缩功能的LAPGCS也与FAC呈强相关(r=0.77,P=0.00)。FAC是一种简单易行的反映左心房功能的指标,其计算方法为两腔心或者四腔心层面(左心房最大面积-左心房最小面积)/左心房最大面积×100%[20]。FAC综合了心房的容受功能及其收缩功能,与容受功能的相关性更强烈。因而,左心房FAC在很大程度上可以代替需要专门软件分析的左心房应变力分析,来作为判断左心室舒张功能是否下降的指标。
总之,心尖肥厚型心肌病患者左心室舒张功能下降,而左心房收缩功能未发生明显变化。左心房FAC可作为LAPGLS的替代指标来判断左心室舒张功能是否下降。
利益冲突:无。

