食管癌根治性放化疗近期疗效和不良反应剂量学分析
陈敬彬 孙健泳 黄伟驹 章耀鸿
食管癌源于食道腺上皮或鳞状上皮的异常增生,其发病和病死率平均水平列恶性肿瘤前列,有明显的地区差异,且潮汕地区为高发区[1-2]。食管癌的治疗手段主要是手术切除、放射治疗和化学药物治疗,治疗失败的主要原因是局部复发和未控,失败者达60%~80%。因此,提高食管癌的局部控制率是提高疗效的关键。本研究对180例根治性放化疗食管癌治疗结果和预后进行分析研究,评价其近期疗效和不良反应。
1 资料与方法
1.1 一般资料
选取2011年1月至2015年12月潮州市人民医院放疗科接受根治性放化疗的180例患者(经病理或细胞学证实的鳞状细胞癌178例,腺癌2例),其中男性125例,女性55例;年龄40~90岁,中位年龄66岁;卡氏评分60~79分11例,80~90分159例;颈段1例,上段32例,中段110例,下段37例;后程加速超分割31例,常规分割149例;采用调强放射治疗技术120例,三维适形放射治疗技术60例;序贯放化疗59例,同步放化疗77例,单纯放射治疗44例;临床分期Ⅰ期6例,Ⅱ期82例,Ⅲ期82例,Ⅳ期10例。依据患者不同临床特征进行分组。①按照肿瘤照射剂量的不同分为低剂量组(106例,肿瘤剂量≤6000 cGy)和高剂量组(74例,肿瘤剂量>6000 cGy);②按照肿瘤长度的不同分为≤10 cm组(92例,肿瘤长度≤10 cm),≤20 cm组(56例,肿瘤长度≤20 cm),>20 cm组(32例,肿瘤长度>20 cm);③按照双肺受量的不同分为≤20 Gy组(42例,双肺20 Gy受量≤20%),≤25 Gy组(60例双肺20 Gy受量≤25%),≤30 Gy组(46例,双肺20 Gy受量≤30%),>30 Gy组(32例,双肺20 Gy受量>30%);④按照脊髓最大受量的不同分为<4000 Gy组(58例,脊髓最大点剂量<40 Gy),<4500 Gy组(58例,脊髓最大点剂量<45 Gy),<5000 Gy组(58例,脊髓最大点剂量<50 Gy),≥5000 Gy组(58例,脊髓最大点剂量≥50 Gy。
1.2 纳入与排除标准
(1)纳入标准:①经临床病理确诊的初治食管癌,且无远处转移;②无其他恶性肿瘤病史;③身体情况良好,卡氏评分>60分,能进食半流食;④无严重内科疾病;⑤治疗前肝、肾功能及血常规正常;⑥有完整临床病历和系统剂量学资料。
(2)排除标准:①非鳞癌患者;②单纯放化疗患者。
1.3 仪器设备
采用21EX医用直线加速器(美国瓦里安);Eclipse 8.6逆向调强计划系统(美国Varian);模拟定位机(山东新华);红色激光灯(德国Lamp);热缩体膜固定装置(上海戈瑞医疗器械有限公司);电离室矩阵(德国PTW);Unidos Webline绝对剂量仪(德国PTW);64排螺旋CT(德国西门子)。
1.4 治疗方法
1.4.1 放射治疗方案
所有患者均采用6 MV X射线,调强或三维适形放射治疗,计划靶区(planning target volume,PTV)剂量58~70 Gy,28~35 F,5.8~7 W。90%~95%的等剂量线三维包绕靶区,以剂量-体积直方图(dosevolume histogram,DVH)和等剂量线综合评价治疗计划。
1.4.2 化疗方案
多年来食管癌放射治疗后总的生存率并无明显提高,对于中晚期食管癌失败的主要原因是局部未控,其次是转移[3]。同步放化疗进一步增加局部病灶控制,减少转移与复发。本研究中同步化疗采用多西他赛或者奈达铂单药单周治疗;诱导化疗采用多西他赛联合奈达铂用药;辅助化疗采用多西他赛联合奈达铂用药。
1.5 观察与评价指标
(1)近期疗效标准。食管癌近期疗效按照实体瘤的疗效评价标准(response evaluation criteria in solid tumors,RECIST)评价,分为完全缓解(complete remission,CR)、部分缓解(partial remission,PR)、疾病稳定(disease stability,SD)及疾病进展(disease progression,PD)。
(2)急性反应分级。急性放射性损伤按照美国放射治疗协作组(Radiation Therapy Oncology Group,RTOG)标准评定。
(3)对比分析肿瘤长度和剂量、肺V20及脊髓Dmax对近期疗效和急性不良反应的影响;放射治疗方式对患者治疗费用和治疗日的影响。
1.6 统计学方法
采用SPSS 22.0统计软件对数据进行统计学处理与分析,计数资料的比较采用x2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 随访情况
治疗后对180例患者进行5~71个月随访,中位随访时间36个月,其中2例失访,随访率为98.9%。失访病例以最后一次随访仍存活的时间按截尾数据处理。
2.2 近期疗效
按照RECIST标准评价近期疗效,分为CR、PR、SD及PD。全组总有效率为83.9%(151/180),其中CR为2.2%(4/180)、PR为81.7%(147/180)、SD为11.11%(20/180)及PD为2.8%(5/180),见表1。

表1 不同剂量组近期疗效比较(例)
2.3 生存率
高剂量组和低剂量组总生存率比较,差异无统计学意义(x2=0.273,P>0.05),见图1。
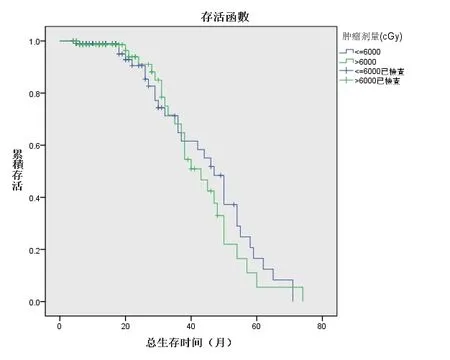
图1 高剂量组和低剂量组总生存率
2.4 放射性肺炎
180例患者中28例(占15.56%)发生放射性肺炎,其中2级以下占89.44%(161/180),2级及以上占10.56%(19/180)。主要影响因素为双肺受量V20(V20指照射总剂量高于20 Gy的肺体积占全肺总体积的百分数),差异有统计学意义(x2=10.072,P<0.05);肿瘤剂量(Dt)差异有统计学意义(x2=10.771,P <0.05);肿瘤长度(Lt),差异有统计学意义(x2=17.253,P<0.05),患者放射性肺炎统计情况见表2。
2.5 骨髓抑制
180例患者中28例(占15.56%)发生骨髓抑制,其中2级以下占89.44%(161/180),2级及以上占10.56%(19/180)。主要影响因素为脊髓最大点剂量(Dmax)差异有统计学意义(x2=16.429,P<0.05);肿瘤剂量(Dt),差异有统计学意义(x2=9.541,P=0.05)、肿瘤长度(Lt),差异有统计学意义(x2=9.354,P<0.05),患者骨髓抑制统计见表3。
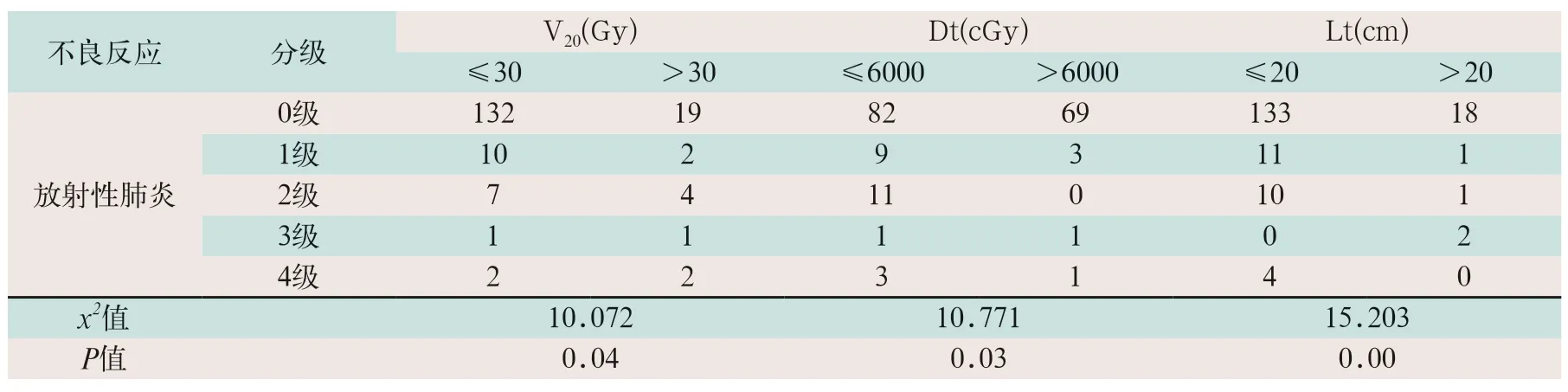
表2 放射性肺炎统计

表3 骨髓抑制统计
2.6 超分割放射治疗与常规分割放射治疗费用及住院天数
(1)后程超分割放射治疗方案:第一阶段行常规分割放射治疗,剂量为36 Gy/18 F/3.6 W;第二阶段为后程加速超分割放射治疗,剂量为30 Gy/20 F,1.5 Gy/F,2次/d,两次放射治疗间隔>6 h,5 F/W,总治疗为28 d。
(2)常规分割放射治疗方案:剂量为66 Gy/33 F,2.0 Gy/F,1次/d,5 F/W,总治疗为33 d。超分割放射治疗较常规放射治疗缩短治疗为5 d,有效缩短患者疗程。
3 讨论
3.1 剂量与疗效
放射治疗是治疗食管癌的一种重要手段,其放射治疗剂量为60~70 Gy,6~7周最佳[4]。但Pearson和Mareial等[5]提出50 Gy,4~5周治疗效果最佳,国内一些研究也发现类似结论,万钧[6]和沙永慧等[7]报道的前瞻性随机对照临床研究结果表明。肿瘤外照射70 Gy和50 Gy的生存率并无统计学差异。本研究也显示,高剂量组(>6000 cGy)、低剂量组(≤6000 cGy)的近期疗效、远期疗效均无显著差异,低剂量组的放射治疗不亚于高剂量组。
3.2 剂量与不良反应
美国放射肿瘤学协作组(RTOG)在一个前瞻性的研究中发现,V20的大小不仅与放射性肺炎的发生率相关,而且与放射性肺炎的严重程度明显相关[8]。本研究也得到类似结果,按照照射总剂量>20 Gy的肺体积占全肺总体积的百分数分组(≤30 Gy、>30 Gy),统计显示患者获得放射性肺炎的严重程度与V20大小密切相关,故有统计学差异。此外,放射性肺炎也受到肿瘤剂量、肿瘤长度的影响,也具有统计学差异。分析认为,肿瘤剂量的提高和长度的增加提高V20水平,间接导致放射性肺炎发生。另一主要不良反应为骨髓抑制,2级以上骨髓抑制的发生概率为15%(27/180),均较文献报道为低。骨髓抑制主要影响因素是骨髓最大点剂量Dmax和肿瘤剂量、肿瘤长度。分析原因可能为骨髓抑制一般是急性反应,而后期出现的骨髓抑制多出现在多程化疗的患者身上,而本组病期普遍较晚,预后差,多数患者在此之前已死亡有关。
在本研究采用的剂量范围内,高剂量并不能带来食管癌放射治疗患者高获益,高治疗剂量则显著增加损伤,因此不可取[9]。鉴于以上结果,本研究认为,食管癌放射治疗不宜追求过高剂量,但食管癌外照射放射治疗的合适剂量仍值得探讨,因为局部未控制或复发仍是治疗失败的主要原因。低剂量组更能体现放射肿瘤学总原则和临床剂量学原则的要求,降低周围正常组织的受量,减少放射治疗副反应,且能缩短疗程,减少患者的治疗费用。

