参附注射液通过调控自噬减轻大鼠心肌缺血再灌注损伤的作用研究①
贾合磊 卢长青 王 娟 任冬冬 陈亚奇
(河南省中医院/河南中医药大学第二附属医院急诊科,郑州450002)
心肌缺血再灌注损伤(Myocardial ischemic reperfusion in jury,MIRI)指冠状动脉急性阻塞后短时间内心肌供血中断,当心肌缺血恢复血流供应后,造成组织结构损伤加重的现象[1]。MIRI是临床常见的心脏疾病,常见于冠状动脉血管形成术、冠状动脉重建术、心脏移植手术等术后并发症[2],对术后疗效产生了严重的影响。MIRI的发病机制复杂,尚需更深入的研究,目前已知氧自由基累积造成过氧化损伤、中性粒细胞浸润、钙超载触发线粒体功能障碍及钙泵障碍、细胞程序性死亡均与MIRI有着重要联系[3]。作为程序性死亡的一种,自噬在MIRI的起始和进展中发挥着重要作用[4]。参附注射液(Shenfu injection,SFI)是中国传统中药红参与附子的提取物,主要活性成分是人参皂苷和乌头类生物碱,具有抗缺血、抗缺氧、清除氧自由基、抗脂质过氧化、抗细胞内Ca2+超载等多种药理作用[5],常被用于心脏相关的疾病治疗中。许多研究表明,SFI对MIRI具有显著的疗效[6],而参附注射液对MIRI的精确分子机制仍有很多不清楚的地方。已有相关文献报道参附能够通过调节自噬减轻大鼠缺氧复氧心肌细胞损伤[7],提示SFI可能通过调控自噬对MIRI起治疗作用。为了进一步验证这一结论,我们通过构建动物疾病模型和细胞模型,从体内体外两个方向研究SFI对自噬的调控作用。
1 材料与方法
1.1材料
1.1.1主要试剂 参附注射液购自雅安三九药业有限公司,规格100 ml/支,批号:国药准字Z20043116。DMEM培养基和胎牛血清购自美国Hyclone公司。胰蛋白酶购自美国Amersco公司。乌拉坦购自Sigma-aldrich公司。5-BrdU购自美国Selleck公司。HE染色试剂盒、肌酸激酶(Creatine Kinase,CK)、心肌肌钙蛋白Ⅰ(Cardiac troponin Ⅰ,cTnⅠ)、血清乳酸脱氢酶(Lactate dehydrogenase,LDH)、丙二醛(Malondialdehyde,MDA)和超氧化物歧化酶(Superoxide dismutase,SOD)检测试剂盒购自南京建成生物工程研究所。IL-6、 IL-1β、肿瘤坏死因子α(Tumor necrosis factor-α,TNF-α)试剂盒购自上海酶联生物。雷帕霉素(Rapamycin)购自美国Cayman chemical公司。MTT试剂盒、RIPA裂解液、ECL显色液购自北京索莱宝生物公司。BCA试剂盒购自北京全式金生物技术有限公司。甘油醛-3-磷酸脱氢酶(Glyceraldeh-yde-3-phosphate dehydrogenase,GAPDH)、微管相关蛋白1轻链3(Microtubulerassociated protein 1 light chain 3,LC3Ⅱ)、LC3Ⅰ、Beclin1、p62、磷脂酰肌醇-3-羟基激酶(Phosphatidylinositol-3-kinase,PI3K)、蛋白激酶B(Protein kinase B,Akt)、p-PI3K、p-Akt、哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)、p-mTOR抗体购自Abcam公司。其他试剂均为国产分析纯。
1.1.2动物、分组和模型制备 40只(体质量 200~250 g)健康雄性大鼠购自上海杰思捷实验动物有限公司,合格证号:SCXK(沪)2018-0004。于恒温恒湿、明暗交替(12 h)的环境喂养48 h。40只大鼠随机分为5组,每组8只。正常对照组、心肌缺血再灌注(Myocardial ischemic reperfusion,I/R)组、SFI 5、10和20 mg/kg组,除正常对照组外,其余组大鼠参照郑曙云等[8]的研究,采用结扎冠状动脉前降支复制I/R模型。大鼠用20%乌拉坦(1.0 g/kg)腹腔麻醉后,气管插管,行人工控制呼吸。左侧第四肋间开胸手术,剪开心包,暴露心肌,用圆形无创缝合针穿一段6/0丝线,置于左冠状动脉前降支起始段下2 mm处。稳定10 min后,除正常对照组外,其余组结扎冠状动脉前降支,以EKGII导联1ST段明显太高(≥0.1 mV)或T波高耸,心肌变暗红色为结扎成功标志。结扎50 min后,按照分组,分别给予生理盐水(I/R组)1 ml/100 g;或给予SFI 5、10和20 mg/kg。结扎60 min后,松开结扎线再灌注4 h[6,8]。
1.2方法
1.2.1CK、cTnⅠ、LDH检测 静脉采血后静置10 min,待血液凝固后3 000 r/min离心15 min,取血清。按照试剂盒操作说明检测CK、cTnⅠ、LDH。
1.2.2大鼠心肌梗死百分比检测 取出心脏,用4℃生理盐水清洗3次后称重,将心肌沿着结扎线切成5份,0.125%NBT常温染色15 min,非梗死区被染成蓝色,梗死区灰白色。将梗死区心肌剪下称重,以梗死区心肌重量占全心肌重量的百分比来表示心肌梗死百分比。
1.2.3HE检测心肌组织病理变化 将心肌置于10%甲醛溶液中固定,石蜡包埋后切片,HE染色,显微镜下观察病理变化。
1.2.4IL-6、IL-1β和TNF-α检测 IL-6、IL-1β、TNF-α的检测通过酶联免疫吸附剂测定(ELISA)试剂盒完成。
1.2.5细胞培养、细胞分组和心肌细胞缺糖缺氧复糖复氧(Oxygen-glucose deprivation/reoxygenation,OGD/R)模型制备 参照Wang等[9]的实验方法,心室肌细胞取自刚出生1~2 d大鼠心脏,组织使用PBS清洗3~4次,切碎并使用0.08%胰蛋白酶37℃处理8 min。之后加入新的0.08%胰蛋白酶溶液重复该步骤,直至组织完全消化后终止消化。差速贴壁90 min分离细胞,收集未贴壁细胞于含有10%FBS,100 U/ml青霉素、0.1 mg/ml链霉素的DMEM培养基中5%CO2、37℃培养48 h,并加入0.1 mmol/L 5-BrdU抑制非心肌细胞增殖。将细胞随机分为Control组、OGD/R组、SFI(25 μl/ml)组、SFI(50 μl/ml)组、SFI(100 μl/ml)组,除Control组常规培养以外,其余各组缺氧前将培养液换成无糖无血清培养液,SFI(25 μl/ml)组、SFI(50 μl/ml)组、SFI(100 μl/ml)组分别加入25 μl/ml、50 μl/ml、100 μl/ml的SFI预处理。之后培养于95%N2,5%CO2的37℃培养盒中4 h,造成缺糖缺氧损伤。之后将培养液换成正常DMEM培养液,在5%CO237℃培养箱中继续培养24 h形成复氧复糖环境。
1.2.6雷帕霉素处理细胞 将SFI(100 μl/ml)组分为SFI(100 μl/ml)组、SFI+Rapamycin组,其中SFI(100 μl/ml)组按照1.2.5所述方法处理,SFI+Rapamycin组加入终浓度20 nmol/L的雷帕霉素孵育1 h后,再按照1.2.5所述方法处理。
1.2.7MTT检测细胞活性 将细胞接种于96孔板中,按1.2.5、1.2.6所描述的方法对细胞进行分组及处理24 h后,每孔加入100 μl的MTT溶液(5 mg/ml),混匀后于培养箱中继续培养4 h。4 h后每孔加入150 μl的二甲基亚砜,于摇床上低速振荡10 min后,酶联免疫检测仪490 nm检测细胞吸光度。
1.2.8试剂盒检测心肌组织和细胞MDA和SOD水平 按照试剂盒操作说明检测MDA和 SOD,其中心肌组织按如下方式预处理:取缺血区心肌组织200 mg,4℃生理盐水清洗,碾碎制成10%心肌组织匀浆。
1.2.9Western blot检测心肌组织和细胞蛋白表达 按照1.1.2、1.2.3、1.2.7中描述的方法对细胞或组织分组处理后(组织样品需要进一步通过液氮捣碎处理),用RIPA裂解液提取各组细胞蛋白,用BCA试剂盒对各组细胞总蛋白浓度进行检测后,将各组蛋白浓度调整至一致。每组各取30 μg蛋白用10%SDS-PAGE分离各组蛋白,将分离后的蛋白采用半干转膜法转移到PVDF膜上,用5%的脱脂牛奶室温封闭2 h后,加入适宜浓度一抗,4℃孵育过夜。第2天用磷酸盐缓冲液(Phosphate buffer solution,PBS)清洗3次后,加入二抗室温孵育2 h后,滴加ECL显色液曝光显影。以GAPDH为内参。

总之,微课是对传统教学模式的创新,在传统的教学中起到了很好的辅助作用,有利于提高学生学习化学的兴趣,有利于提高课堂的教学效率,有利于节省课堂教学时间,有利于培养学生的自主学习意识和能力.但是也必须认识到课堂教学必须以教师的讲解为主,在适当的时候进行穿插运用,对教学起到辅助作用.
2 结果
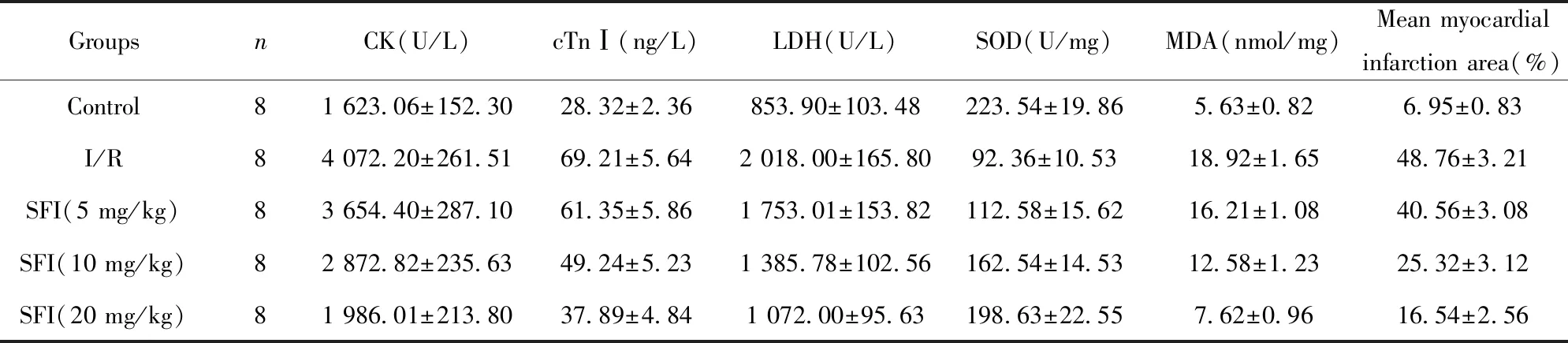
2.1参附注射液对心肌缺血再灌注大鼠心肌损伤及氧化应激的影响 如表1所示,与Control组比较,I/R组中心肌损伤标记物CK、cTnⅠ、LDH表达量显著升高(P<0.01),氧化应激标记物MDA浓度显著升高,SOD活性显著降低(P<0.01),心肌梗死面积显著增加(P<0.01),差异有统计学意义;与I/R组比较,SFI组的心肌损伤标记物CK、cTnⅠ、LDH表达量随着SFI浓度的提高而降低,但不存在显著差异;SFI(10、20 mg/kg)组的心肌损伤标记物CK、cTnⅠ、LDH表达量随着SFI浓度的提高而降低(P<0.01);SFI(5、10、20 mg/kg)组氧化应激标记物SOD活性显著升高(P<0.05,P<0.01),MDA浓度显著降低(P<0.05,P<0.01),并且呈浓度依赖性变化;心肌梗死面积随着SFI浓度的提高而降低(P<0.05,P<0.01),差异有统计学意义。
2.2参附注射液对心肌缺血再灌小鼠心肌组织病理变化的影响 如图1所示,Control组心肌纤维整齐,心肌细胞无嗜酸性变、纤维结构改变;I/R组心肌细胞嗜酸性变,纤维结构改变,出现收缩带,肌丝溶解,空泡变性;SFI(5、10、20 mg/kg)组中也出现了嗜酸性变、纤维结构改变的情况,但是病理变化随加入的SFI浓度升高逐步减轻。
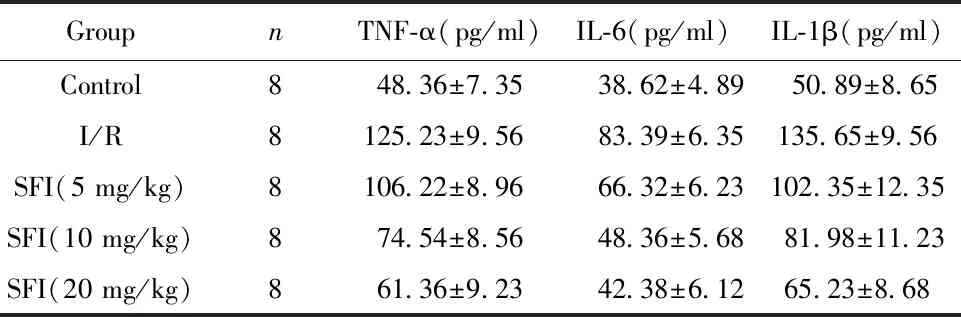
2.3参附注射液对心肌缺血再灌小鼠心肌炎症因子水平的影响 如表2所示,与Control组比较,I/R组血清炎症因子TNF-α、IL-6、IL-1β浓度显著升高差异有统计学意义(P<0.01);与I/R组比较,SFI(5、10、20 mg/kg)组血清炎症因子TNF-α、IL-6、IL-1β浓度显著降低(P<0.05,P<0.01),并且TNF-α、IL-6、IL-1β浓度同SFI浓度呈负相关,差异有统计学意义。
2.4SFI抑制大鼠心肌自噬 如图2所示,与Control组比较,I/R组LC3Ⅱ/LC3Ⅰ、Beclin1表达水平显著增高(P<0.01),p62表达水平显著降低(P<0.01),差异有统计学意义;与I/R组比较,SFI(5 mg/kg)组LC3Ⅱ/LC3Ⅰ比值、Beclin1表达水平降低,p62表达水平升高,但变化不存在显著差异;SFI(10、20 mg/kg)组LC3Ⅱ/LC3Ⅰ比值、Beclin1表达水平降低(P<0.01),与SFI浓度变化呈负相关,p62表达水平增高(P<0.01),与SFI浓度变化呈正相关,差异有统计学意义。
表1 SFI对大鼠心肌组织损伤标记物及氧化应激标记物表达及心肌梗死面积比率的影响
Tab.1 Effect of SFI on expression of myocardial tissue injury and oxidative stress markers and myocardial infarct size in rats
GroupsnCK(U/L)cTnⅠ(ng/L)LDH(U/L)SOD(U/mg)MDA(nmol/mg)Mean myocardialinfarction area(%)Control81 623.06±152.3028.32±2.36853.90±103.48223.54±19.865.63±0.826.95±0.83I/R84 072.20±261.5169.21±5.642 018.00±165.8092.36±10.5318.92±1.6548.76±3.21SFI(5 mg/kg)83 654.40±287.1061.35±5.861 753.01±153.82112.58±15.6216.21±1.0840.56±3.08SFI(10 mg/kg)82 872.82±235.6349.24±5.231 385.78±102.56162.54±14.5312.58±1.2325.32±3.12SFI(20 mg/kg)81 986.01±213.8037.89±4.841 072.00±95.63198.63±22.557.62±0.9616.54±2.56
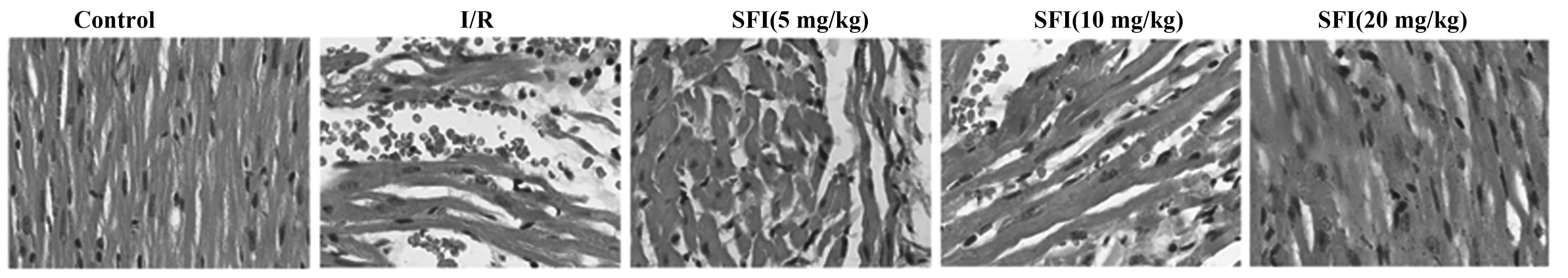
图1 HE染色检测SFI对大鼠心肌组织病理变化的影响(×400)Fig.1 Effect of SFI on pathological changes of rat myocardium was detected by HE staining(×400)
2.5SFI提高大鼠心肌组织PI3K/Akt/mTOR信号通路的活性 如图3所示,与Control组比较,I/R组p-PI3K/PI3K表达量比率显著降低(P<0.01),差异有统计学意义;p-Akt/Akt、p-mTOR/mTOR表达量比率降低,但不存在显著差异;与I/R组比较,SFI(5、10、20 mg/kg)组的p-PI3K/PI3K、p-Akt/Akt、p-mTOR/mTOR表达量比率显著升高(P<0.05,P<0.01),与SFI浓度呈正相关,差异有统计学意义。
表2 SFI对大鼠心肌组织TNF-α,IL-6,IL-1β水平影响
Tab.2 Effects of SFI on concentration of TNF-α,IL-6 and IL-1β in rat myocardial tissue
GroupnTNF-α(pg/ml)IL-6(pg/ml)IL-1β(pg/ml)Control848.36±7.3538.62±4.8950.89±8.65I/R8125.23±9.5683.39±6.35135.65±9.56SFI(5 mg/kg)8106.22±8.9666.32±6.23102.35±12.35SFI(10 mg/kg)874.54±8.5648.36±5.6881.98±11.23SFI(20 mg/kg)861.36±9.2342.38±6.1265.23±8.68
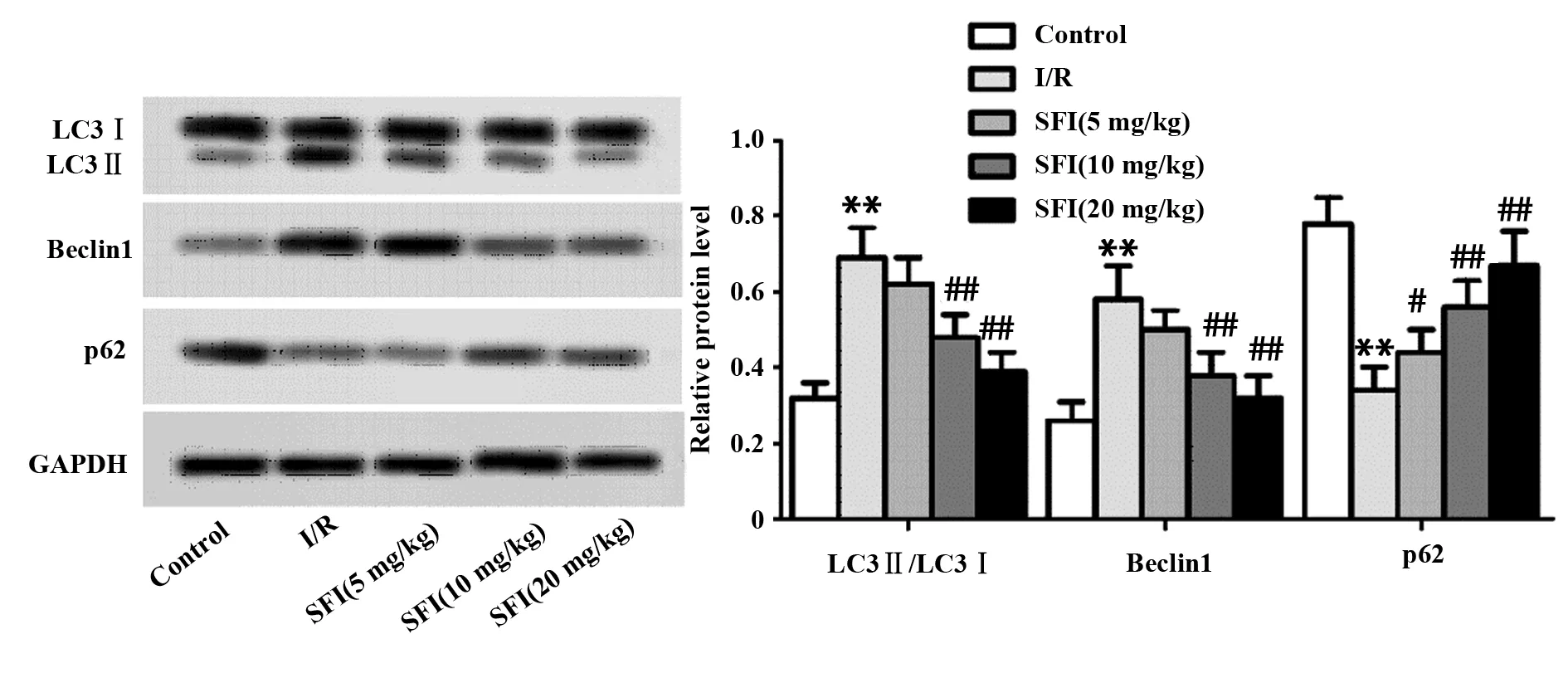
图2 SFI对大鼠心肌组织LC3、Beclin1、p62表达影响Fig.2 Effect of SFI on expression of LC3,Beclin1 and p62 in rat myocardial tissueNote: n=8,**.P<0.01 versus Control group;#.P<0.05,##.P<0.01 versus I/R group.
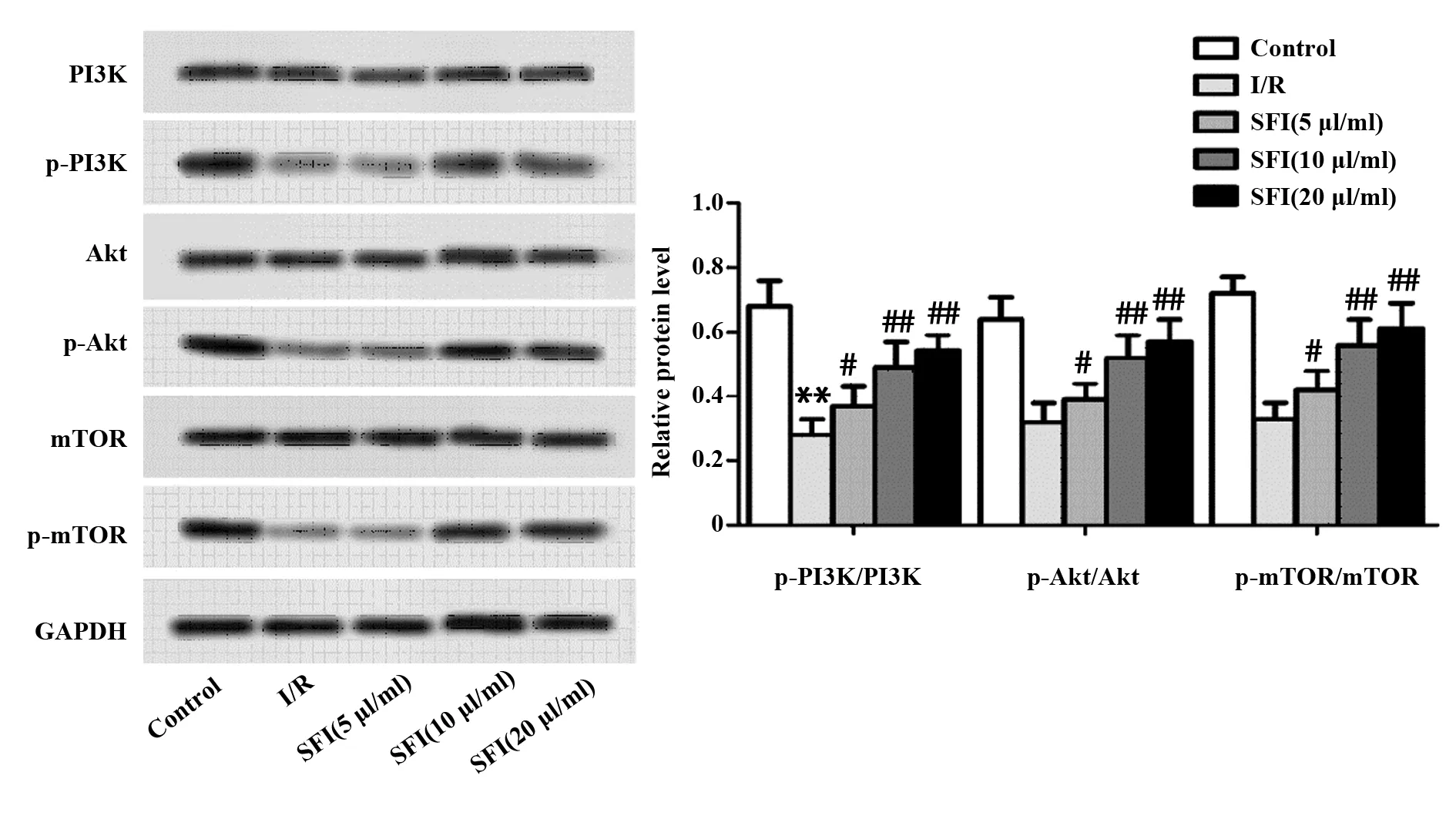
图3 SFI对大鼠心肌组织PI3K、Akt、mTOR表达影响Fig.3 Effect of SFI on expression of PI3K,Akt,mTOR in rat myocardial tissueNote: n=8,**.P<0.01 versus Control group;#.P<0.05,##.P<0.01 versus I/R group.
2.6SFI提高大鼠心肌OGD/R细胞活性 如图4所示,与Control组比较,OGD/R组细胞活性显著降低,差异有统计学意义(P<0.01);与OGD/R组比较,SFI(25 μl/ml)组细胞活性提高,但不具有显著差异;SFI(50、100 μl/ml)组细胞活性显著提高(P<0.05,P<0.01),与SFI浓度呈正相关,差异有统计学意义。
2.7SFI对心肌细胞中SOD和MDA的影响 如表3所示,与Control组比较,OGD/R组SOD活性显著降低(P<0.01),MDA浓度显著升高(P<0.01),差异有统计学意义;与OGD/R组比较,SFI(25、50、100 μl/ml)组SOD活性显著升高(P<0.05,P<0.01),与SFI浓度呈正相关,差异有统计学意义;SFI(25 μl/ml)组MDA浓度降低,但不具有显著差异;SFI(50、100 μl/ml)组MDA浓度显著降低(P<0.05,P<0.01),与SFI浓度呈负相关,差异有统计学意义。
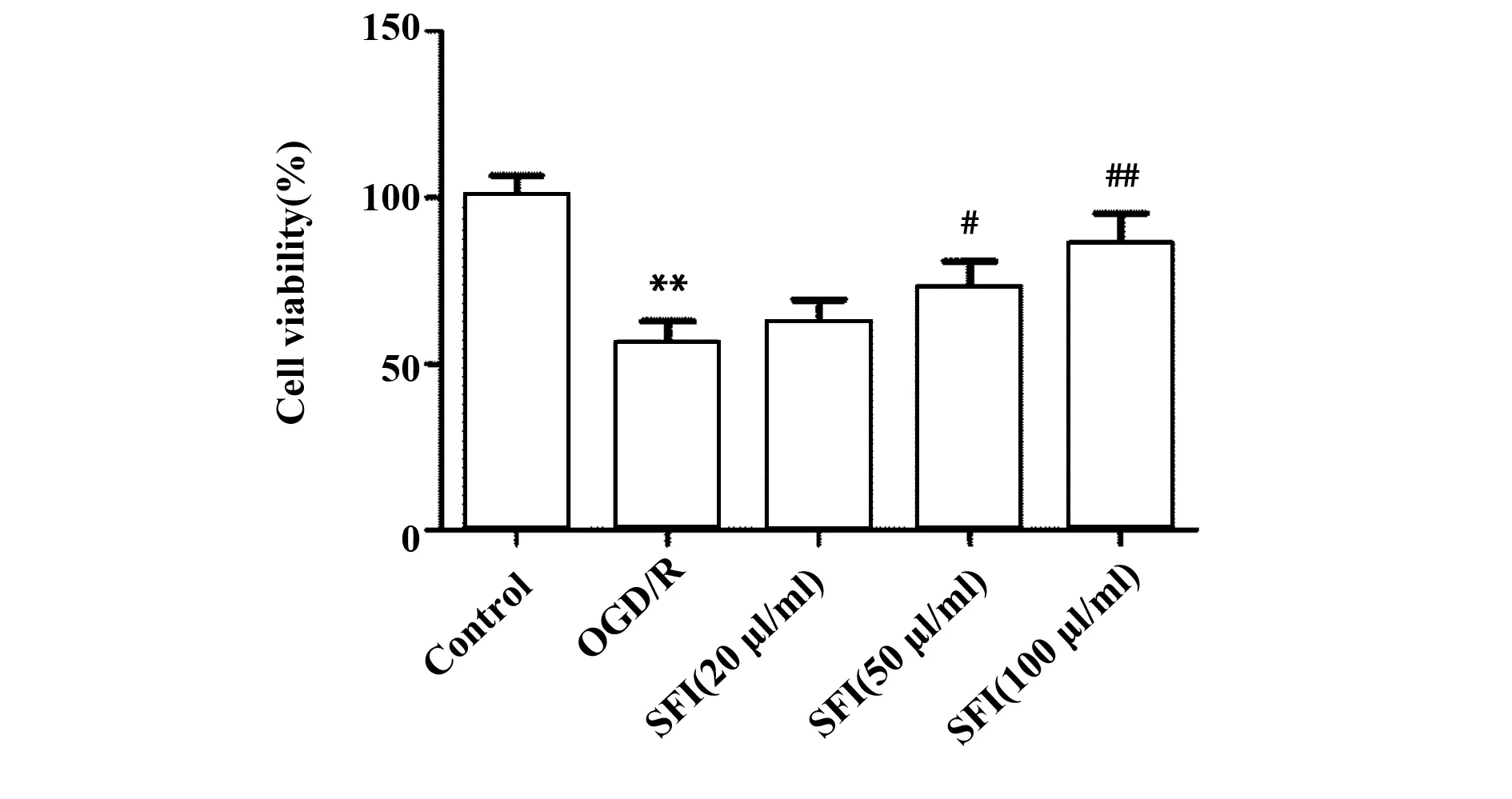
图4 SFI对OGD/R细胞活性影响Fig.4 Effect of SFI on OGD/R cell viabilityNote: n=6,**.P<0.01 versus Control group;#.P<0.05,##.P<0.01 versus OGD/R group.
表3 SFI对OGD/R细胞SOD活性及MDA浓度的影响
Tab.3 Effect of SFI on SOD activity and MDA concentr-ation in OGD/R cell

GroupnSOD(U/mg)MDA(nmol/mg)Control625.33±1.824.17±0.32OGD/R66.78±1.207.31±0.56SFI(25 μl/ml)612.60±1.606.50±0.63SFI(50 μl/ml)616.71±1.545.22±0.58SFI(100 μl/ml)621.20±2.294.55±0.42
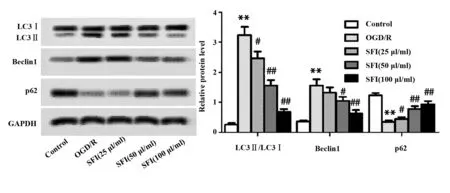
图5 SFI对OGD/R细胞LC3、Beclin1、p62表达影响Fig.5 Effect of SFI on expression of LC3,Beclin1 and p62 in OGD/R cellNote: n=6,**.P<0.01 versus Control group;#.P<0.05,##.P<0.01 versus OGD/R group.
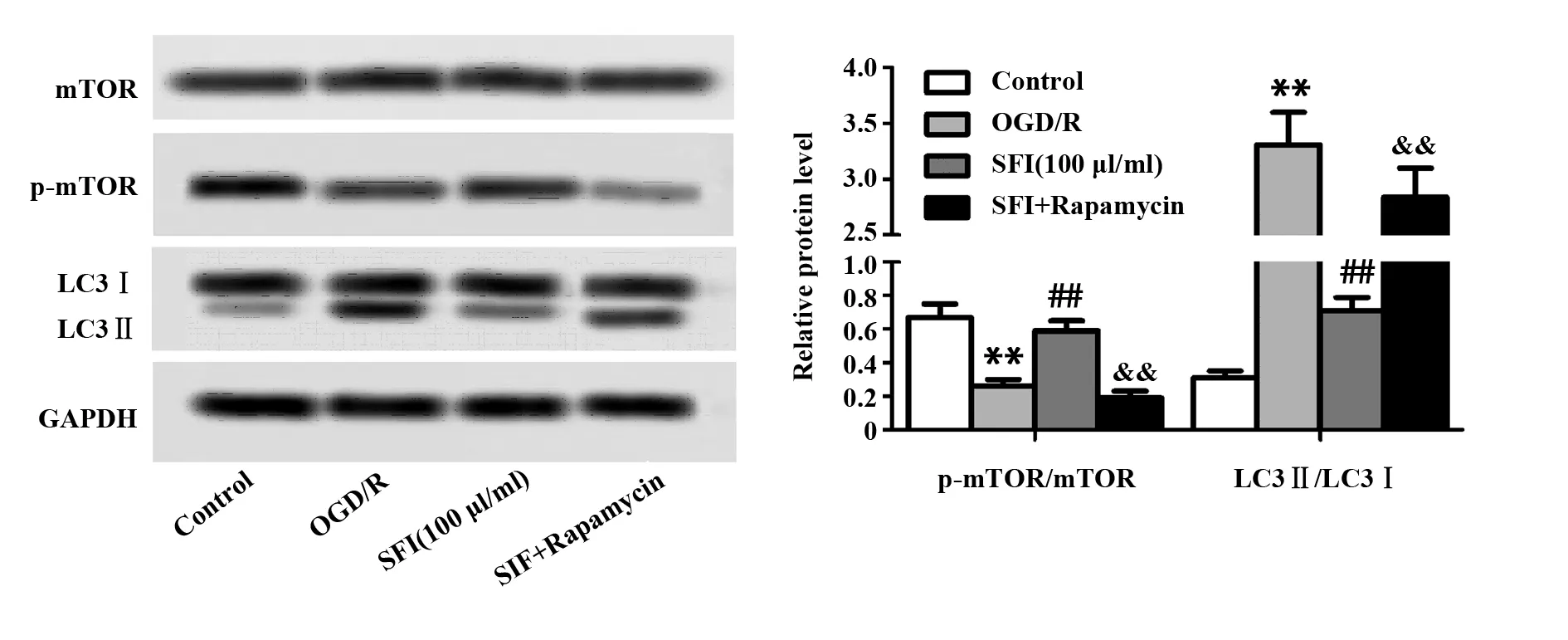
图6 雷帕霉素对SFI调控自噬的影响Fig.6 Effect of rapamycin on ability of SFI to regul-ate autophagyNote: n=6,**.P<0.01 versus Control group;##.P<0.01 versus OGD/R group;&&.P<0.01 versus SFI(100 μl/ml) group.
2.8SFI抑制受损心肌细胞自噬 如图5所示,与Control组比较,OGD/R组LC3Ⅱ/LC3Ⅰ、Beclin1表达水平显著升高(P<0.01),p62表达水平显著降低(P<0.01),差异有统计学意义;与OGD/R组比较,SFI(25、50、100 μl/ml)组LC3Ⅱ/LC3Ⅰ表达水平显著降低(P<0.05,P<0.01),与SFI浓度呈负相关,p62表达水平显著升高(P<0.05,P<0.01),与SFI浓度呈正相关,差异有统计学意义;SFI(25 μl/ml)组Beclin1表达水平降低,但不具有显著差异;SFI(50、100 μl/ml)组Beclin1表达水平显著降低(P<0.05,P<0.01),差异有统计学意义。
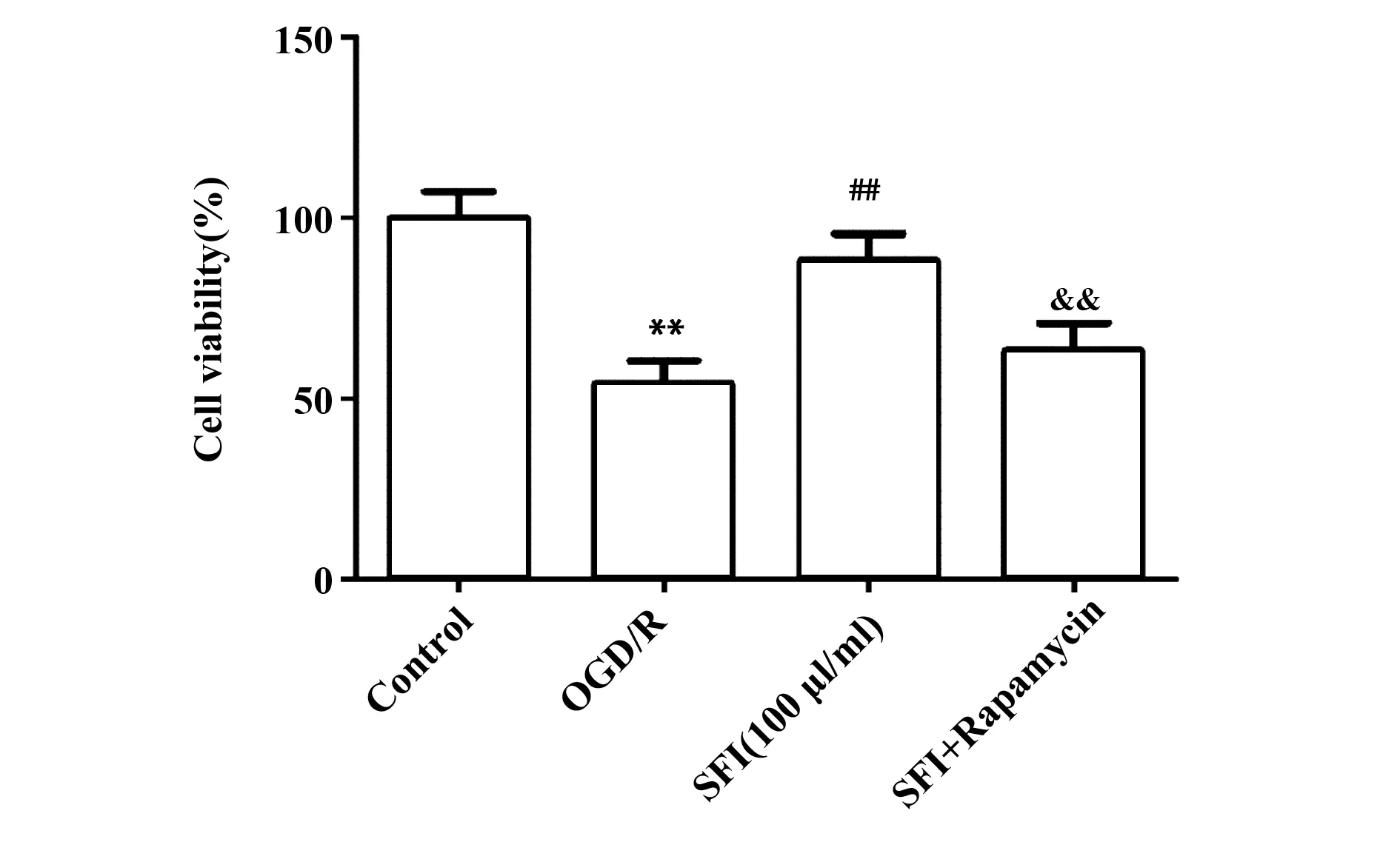
图7 雷帕霉素对SFI保护细胞活性的影响Fig.7 Effect of rapamycin on ability of SFI to protect cell viabilityNote: n=6,**.P<0.01 versus Control group;##.P<0.01 versus OGD/R group;&&.P<0.01 versus SFI(100 μl/ml) group.
2.10雷帕霉素拮抗SFI对细胞活性的保护作用 如图7所示,与Control比较,OGD/R组的细胞活性显著降低(P<0.01),差异有统计学意义;与OGD/R组比较,SFI(100 μl/ml)组、SFI+Rapamycin组的细胞活性显著升高(P<0.01),差异有统计学意义;与SFI(100 μl/ml)组比较,SFI+Rapamycin组细胞活性显著降低(P<0.01),差异有统计学意义。
3 讨论
自噬是广泛存在于真核生物中的一种维持细胞自身稳态的调控机制,是细胞通过形成自噬体并进一步与溶酶体结合降解自身受损的细胞器和蛋白质的过程,对细胞具有保护作用,而当细胞过度自噬时,会引发细胞非凋亡性死亡,因此自噬又被称为Ⅱ型细胞程序性死亡[10]。虽然这一观点在过去的研究中一直存在争议[11],然而近期的研究表明,自噬在发育和病理性的细胞死亡中都发挥着重要作用[12]。SFI是我国临床上常用的中药材之一,在MIRI及其他心脏相关疾病中具有显著疗效[6]。SFI成分很多,具有复杂的分子机制。李丽静等[7]研究表明,参附汤可降低大鼠缺氧复氧心肌细胞Beclin1的表达,从而抑制自噬,对心肌起保护作用,提示SFI可能通过调控自噬,减轻大鼠MIRI。本研究通过在体和离体实验,对SFI调控自噬减轻大鼠MIRI的作用和机制进行了进一步研究。
为了判断大鼠心肌的受损程度,本研究首先测定了大鼠血清CK、LDH、cTnⅠ水平,CK、LDH、cTnⅠ是常用的心肌损伤标记物,通常存在于胞质内,当心肌细胞发生损伤时,CK、LDH、cTnⅠ会从心肌细胞渗出到血液中,表现为血清CK、LDH、cTnⅠ水平升高[13]。本研究发现,SFI能够显著降低大鼠血清中CK、LDH、cTnⅠ的水平,其效果呈浓度依赖性变化,表明SFI减轻了MIRI对大鼠心肌造成的损伤,进一步对心肌梗死面积称量和心肌组织病理切片观察,检测大鼠心肌细胞活性,发现SFI显著减轻了大鼠心肌的梗死面积和病理变化,提高大鼠心肌细胞活性,与心肌损伤标记物测定的结果相符。
在MIRI中,炎症介质参与了心肌损伤的过程,其中活性氧(Reactive oxygen species,ROS)和炎症细胞因子在调控自噬中发挥着重要的作用。在心肌缺血阶段,低氧、ATP耗竭造成的细胞器损伤可激活自噬,而在再灌注阶段,氧化应激导致ROS大量产生,加重了细胞器损坏和脂质过氧化,导致了自噬的过度激活[14]。MDA是膜脂发生过氧化的重要产物之一,在氧化应激中水平升高,SOD是生物体重要的抗氧化酶,对清除ROS起着重要作用[15]。此外,白细胞对缺血心肌组织的浸润,并大量释放TNF-α、IL-6、IL-1β等炎症细胞因子,也加重了心肌损害[16]。本研究发现,SFI能够显著提高大鼠心肌组织和细胞内的SOD活性水平,抑制MDA的生成,且效果呈浓度依赖性变化,表明SFI能够降低MIRI大鼠心肌氧化应激水平。此外,SFI同样显著降低了炎症细胞因子TNF-α、IL-6和IL-1β的水平,且效果呈浓度依赖性变化,表明SFI缓解了MIRI的炎症反应。上述结果表明SFI对心肌的保护作用是通过缓解炎症和氧化应激实现的。
自噬是MIRI的重要病理机制之一,MIRI诱导的氧化应激、炎症等均能增强心肌的自噬作用。当心肌缺血时,细胞通过自噬降解受损部位并获得修复和再生的能量和原料,并通过阻断线粒体诱发凋亡的途径等方式保护心肌细胞[17,18],而在再灌注期间,心肌细胞的自噬发生过度激活,心肌损伤进一步加重[19]。为了进一步探究SFI对自噬的调控作用,本研究对自噬相关蛋白进行了检测,结果表明SFI显著降低了心肌组织和细胞中LC3Ⅱ/LC3Ⅰ比率和Beclin1蛋白表达水平,提高了p62的蛋白表达水平,且效果呈浓度依赖性变化。LC3、Beclin1、p62三种蛋白通常作为自噬水平的检测指标,Beclin1与PI3KCⅢ、Atg14形成三聚体,聚集自噬相关蛋白启动自噬;LC3的活性形式LC3Ⅱ参与自噬体的延伸;p62可与待降解物结合,再与LC3Ⅱ形成复合物,最终定位于溶酶体内降解,p62会随着自噬作用的增加而不断被消耗[20,21]。结合实验结果表明,SFI对MIRI大鼠心肌自噬作用的激活具有明显的抑制作用。
PI3K/Akt/mTOR信号通路对于自噬作用的激活具有重要调控作用,其中mTOR是PI3K/Akt下游最关键的自噬负调控因子。当mTOR表达受抑制时,ULK1复合体被激活,转移到内质网上诱导自噬泡膜形成[22]。本研究发现,SFI能显著提高心肌组织PI3K/Akt/mTOR信号通路的活性,从而抑制自噬作用的激活。雷帕霉素是一种新型免疫抑制剂,是mTOR的特异负调控因子[23],使用雷帕霉素抑制mTOR活性后发现,SFI对LC3Ⅱ的抑制作用显著降低,心肌细胞的活力也显著降低,表明SFI对MIRI大鼠心肌细胞自噬作用的抑制主要是通过激活自噬上游的PI3K/Akt/mTOR信号通路实现的。
综上所述,SFI能够通过抑制自噬作用的激活,下调自噬作用相关蛋白LC3Ⅱ、Beclin1的表达,上调p62的表达,在MIRI中保护心肌细胞,减轻细胞损伤,降低炎症反应。本研究首次探究了SFI通过调控自噬对MIRI的作用机制,后期将对SFI调控各种自噬相关蛋白的作用机制展开深入研究。