Zn和Cd处理下内生真菌对中华羊茅生长及内源激素的影响
王美宁,蔺伟虎,马碧花,李苗苗,田 沛
(兰州大学草地农业生态系统国家重点实验室 / 兰州大学农业农村部草牧业创新重点实验室 /兰州大学草地农业科技学院,甘肃 兰州 730020)
禾草内生真菌是指在禾草体内渡过全部或大部分生命周期但对禾草本身不显示外部症状的一大类真菌[1-2]。广泛研究的内生真菌主要是子囊菌门(Ascomycota)麦角科(Clavicipitaceae)的有性世代Epichloë和其所对应的Neotyphdium属内生真菌,后统一命名为Epichloë属内生真菌,Epichloë内生真菌广泛存在于野大麦(Hordeum brevisubulatum)、黑麦草(Lolium perenne)、中华羊茅(Festuca sinensis)等禾草中[2-3]。禾草与内生真菌能形成稳定的共生体,宿主植物为内生真菌提供生长所需的营养环境,内生真菌寄生又能促进禾草地上与地下部分的生长,增加宿主植物生物量,提高其抗旱耐寒、耐盐碱性、抗病虫害等抗逆境胁迫能力以适应生物及非生物胁迫[4-6]。高羊茅(Festuca arundinacea)和黑麦草感染内生真菌被认为能够增加其对草食动物的抵抗力,增加抗旱、耐盐等非生物胁迫能力,并且能够提高宿主植物的竞争力[7-8]。中华羊茅是分布在我国青海、四川、甘肃等地的多年生丛生型禾本科羊茅属植物,且绝大多数中华羊茅都带有Epichloë内生真菌[3]。研究发现,Epichloë内生真菌能协调中华羊茅在寒冷胁迫下的生理生化反应,避免其受到冻伤[9];在水分匮乏条件下,内生真菌显著提高了中华羊茅的株高分蘖等生长指标,增加了抗旱性[10];带菌的中华羊茅与其他禾草混播,内生真菌能增加中华羊茅的竞争力,促进伴生植物的生长,提高草地群落的稳定性[11]。另有研究表明,中华羊茅内生真菌共生体抗逆性与其产生的生物碱有关[12]。目前,对于中华羊茅内生真菌共生体的研究主要集中在其抗寒、抗旱及生物碱上,对于其他方面的研究不足。
植物受到胁迫时,内源激素含量会发生变化以应对植物生长发育的需要,从而影响植物的生理过程,内源激素是指由特定环境信号诱导植物细胞产生的能够对植物生理反应起到调节作用的活性物质,对植物的生命代谢至关重要,是植物逆境显示的信号。常见的植物内源激素有生长素类(auxin)、赤霉素类(gibberellic acid)、细胞分裂素类(cytokinin)、脱落酸类(abscisic acid)及乙烯(ethylene),它们对植物生长的影响复杂多样,在细胞分裂与伸长、组织器官分化、成熟与衰老等方面,分别或相互协调地调控植物的生长、发育与分化[13],在植物受到逆境胁迫时,植物内源激素会发生改变以应对环境胁迫[14]。
随着全球工业的高速发展,重金属污染已经是一个严重影响植物生长以及农业生产的环境问题。Zn是植株生长发育过程中所需的营养元素,是谷氨酸脱氢酶的活化剂,缺Zn会改变植株的株型,影响植株的生长,但土壤中Zn的含量过高时就会对植物产生毒害作用,使植物新陈代谢紊乱,生长受阻,甚至导致死亡[15];Cd是一种剧毒重金属元素,对植物的光合作用、呼吸作用、酶活性以及营养元素的吸收均有影响,Cd会破坏膜系统,使胞内物质渗出,有毒物质进入导致植株生理生化反应紊乱[16-17]。内生真菌与禾草共生,可显著提高植物耐重金属性[18-21],禾草内生真菌可用于重金属污染的修复,且具有如下优势:一是内生真菌伴随植物生长,带菌禾草表现出更强的生长力及抗逆性[1-4,22-23]。二是侵染了内生真菌的植物可能对重金属的积累更高;甚至在低浓度重金属胁迫下,内生真菌会促进宿主植物的生长[24-25]。鉴于此,感染内生真菌的禾草有望应用于重金属污染的修复中。
中华羊茅为我国西北部重要的乡土草,其带菌率高,抗逆性强,对野外干旱、低温及盐碱胁迫等外界不良环境具有良好的适应性,中华羊茅在土壤条件严苛的环境下也会生长,能在弱酸弱碱及营养不足的土壤条件下生长[1,26],但对重金属胁迫下中华羊茅-内生真菌共生体的生长的研究尚未见报道。关于内生真菌能提高禾草对重金属抗性的研究较多,但关于重金属胁迫下内生真菌与寄主植物内源激素的关系的研究较少,因此研究中华羊茅内生真菌共生体对重金属的抗性以及胁迫下植株内源激素的变化有非常重要的意义。本研究以Epichloë属内生真菌侵染(E+)和未侵染(E-)的中华羊茅为材料,在温室环境下通过Zn和Cd处理,分析探究在重金属处理下中华羊茅的生长与生理的变化,探究重金属处理条件下内生真菌与内源激素含量的关系。
1 材料与方法
1.1 试验材料
在青海省平安县巴藏沟乡(102°06′ E,36°20′ N,海拔3 129 m)中华羊茅植株上采获种子,4 ℃保存于兰州大学草地农业科技学院草地保护研究所冰箱。所用化学药品均为分析纯的ZnCl2和CdCl2,其中Cd2+的浓度100 mg·L-1,Zn2+的 浓度500 mg·L-1[27-31]。
1.2 试验设计
试验于2017年在兰州大学榆中校区草地农业科技学院智能温室 (105°26′ E,35°36′ N,海拔1 718 m)开展。中华羊茅种子带菌率检测用苯胺蓝染色法[32],每株检测20粒,确定种子带菌率,建立内生真菌侵染(E+)及未侵染(E-)种群。2017年8月将供试种子播种于育苗盘内,待其生长2~3个分蘖后,对成熟分蘖的叶鞘进行内生真菌带菌率的检测,确认其带菌率。将已建立的E+和E-种群于10月移栽至温室内。土壤采用黑土∶蛭石=3∶1的混合土,供试花盆规格为上径15.5 cm×下径11.5 cm×高14 cm的圆形花盆。在花盆中装入等量灭菌完毕的冷却土壤,移栽中华羊茅幼苗1株,选取长势一致的中华羊茅幼苗,至幼苗生长1个月后,选分蘖数一致的15盆E+和15盆E-植株,对照组正常浇水,而Zn处理组与Cd处理组分别用100 mL 的 ZnCl2(500 mg·L-1)与 CdCl2(100 mg·L-1)溶液处理2次,隔14 d浇一次,处理28 d,每个处理5个重复,期间正常浇水(温度:25±2 ℃,湿度:42±5%)。处理完毕后收获植物材料用于以下指标的测定。
1.3 指标测定
测量中华羊茅单株株高、分蘖数,于烘箱中60 ℃/48 h烘干至恒重,后用电子天平(BSA224S-CW,Sartorius)分别测定地上和地下干物质量。
中华羊茅植株内源激素赤霉素(GA3)、生长素(IAA)、细胞分裂素(CTK)和脱落酸(ABA)测定采用酶联免疫分析(ELISA)试剂盒,由上海丹施生物科技有限公司提供。在植株处理28 d后,每盆取2 g中华羊茅叶片,用锡箔纸包裹液氮速冻后,-80 ℃保存备用。单株取样为1次重复,共3次重复。每盆取1 g中华羊茅叶片,加入9 mL PBS (pH 7.4),用手工或匀浆器研磨匀浆,离心20 min(4 ℃,2 000 r·min-1),按照试剂盒步骤提取后,用酶标分析仪(Rayto RT-6100)在450 nm波长下测定样品吸光度(OD值),通过标准曲线计算样品中植物内源激素含量。
1.4 数据分析
本研究所有数据用Microsoft Excel 2010录入并作图,各项指标用SPSS 18.0统计分析软件进行分析,不同离子处理采用单因素方差分析,对株高、分蘖和生物量,植株内源激素赤霉素(GA3)、生长素(IAA)、细胞分裂素(CTK)和脱落酸(ABA),进行LSD法检测差异显著性,Duncan法进行多重差异性比较。
2 结果与分析
2.1 重金属Zn、Cd处理下内生真菌对中华羊茅株高、分蘖和生物量的影响
Zn和Cd两种不同处理均对中华羊茅的株高有影响。3种不同处理下,中华羊茅E+的株高均显著大于E-的株高(P<0.05)。与对照相比,Zn处理显著增加了E+和E-的株高,Cd处理显著降低了中华羊茅的株高 (P<0.05) (图1A)。
Zn和Cd两种不同处理对中华羊茅的分蘖影响不同。6种不同处理下,中华羊茅E+的分蘖均显著大于E-的分蘖(P<0.05)。与对照相比,Zn处理对中华羊茅E+和E-分蘖的影响不显著(P>0.05);Cd处理显著增加了E+的分蘖且达到最大,E-植株分蘖显著减少(P<0.05),说明内生真菌能缓降Cd处理对中华羊茅分蘖降低的影响(图1B)。
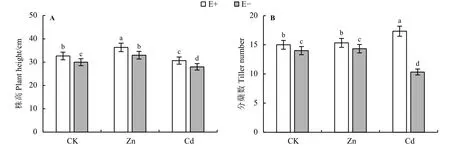
图1 Zn、Cd处理下内生真菌对中华羊茅的株高和分蘖的影响Figure 1 Effect of endophyte infection on plant height and the tiller of Festuca sinensis under Zn and Cd treatments
Zn和Cd两种不同处理影响中华羊茅的地上与地下生物量。在Zn处理条件下,中华羊茅的地下生物量显著大于对照和Cd处理;E+的地上生物量与对照和Cd处理差异不显著(P>0.05),且E+和E-间差异不显著。Cd处理降低了中华羊茅E+和E-的地上生物量和地下生物量;且E+的地上生物量显著大于E-,而地下生物量E+与E-差异不显著,说明内生真菌显著增加了Cd处理下中华羊茅的地上生物量(表1)。

表1 重金属Zn、Cd处理下内生真菌对中华羊茅生物量的影响Table 1 Effect of endophyte infection on aboveground and underground biomass of Festuca sinensis under Zn and Cd treatments
在Zn和Cd处理下内生真菌对中华羊茅内源激素GA3有显著影响。对照组中,E+和E-的叶片中GA3无显著差异(P>0.05)。与对照相比,Zn处理显著增加了中华羊茅E+和E-叶片中GA3含量,E+叶片中GA3含量增加39.8%,E-增加15.2%, E+显著高于E-(P<0.05);Cd处理使中华羊茅GA3含量显著下降(P<0.05),E+含量下降30%,E-含量下降 40%,E+含量显著高于 E-(P<0.05) (图2A)。
中华羊茅E+和E-在Zn和Cd处理条件下内源激素CTK的含量有显著差异。对照组中,E+叶片中CTK显著高于E-(P<0.05)。与对照相比,Zn处理显著增加了中华羊茅E+和E-叶片中CTK含量,E+含量增加35.8%,E-增加38.26%,E+显著高于E-(P<0.05);Cd处理使中华羊茅CTK含量显著下降(P<0.05),E+含量减少 56.5%,E-减少 55.4%(P<0.05),E+与E-差异不显著(图2B)。
中华羊茅E+和E-在Zn和Cd处理条件下内源激素IAA含量差异显著(P<0.05)。对照组中,E+和E-叶片中的IAA含量无显著差异(P>0.05)。与对照相比,Zn处理显著增加了中华羊茅E+叶片中IAA含量,E+的IAA含量增加了24.1%,E-的IAA含量虽然增加了但无显著变化;对照相比,Cd处理下中华羊茅E+叶片的IAA含量与无显著差异,E-植株显著下降(P<0.05),其中E+减少6.7%,E-含量减少55%。在Zn和Cd处理下,E+叶片中的IAA含量均显著高于E-(P<0.05)(图2C)。
中华羊茅E+和E-在Zn和Cd处理条件下ABA的含量有显著差异。与对照相比,在Zn处理条件下,中华羊茅E+和E-叶片中的ABA含量显著下降(P<0.05),其中E+下降47%,E-下降30%;Cd处理显著增加了中华羊茅E+和E-叶片中的ABA含量(P<0.05),E+含量增加30.1%,E-增加14.4%。在3种不同处理下,中华羊茅E-的ABA含量均显著高于 E+(P<0.05)(图2D)。

图2 Zn、Cd处理下内生真菌对中华羊茅内源激素的影响Figure 2 Effect of endophyte infection on endogenous hormones in Festuca sinensis under Zn and Cd treatments
3 讨论与结论
重金属胁迫能引起植物一系列生理和生化变化[33],比如干扰植物的光合作用,光电子传递的变化及矿质营养吸收等[34],植物对外界重金属等非生物胁迫的抗性是复杂多样的,其中与内源激素含量的变化有直接关系[35]。植物内源激素作为信号分子在重金属胁迫、干旱胁迫等胁迫-感知-反应一系列反应中起作用,也可以介导植物对非生物胁迫的适应反应[36]。在逆境胁迫的条件下,植物内源激素以含量的变化来应对环境的改变[37]。Zn是植物生长所需的微量元素,适量的Zn可以促进植物的生长,但土壤中含量过高便会造成重金属污染[38-39],本研究发现,中华羊茅对Zn(500 mg·L-1)的抗性较强,Zn能显著增加了中华羊茅的株高与生物量(P<0.05),这与前人研究发现Zn会促进植物生长的研究[40]一致。但促进的浓度存在差异,150和300 mg·L-1的Zn会抑制羽茅(Achnatherum sibiricum)的分蘖、叶片延伸,生物量也随浓度的升高而下降,低浓度Zn种子萌发、植株生物量积累有促进作用,浓度过高则会出现抑制[19,27,41],说明中华羊茅对Zn的抗性强,适宜在含有高浓度的Zn土壤中生长,这也是中华羊茅在治理重金属Zn污染中的优势。有学者研究表明Zn是IAA形成的必需元素,Zn对IAA前体-色氨酸的合成有影响[42-43],本研究发现Zn处理增加了中华羊茅叶片的生长类内源激素GA3、IAA含量,降低了ABA含量,说明Zn与IAA的合成有关;GA3可以促进L-色氨酸转换为D-色氨酸,进而被合成IAA[43],因此,本研究说明Zn对中华羊茅体内IAA与GA3的合成也有影响。
Cd作为众多污染中对植物毒害最严重的重金属之一,可以使植物一系列的生理代谢过程发生变化,包括光合作用、呼吸作用以及营养元素的吸收等,直接对植物生长发育产生严重的影响[44]。本研究发现100 mg·L-1的Cd会抑制中华羊茅的株高、减少生物量的积累,减少分蘖,Cd胁迫可以抑制醉马草(Achnatherum inebrians)、披碱草(Elymus dahuricus)和野大麦幼苗胚芽的生长,表现出叶片黄化,胚根褐变,且生物量也随Cd浓度的增加而下降[45-47];Cd对高羊茅种子发芽与幼苗生长产生持续性抑制作用[27],说明Cd对植物生长通常表现为抑制作用。Cd显著降低了中华羊茅GA3、CTK的含量,Cd胁迫下水稻(Oryza sativa)叶片的内源激素IAA、乙烯以及GA3含量下降[28],说明Cd胁迫会使植株体内生长类激素的含量下降。Cd显著增加了中华羊茅叶片中胁迫激素ABA的含量(P<0.05),说明植物生长过程中能通过提高ABA的含量,缓解重金属Cd的毒害。
不论在正常生长或是在胁迫条件下,内生真菌均能促进禾草的生长发育,内生真菌能提高寄主植物对外界环境中重金属的耐受性。本研究中,内生真菌提高了重金属胁迫下中华羊茅的株高、分蘖和地上、地下生物量,且显著提高了中华羊茅在Cd处理下的分蘖数;内生真菌不但提高了多年生黑麦草对Zn的耐受性,增加了地上生物量[48];还提高了紫羊茅(Festuca rubra)、细羊茅(Festuca stapfil)在Cu胁迫下生物量的积累;Cd胁迫会降低高羊茅和草地羊茅(Festuca pratensis)的生物量,而内生真菌可以缓解Cd对羊茅属植物的毒害作用[19],这均说明内生真菌能提高了植株对重金属的抗性,缓冲重金属对植株的毒害作用。在胁迫条件下,内生真菌改变植物内源激素含量使植物适应逆境胁迫[28]。本研究中,内生真菌通过增加3类生长类激素含量、降低了抑制类激素含量ABA,促进了中华羊茅在重金属处理下的生长,提高了对重金属的抗性,吴慧凤[49]研究发现铁皮石斛(Dendrobiuyn catenatum)接种内生真菌后植株的GA3含量达到极显著水平,菌株C20、C35、C42极显著地提高IAA的含量,而ABA的含量均极显著地低于未接菌植株;梅映学[28]发现Cd胁迫下带菌水稻的IAA、乙烯、GA3均显著高于未带菌水稻,均说明重金属胁迫时,内生真菌能协调植物激素以改变植物的生长。
本研究结果说明内生真菌能通过调控植物内源激素的含量,提高寄主植物对非生物胁迫的适应性,目前对于内生真菌通过调控宿主植物内源激素的研究较多,但在机理方面相关研究较少,对于其分子水平的研究匮乏,在未来的研究中应大量开展该方面的研究,以期阐明内生真菌-重金属胁迫-植物三者相互作用关系,为内生真菌抗逆研究提供科学依据。

