鞘氨醇激酶1在乳腺癌骨髓中的表达及临床意义*
袁鲲,谭鑫,吴芳兰,吴瑛,吴东波
(长沙市第一医院 1.检验科,2.妇产科,湖南 长沙 410005)
乳腺癌现为女性恶性肿瘤发病率占首位的疾病,严重危害女性健康[1-2]。乳腺癌的临床预后与是否远处转移密切相关,现在认为鞘氨醇激酶(sphingosine kinases,SPHKs)是肿瘤进展的关键因素[3-4],目前发现鞘氨醇激酶1(SPHK1)与肿瘤发病有重要关系,包括肿瘤增殖、抵抗凋亡及转移[5-6]。而SPHK1与乳腺癌临床远处转移相关研究鲜少报道,因此,为明确SPHK1与乳腺癌骨髓微转移相关性,是否可以作为早期诊断指标,特做以下研究。
1 资料与方法
1.1 一般资料
选取2016年6月—2018年6月长沙市第一医院乳腺癌、乳腺良性肿瘤及健康体检者骨髓(骨髓来源本院检验科骨髓细胞形态室)。乳腺癌患者90例。年龄(39±12)岁;均行病理检查确诊,术前未接受放射及化学治疗,常规体检并排除远处转移。按国际抗癌联盟(union for international cancer control,UICC)2010年肿瘤TNM分期标准进行分期[7]:Ⅰ期28例,Ⅱ期41例,Ⅲ期21例。良性乳腺肿瘤患者52例,排除身体其他部位恶性肿瘤。年龄(34±9)岁;乳腺纤维腺瘤28例,导管内乳头状瘤24例。健康体检者20例,为单纯乳腺增生,年龄(32±5)岁。健康对照组部分患者因症状较重,疑乳腺肿块性质,在行排癌检查的同时,同意行骨髓检测;部分患者伴有血象异常,同意行骨髓检测,后复查血象正常。3组间患者年龄差异无有统计学意义(P >0.05)。研究经本院医学伦理委员会批准,所有患者均签署知情同意书。
1.2 方法
1.2.1 常规骨髓取样三点取材法在患者双侧髂前上棘与胸骨处行骨髓穿刺术,取骨髓液10 ml,置入-70℃冰箱冷冻保存备用。
1.2.2 实时荧光定量聚合酶链反应(quantitativerealtime polymerasechain reaction,qRT-PCR)检测各组骨髓中 SPHK1 mRNA 的表达 取骨髓液加入 Trizol,按说明书提取总RNA,采用RT-PCR试剂盒及real-time PCR试剂盒(日本TaKaRa公司)对样本RNA进行逆转录及PCR扩增。引物序列由大连宝生物工程有限公司合成:SPHK1正向为 5'-CTTCCTT GAACCATTATGC-3',反向为 5'-CCGATACTTCTCACT CTC-3',扩增片段长度为426 bp。β-actin引物序列正向为5'-GTGGGCATGGGTCAGAAG-3',反向为5'-G AGGCGTACAGGGATAGCAC-3',扩增片段长度为576 bp;逆转录体系 20 μl,反应条件:42℃下扩增30 min,95℃下水浴 2 min,置入 -20℃冰箱冷冻保存。采用美国 Applied Biosystemes公司 ABI PRISM7 300 荧光定量聚合酶链反应(RTFQ-PCR)仪进行PCR反应,反应体系 20 μl,反应条件:95℃预变性 1 min 30 s,随后 95℃变性 15 s,60℃退火 30 s,65℃延伸 1 s,共40个循环。美国 Thermo Electron Corporation 公司连续光谱荧光酶标仪自动进行样本检测,结果<103copy/ml为阴性,≥ 103copy/ml为阳性。
1.2.3 Westernblotting 检测骨髓中 SPHK1 蛋白的表达 提取总蛋白,BCA蛋白定量试剂盒[生工生物工程(上海)股份有限公司]检测蛋白浓度,配制10%分离胶及5%堆积胶,每孔加入等量待测蛋白。SDSPAGE电泳后,将蛋白转移至PVDF上,室温封闭2 h,加入SPHK1多克隆抗体(1∶400,美国Santa Cruz公司)4℃过夜,HRP标记的兔抗山羊二抗(1∶4 000)室温孵育1 h。用凝胶图像分析系统(江苏捷达)进行灰度分析,计算积分光密度(IOD)值。
1.3 统计学方法
数据分析采用SPSS 13.0统计软件,阳性率的比较采用χ2检验,组间均数比较进行方差齐性检验,如方差齐,则采用单因素方差分析,组间进一步两两比较采用SNK-q检验,P<0.05为差异有统计学意义。通过计算骨髓SPHK1对乳腺癌诊断的敏感性、特异性、准确性、阳性预测值(PPV)、阴性预测值(NPV)、阳性似然比(positive likelihood ratio, PLR)和阴性似然比(negative likelihood ratio,NLR)评估诊断符合率。应用Kappa检验评估诊断一致性,若0.75<κ≤1.00,说明一致性极好;0.40<κ≤0.75,一致性好;0.00≤κ≤0.40,则一致性差。
2 结果
2.1 各组SPHK1在骨髓中的表达
90例乳腺癌组患者中骨髓SPHK1阳性68例(75.6%),52例良性乳腺肿瘤组患者骨髓SPHK1阳性7例(13.5%),20例健康对照组中骨髓SPHK1阳性1例(5.0%),3组间阳性率比较差异有统计学意义(χ2=67.119,P =0.000)。
2.2 各组SPHK1 mRNA和蛋白在骨髓中的表达
90例乳腺癌组患者SPHK1 mRNA相对表达量为(3.015±0.943)高于良性乳腺肿瘤组患者(0.974±0.397)和健康对照组(0.482±0.093),组间比较差异有统计学意义(F =8.423,P =0.000);良性乳腺肿瘤组患者SPHK1 mRNA表达量与健康对照组比较,差异无统计学意义(P >0.05)(见图1)。90例乳腺癌组患者SPHK1蛋白相对表达量为(1.657±0.198),良性乳腺肿瘤组患者为(0.963±0.132),健康对照组为(0.749±0.126),组间比较差异有统计学意义(F =4.768,P =0.000);良性乳腺肿瘤组SPHK1蛋白相对表达量与健康对照组比较,差异无统计学意义(P >0.05)(见图2)。
2.3 骨髓SPHK1的检测诊断乳腺癌的符合率
ROC曲线下面积为0.887,SPHK1蛋白确定良恶性肿块的临界值为1.1247。以病理活检为金标准,骨髓SPHK1诊断敏感性为75.6%,特异性为86.5%。经Kappa检验评估骨髓SPHK1诊断乳腺癌骨髓微转移的一致性,κ值为0.59>0.4,表示具有较好的一致性。见表1。
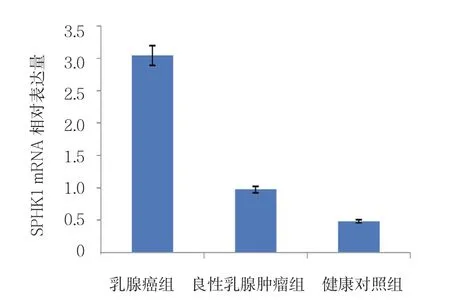
图1 各组骨髓中SPHK1 mRNA的相对表达量
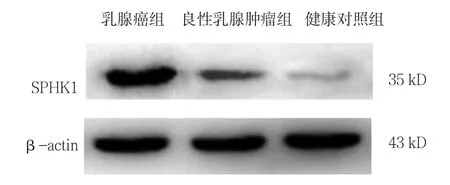
图2 SPHK1蛋白在各组骨髓中的表达

表1 骨髓SPHK1的检测诊断乳腺癌的符合率
3 讨论
SPHK将鞘氨醇转化为鞘氨醇1磷酸(S1P),S1P可作为细胞内第二信使以及可结合特异性受体的细胞外配体。而产生的S1P,反过来可以作为G蛋白偶联S1P受体1-5(S1PR1-S1PR5)家族的配体,并调节广泛的生物学效应,包括调控细胞增殖、转化和迁移,促进血管生成,在细胞增殖、迁移和存活中起关键作用[8-9]。SPHK具有2种不同功能的异构体,SPHK1和SPHK2,这2种形式已被发现与肿瘤的发生发展密切相关,其中以SPHK1更为明显,SPHK1是细胞内神经鞘脂类代谢的重要限速酶,可能成为肿瘤新的治疗靶点[10-12]。有研究认为SPHK1在消化道肿瘤中与肿瘤晚期进展相关,可以作为消化道肿瘤患者死亡的预测因子[13-14]。在原发性肝癌中,SPHK1表达高于癌旁组织,且高表达SPHK1蛋白的肝癌患者生存期较短。认为SPHK1是肝癌的一个潜在分子靶点,有助于判断病情的复发和预后[15]。近年来有研究认为,SPHK1高表达与血管内皮细胞增殖有重要关系,可能是促进血管内皮细胞过度增殖的重要因子,这亦提示SPHK1蛋白与肿瘤增殖及远处转移可能有关[16-17]。
熊伟等[18]发现,ABCB5与SPHK1在乳腺癌组织中表达高于癌旁组织,且SPHK1蛋白表达与肿瘤分期、肿瘤大小、月经情况、淋巴结转移、ER及HER-2表达有关,认为其在乳腺癌发生、发展中有一定作用,其检测可辅助乳腺癌的诊断和病情评估。微阵列分析结果提示乳腺癌患者SPHK1异构体表达高水平预示预后较差[19]。研究也证实SPHK1在ER阳性乳腺癌中高表达,并与ER受体相互作用[20];SPHK1/S1P信号通路也被报道能促进内分泌药物耐药性且促进雌激素依赖性肿瘤的发生、活化及存活。但有关SPHK1与乳腺癌远处转移的研究较少,本研究发现乳腺癌组患者骨髓中SPHK1阳性率高于良性乳腺肿瘤组及健康对照组;乳腺癌组患者SPHK1 mRNA和蛋白相对表达量高于良性乳腺肿瘤组患者和健康对照组;骨髓SPHK1诊断乳腺癌的敏感性为75.6%,特异性为86.5%。经Kappa检验κ值为0.59>0.40,具有较好的一致性。显示SPHK1在乳腺癌患者骨髓中存在表达异常,且与病理诊断符合情况较为一致。
表达SPHK1的成纤维细胞可获得转化表型并促进肿瘤发生,提示SPHK1具有致癌活性,且SPHK1在多种人类肿瘤中高表达,此外在某些肿瘤中其表达上调与临床预后较差密切相关,抑制SPHK1表达可影响肿瘤细胞的增殖,SPHK1的活化是细胞增殖、转化、转移和耐药的关键因素。因此,通过检测肿瘤的微转移可以监测肿瘤发展趋势,在肿瘤可能转移的早期进行干预,消灭潜在微转移灶,对乳腺癌患者预后具有极大的临床意义。SPHK1可能是肿瘤侵袭转移的关键调控因子,因而乳腺癌患者骨髓中SPHK1表达升高,使检测骨髓微转移成为可能。
综上所述,SPHK1可作为检测乳腺癌患者骨髓转移的分子标志之一,有助于早期检测乳腺癌患者的骨髓转移,可能成为乳腺癌治疗的新靶点。

