外源ABA对干旱条件下小麦冠层温度及光合同化物积累与分配的调控效应
张 鑫,孔 祥,李 勇,骆永丽,黄 翠,金 敏
(1.山东农业大学农学院/作物生物学国家重点实验室,山东泰安 271018; 2.山东农业大学生命科学院,山东泰安 271018)
黄淮海区域是我国小麦主产区,降雨季节分布不均,小麦生长季年均降雨量不足200 mm,占其全生育期需水量的35%~50%[1];灌浆期干旱频发,造成小麦植株代谢紊乱,叶绿体降解,灌浆期缩短,灌浆速率降低,最终导致粒重和产量的降低[2-6]。小麦灌浆期冠层温度既能反映植株和外部环境间的能量交换,也是叶片光合能力及产量的影响因素之一[7]。冠层温差(CTD)是指空气温度与作物冠层温度的差值,与土壤水分含量、叶气交换率、叶面积、光合酶活性等环境和叶片生理条件有关[8-9]。研究表明,小麦冠层温度和产量呈显著负相关,CTD与产量呈显著正相关[10],因此CTD可用来作为作物抗旱性鉴定的指标。灌溉可使小麦冠层温度显著降低[7]。水分胁迫和缺氮会减弱光合作用并使叶温和冠层温度升高,导致冠层温差降低[11]。光合作用是小麦干物质积累和籽粒产量形成的生理基础,叶绿素荧光作为光合作用的内在因素,在光能吸收、传递及转换过程中起着重要作用[12-13]。灌浆期水分亏缺时,小麦光合速率减弱,造成大幅减产,因此促进光合同化物大量向籽粒的快速转运对小麦高产十分重要。
干旱条件下植物的脱落酸(abscisic, ABA)含量与气孔导度和叶片生长有关。当植物根系感受干旱信号时,植株体内ABA含量迅速上升,ABA通过调节K+运动与Ca2+协同效应来控制叶片气孔关闭,从而降低蒸腾失水,维持叶片细胞水分状态,提高植物的耐旱能力[15]。ABA对调节植物抗旱性的提高具有重要作用[16]。喷施外源ABA可以延长小麦叶片保绿时间,减缓叶绿素降解速率[17]。同时,外源ABA还可以促进茎叶中的同化物向籽粒转运,有利于籽粒灌浆[18]。花后干旱胁迫对小麦冠层温度、叶片光合能力及籽粒灌浆进程影响的研究已有报道,但关于在灌浆过程中喷施外源ABA如何调节冠层温度以及冠层温度与光合产物积累分配的关系如何,仍有待深入研究。本研究在产量形成的关键时期(灌浆期)进行干旱胁迫试验,分析干旱对两个小麦品种冠层温度、叶片光合生产力及籽粒灌浆过程的影响,探讨干旱逆境下外源 ABA 对不同耐旱型小麦光合产物积累和分配的调控作用,以期深入认识小麦冠层温度变化与光合产物积累与分配的关系,为花后籽粒生长调控提供理论依据。
1 材料与方法
1.1 试验地概况
2017-2018年小麦生长季,在山东泰安山东农业大学试验农场遮雨棚内(36°9′ N,117°9′ E)进行池栽试验,试验地耕层(0~20 cm)土壤含有机质11.3 g·kg-1、全氮0.9 g·kg-1、碱解氮83.4 mg·kg-1、速效磷30.3 mg·kg-1、速效钾90.8 mg·kg-1。播种前基施纯氮120 kg·hm-2、P2O575 kg·hm-2、K2O 100 kg·hm-2,拔节期追施纯氮120 kg·hm-2,全生育期严格控制病虫草害。
1.2 试验设计
本试验采用三因素裂区设计。主区是小麦品种,为水分敏感型品种辐287和耐旱型品种山农20;副区是水分,设正常灌水条件(田间持水量的75%~80%,用W表示)和水分亏缺条件(田间持水量的40%~50%,用D表示)两个水分梯度;副副区是喷施外源激素,设喷施ABA和喷施清水(CK)两个水平。
试验小区面积6.25 m2(2.5 m×2.5 m),每处理重复3次。小麦基本苗为270株·m-2,于2017年10月8日播种,2018年6月5日收获。于盛花期开始控水,实时监测土壤体积含水量并及时补灌。控水开始后每天16:00左右全株喷施外源ABA(美国Sigma公司),连续喷施4 d。为使激素能更好地附着于植株上,喷施前将激素与 0.5%(v/v)Tween-20 (美国Sigma公司)混合,浓度为10 mg·L-1,用量为100 mL·m-2。以喷施含0.5%(v/v)Tween-20的清水为对照(CK),每处理重复3次。
1.3 测定项目与方法
1.3.1 植株挂牌标记及取样
于花后开始,在每个小区中选择株高和绿叶数基本一致且无病害的5株小麦植株挂牌标记,用于旗叶SPAD值、光合指标及荧光参数的测定。花后3、5、7、9、11、13、15、17、19、21、23、25 d(弱势粒从花后5 d开始)和成熟期进行取样,每次每个小区取10个麦穗作为一组,取3次重复,共30个麦穗。每穗取中部小穗的第1、第2位籽粒为强势粒,第3、第4位籽粒为弱势粒,若无第4位籽粒,则只取第3位籽粒为弱势粒,若有第5位籽粒,则取第3、第4、第5位籽粒为弱势粒。所取样品烘干至恒重,用于籽粒灌浆特性分析。
1.3.2 补灌水量及遮雨棚内温度测定
土壤含水量及补灌水量测定:于盛花期开始进行控水,利用环刀法测定田间持水量、土壤容重和土壤质量含水量。用一定容积(V)的环刀取 0~20 cm的原状土,每10 cm为一层,每个处理做好标记,取回后进行称重,记为m1;将原状土放于盛水的搪瓷盘内,有孔盖的一端朝下,盘内水面较环刀上缘低1~2 mm,勿使环刀上面淹水,让土壤水分充分饱和达到恒重为止,称重,记为m2,然后放入105~110 ℃ 烘箱中,烘至恒重,取出称重,记为m3。依据公式“田间持水量=(m2-m3)/m3×100%”、“土壤容重=m3/V”、“土壤质量含水量=(m1-m3)/m3×100%”进行计算。采用美国 Decagon公司生产的ECH2O土壤含水量监测系统准确实时监测土壤体积含水量,15 min读取1个数据,当土壤体积含水量快达到阈值时,依据公式“补灌水量=20/3×a×H×(B1-B2)”计算补灌水量(m3·667 m2)并及时补灌。式中a为测墒土层容重(g·cm-3);H为测墒土层深度(cm);B1为目标土壤质量含水量(田间持水量乘以目标土壤相对含水量);B2为灌溉前土壤质量含水量。
遮雨棚内温度测定:采用美国 Decagon公司生产的EM50微型气象监测系统准确实时监测气温变化,每15 min读取1个数据。
1.3.3 冠层温度测定
利用红外热成像仪(Testo 890)拍摄植物冠层的热度图,传感器分辨率为640×480,灵敏度为0.04 ℃。于花后7、14、21、28 d选择晴朗中午的12:00到14:00之间进行冠层红外图像采集,共采集4次数据。利用TestoIRsoft 4.0版本软件进行图像分析。从每个小区的热成像图片中选出15片旗叶和15个麦穗测定叶温及穗温,计算了每种处理下的冠层温差(CTD)及穗叶温差(SLTD)[8]。CTD=气温-冠层温度;(2)SLTD=穗温-叶温。
1.3.4 叶绿素相对含量测定
采用日本大阪Minolta公司生产的手持式叶绿素计(SPAD-502)来估测叶绿素含量。于花后5、11、17、23和30 d按照每个小区中挂牌标记的编号测定旗叶SPAD值,测定时选取无叶脉的部位,每片旗叶测定3次,取其均值。
1.3.5 旗叶叶面积测定
于花后从每个小区中随机抽取15片完全发育的旗叶,利用美国CID公司生产的CI-202便携式激光叶面积仪来测定叶面积(LA)。
1.3.6 光合指标测定
采用美国LI-COR公司生产的LI-6400便携式光合作用测定系统测定旗叶的净光合速率、蒸腾速率、气孔导度和胞间CO2浓度。于花后7、14、21、28 d晴朗上午的9:00到12:00之间,按照每个小区中挂牌标记的编号进行测定,共测定 4次。
1.3.7 荧光参数测定
利用英国Hansatech公司生产的Handy-PEA植物效率分析仪测定旗叶叶绿素荧光参数。于花后7、14、21、28 d晴朗上午的9:00到12:00之间,按照每个小区中挂牌标记的编号进行测定,共测定4次。通过数据分析获得Vj(PSII活性反应中心的关闭程度)、Wk(放氧复合体受害程度)、φ0(被捕获电子传递到电子传递链QA-中下游的其他电子受体的概率)和PIabs(基于光能吸收的性能指数)[11]。
1.3.8 干物质积累与分配测定
于开花期和成熟期从每个小区各取生长一致的10个小麦单茎,将成熟期样品分为茎秆及叶鞘、叶片、穗轴及颖壳、籽粒四部分,所取样品于105 ℃下杀青30 min,然后在70 ℃烘箱中烘至恒重。计算干物质积累与转运的相关指标[19]。
花前干物质转运量=开花期营养器官干物质量-成熟期营养器官(茎鞘+叶片+颖壳)干物质量;
花后光合积累量=籽粒产量-花前干物质转运量;
花前干物质转运量对籽粒产量的贡献率=花前干物质转运量/籽粒产量×100%;
花后光合积累量对籽粒产量的贡献率=花后光合积累量/籽粒产量×100%。
1.3.9 籽粒动态灌浆过程测定
采用Richard方程W=A/(1+Be-kt)1/N模拟籽粒增重动态过程[20]。式中W为籽粒重量,A为生长终止量,t为花后天数,B、k、N为参数。对方程求一阶导数可得灌浆速率G=AKBe-kt/(N(1+be-kt)(N+1)/N)。当灌浆进程达到生长终止量的99% 时,实际灌浆终期t3=ln[(100/99)N-1/B]/k;最大灌浆速率Gmax=Ak(1+N)-(N+1)/N;平均灌浆速率Gmean=Ak/(2N+4);活跃生长期D=2(N+2)/k。
1.3.10 产量及其构成要素测定
于小麦成熟期各小区收获1 m2用于测产,各小区选取1 m双行用于统计穗数和穗粒数,并于脱粒后晾干称重,测千粒重。
1.4 统计分析
利用DPS 7.05统计分析软件进行方差分析及显著性检验(LSD法),用MATLAB 2012计算灌浆参数,用SigmaPlot 10.0软件作图。
云、贵、川三省的人民收入在近年一直保持着较快的增长趋势。2017年云南城市居民人均可支配收入达到30 996元,增长8.3%,农村居民人均纯收入达到9 862元,增长9.3%;2017年贵州城市居民人均可支配收入达到29 080元,增长8.7%,农村居民人均纯收入达到8 869元,增长9.6%;2017年四川城市居民人均可支配收入达到30 727元,增长8.4%,农村居民人均纯收入达到12 227元,增长9.1%。从现有的城镇与农村收入水平来看,三省的居民已经基本具备一定的体育消费能力。简而言之,随着云、贵、川三省居民收入的不断增高,大型体育赛事运作管理将会得到愈来愈强的推动力。
2 结果与分析
2.1 干旱和外源ABA对不同小麦品种干物质积累转运的影响
与正常灌水相比,干旱条件下两品种成熟期植株总干重及单茎籽粒干重均显著降低(表1)。与CK相比,喷施外源ABA显著提高了成熟期水分敏感型品种辐287植株总干重、两品种单茎籽粒干重及干物质分配比例。耐旱型品种山农20的花后光合积累量显著高于水分敏感品种辐287(表2)。不同处理间两个品种的花前干物质转运量差异均不显著,花后干物质积累对籽粒产量的贡献率为67.92%~81.88%。在CK条件下,与正常灌溉相比,干旱胁迫后两品种花后光合积累量及其贡献率均显著降低,且辐287降幅大于山农20,其中辐287和山农20的贡献率分别降低5.05%和3.25%。在干旱条件下,与CK相比,喷施ABA后花后光合积累量及其贡献率均显著提高。这表明两个品种籽粒中的干物质均主要来源于花后干物质积累,但灌浆期发生干旱时,耐旱型品种籽粒的形成对花后干物质积累的依赖性 更大。
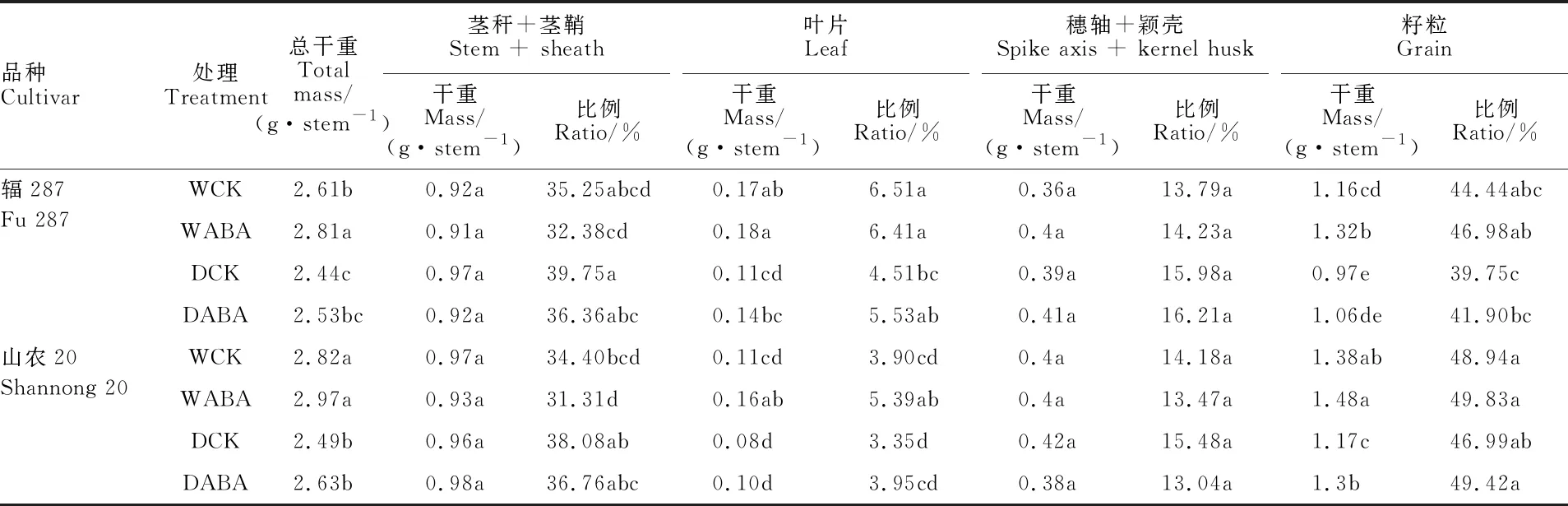
表1 成熟期小麦不同器官干物质积累量及分配比例Table 1 Amountand its proportion of dry matter accumulation in different wheat organs at maturity
同列数据后不同小写字母表示不同处理间在0.05水平差异显著。下表同。
Different lower-case letters following the values within the same columns indicate significant difference among the treatments at 0.05 level. The same in tables 2 and 4.
2.2 干旱和外源ABA对不同小麦品种冠层温度、叶温和穗温的影响
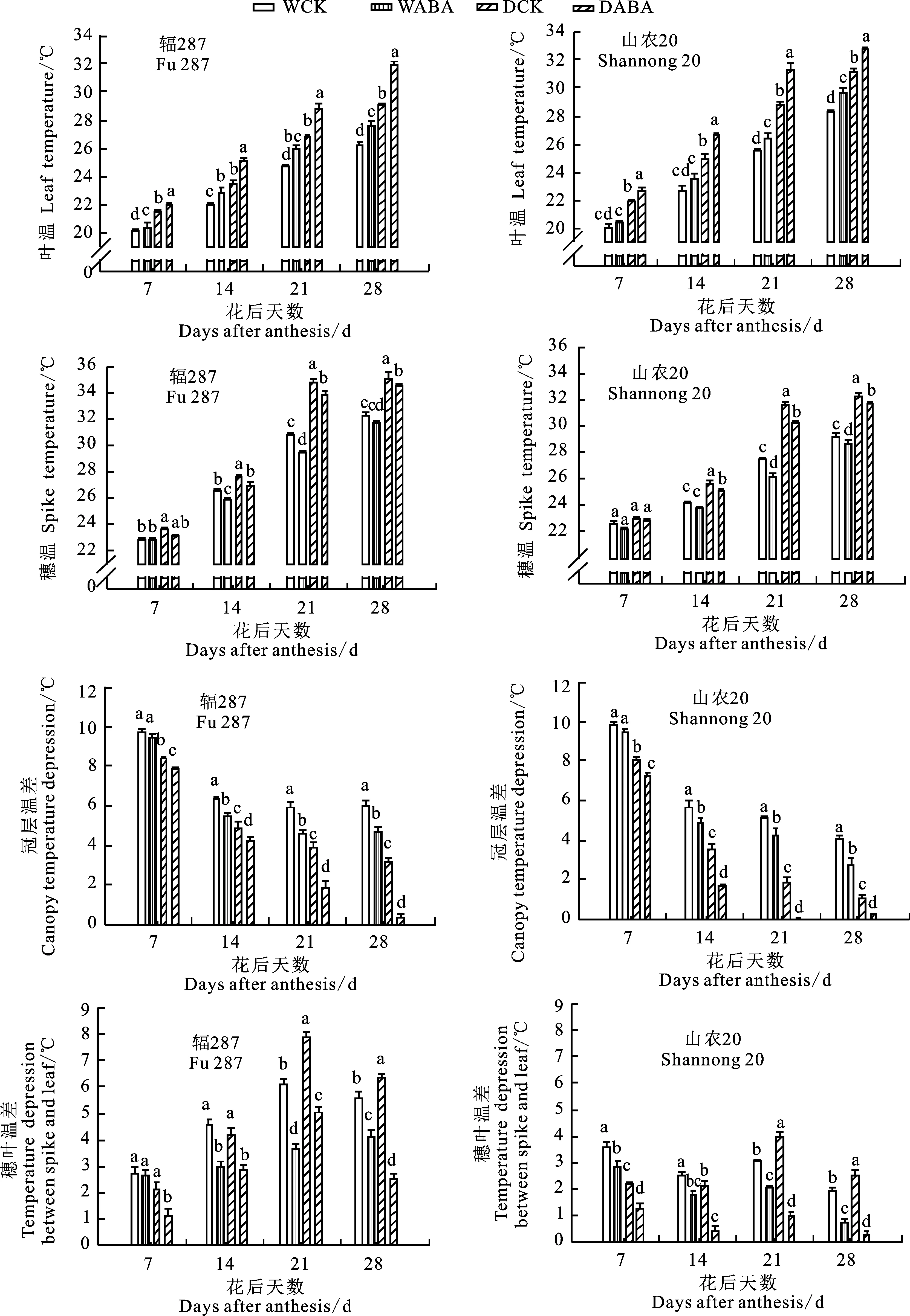
随着生育进程的推进,小麦花后旗叶温度及穗温均逐渐升高,干旱条件下叶温和穗温升高得更快(图2)。花后21 d不同处理间叶温和穗温差异最明显。其中,与正常灌水相比,干旱胁迫导致辐287的叶温及穗温分别升高2.16和3.96 ℃,山农20分别升高3.27和4.1 ℃。喷施外源ABA可以使叶温升高,降低穗温。花后21 d,在干旱条件下,与CK相比,ABA喷施后辐287和山农20叶温分别升高1.94和2.48 ℃,穗温分别降低 0.94和1.38 ℃。整个灌浆期间,山农20的冠层温度显著高于辐287。灌浆前期,在CK条件下,干旱处理的叶温升高幅度大于穗温,导致其穗叶温差显著低于正常灌水处理;随着叶片的衰老,灌浆后期干旱处理的穗温升高加快,导致其穗叶温差显著高于正常灌水处理,说明干旱胁迫加速了小麦叶片衰老。在干旱条件下,与CK相比,喷施ABA可以降低穗叶温差,灌浆中后期降辐更大。随着冠层温度的不断升高,冠层温差呈现下降趋势。灌浆中后期耐旱型品种山农20的冠层温差显著低于水分敏感型品种辐287。这说明干旱显著降低了冠层温差,干旱条件下喷施ABA可升高了冠层温度,降低其冠层温差。
2.3 干旱和外源ABA对小麦旗叶面积和叶绿素相对含量(SPAD值)的影响
辐287的旗叶面积显著大于山农20,但土壤水分和外源ABA对两个小麦品种旗叶面积影响不显著(图2)。花后两品种旗叶SPAD值均呈降低趋势,整个灌浆期间山农20显著高于辐287(图3)。干旱处理的SPAD值显著低于正常灌水处理,其中花后23 d两种处理间差异最大。与WCK处理相比,在花后23 d DCK处理下辐287和山农20的SPAD值分别降低35.04%和 25.73%。喷施ABA能显著提高SPAD值。在花后23 d,与DCK处理相比,在DABA处理下辐287和山农20的SPAD值分别提高20.03%和 24.48%。这表明喷施外源ABA可以减弱干旱小麦旗叶叶绿素分解的速率,延长叶片保绿时间。

表2 小麦营养器官干物质的转运量及其对籽粒产量的贡献率Table 2 Transportation amount and contribution rate of dry matter in vegetative organs of wheat
图柱上同一时期不同小写字母表示处理间在 0.05 水平上差异显著。下图同。
Different lower-case letters above the columns at the same stage indicate significant difference among the treatments at 0.05 level,The same in figures 2-5.
图1 不同处理下小麦花后冠层温度、叶温和穗温变化
Fig.1 Changes of canopy,leaf and spike temperature of wheat under different treatments after anthesis

图2 不同处理间小麦旗叶面积差异Fig.2 Differences of wheat flag leaf area among various treatments
2.4 干旱和外源ABA对小麦旗叶光合作用的 影响
花后两品种旗叶净光合速率、蒸腾速率及气孔导度均呈下降趋势(图4)。整个灌浆期间,干旱胁迫下山农20的净光合速率显著高于辐287。干旱处理的三个指标均显著低于正常灌水处理,在灌浆中后期下降更显著。其中,花后21 d两种处理间差异最大,DCK处理下辐287和山农20的净光合速率较WCK处理分别降低50.48%和29.85%,气孔导度分别降低26.79%和45.43%,蒸腾速率分别降低了26.46%和41.36%。喷施ABA能显著提高两品种净光合速率,其中花后21d,DABA处理下辐287和山农20的净光合速率较DCK处理分别提高53.35%和31.31%。同时,外源ABA使两品种气孔导度及蒸腾速率显著降低,其中花后21 d,与DCK处理相比,DABA处理下辐287和山农20的气孔导度分别降低35.46%和47.74%,蒸腾速率分别降低19.34%和32.23%。这说明外源ABA可缓解干旱对小麦旗叶光合和蒸腾作用的抑制效应。

图3 不同处理下小麦花后旗叶SPAD值的变化Fig.3 Changes of SPAD values in wheat flag leaf under different treatments after anthesis
2.5 干旱和外源ABA对小麦旗叶荧光参数的影响
花后两品种PIabs及φ0值随籽粒灌浆的进行均呈降低趋势(图5),表明小麦叶片光能吸收和光合电子传递能力均逐渐减弱。整个灌浆期间山农20的PIabs值均高于辐287。与WCK处理相比,DCK处理下两品种PIabs值均显著降低,尤其在灌浆后期,PIabs值降幅达到50%以上。喷施ABA能显著提高PIabs值,改善光合机构对光能的吸收,其中花后21 d升高幅度最大,DABA处理下辐287和山农20的PIabs值较DCK处理分别提升133.37%和82.49%。整个灌浆期间山农20的φ0值也均高于辐287。在灌浆中后期,与WCK处理相比,DCK处理后两品种φ0值均显著降低,尤其灌浆后期的降幅均达到50%以上。喷施ABA能显著增高φ0值,其中花后21 d,DABA处理后辐287和山农20的φ0值与DCK处理相比分别提升38.94%和32.86%。
花后两品种Vj和Wk值在籽粒灌浆过程中均呈逐渐升高趋势(图5),表明小麦光系统II活性反应中心的关闭程度及放氧复合体的受损害程度在不断增加。整个灌浆期间山农20的Vj值均低于辐287。与正常灌水处理相比,干旱显著提高灌浆中后期两品种的Vj值,其中花后21 d,DCK处理下辐287和山农20的Vj值与WCK处理相比分别升高31.57%和26.99%。喷施ABA能显著降低Vj值,减少光合电子传递链中质体醌阴离子的积累量,其中花后21 d,DABA处理后辐287和山农20的Vj值较DCK处理分别降低14.56%和15.47%。灌浆中后期山农20放氧复合体受损害程度低于辐287。干旱胁迫导致两品种Wk值均显著升高,其中花后21 d,DCK处理后辐287和山农20的Wk值与WCK处理相比分别提高30.85%和22.49%。喷施ABA也降低了Wk值,其中花后21 d,DABA处理下辐287和山农20的Wk值与DCK处理相比分别降低13.6%和13.57%。
2.6 干旱和外源ABA对小麦籽粒灌浆过程的 影响
2.6.1 籽粒增重过程
两品种强、弱势籽粒增重过程均呈“S”型曲线变化(图6),随着籽粒灌浆的进行,不同处理间差异逐渐增大,花后30 d强、弱势粒重达最大值。
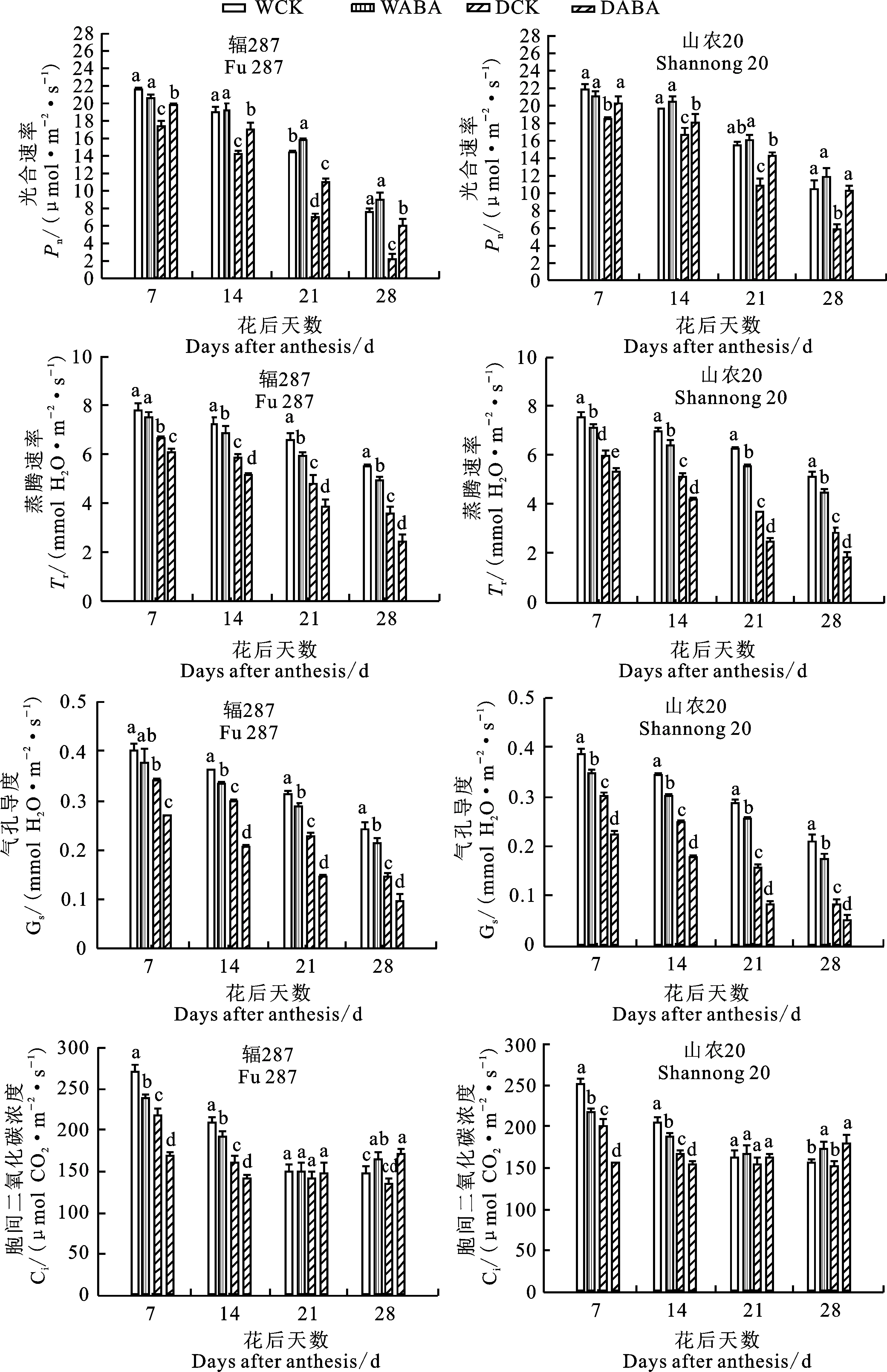
图4 不同处理下小麦花后旗叶光合参数变化Fig.4 Changes of photosynthetic parameters of wheat flag leaf under different treatments after anthesis
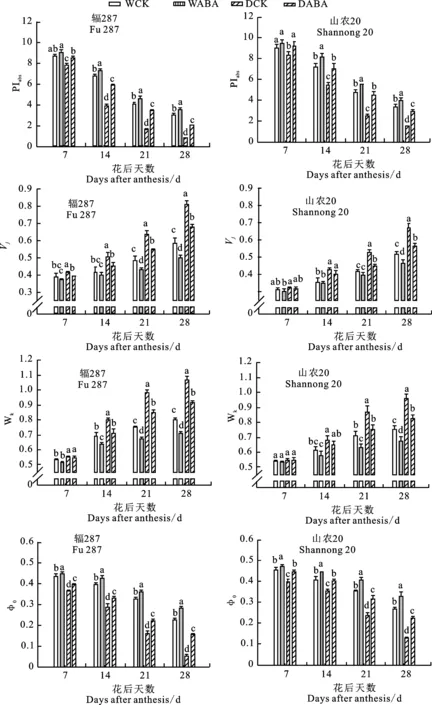
图5 不同处理下小麦花后旗叶荧光参数变化Fig.5 Changes of chlorophyll fluorescence parameters of wheat flag leaf under different treatments after anthesis
灌浆中后期山农20强、弱势粒重显著高于辐287。干旱胁迫显著降低了两品种强、弱势粒重,且灌浆中后期降幅更大。花后30 d,与WCK处理相比,DCK处理下辐287的强、弱势粒重分别降低16.21%和16.91%,山农20分别降低 11.88%和6.79%。喷施ABA 可以促进籽粒灌浆,强弱势粒重均显著提高。花后30 d,与DCK处理相比,DABA处理下辐287强、弱势粒重分别提高 7.43%和12.44%,而山农20分别提高7.42%和6.77%。
2.6.2 灌浆速率
灌浆过程中两品种强、弱势籽粒灌浆速率均呈先升后降趋势(图7),其中辐287的强、弱势粒分别在花后13、15 d达最大值,而山农20分别在花后14、13 d达最大值。与WCK处理相比,DCK处理下辐287的强、弱势粒灌浆速率在花后3~25 d均显著降低,山农20强势粒在花后13~25 d、弱势粒在花后5~15 d显著下降。与DCK处理相比,DABA处理下辐287强势粒在花后 5~25 d及弱势粒在花后5~11 d和19~27 d的灌浆速率显著提高,山农20强势粒在花后5~ 11 d和17~30 d及弱势粒在花后5~17 d的灌浆速率显著提高。
2.6.3 籽粒灌浆参数
山农20强势粒的最大灌浆速率、平均灌浆速率及活跃生长期均大于辐287,并且两个品种强势粒最大灌浆速率、平均灌浆速率和生长活跃期均高于弱势粒(表3),说明山农20的较高粒重主要归因于最大灌浆速率和平均灌浆速率较大。与WCK处理相比,DCK处理下辐287的最大灌浆速率、平均灌浆速率及生长活跃期均显著降低,山农20的最大灌浆速率、平均灌浆速率显著降低,说明灌浆期干旱胁迫下,水分敏感型品种的粒重降低主要是籽粒灌浆速率下降和生长活跃期缩短引起,而耐旱型品种主要是籽粒灌浆速率降低所致。与DCK处理相比,DABA处理下两品种强势粒最大灌浆速率、平均灌浆速率、生长活跃期及实际灌浆终期均有所提高,说明喷施ABA后粒重的增加主要是由于其灌浆速率提高和生长活跃期延长。
2.7 干旱和外源ABA对小麦产量及其构成的影响
山农20的平均千粒重及产量均显著高于辐287(表4)。干旱胁迫导致两品种千粒重及产量均下降,对穗数和穗粒数影响不明显。与WCK处理相比,DCK处理后辐287的千粒重及产量分别降低15.76%和21.08%,山农20分别降低
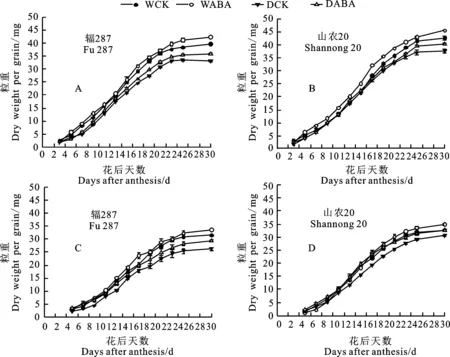
A和B: 强势粒; C和D: 弱势粒。图7同。
A&B:Superiorgrain; C&D: Inferior grain. The same in figure 7.
图6 不同处理下小麦粒重变化
Fig.6 Change of wheat grain weight under different treatments after anthesis
10.36%和13.32%,说明灌浆期干旱主要通过降低粒重造成小麦减产。与DCK处理相比,DABA处理下辐287千粒重和产量分别升高 7.02%和7.08%,山农20分别升高6.65%和 8.97%,说明喷施ABA可以减弱干旱对千粒重的不利影响,进而增加产量。

图7 不同处理下小麦籽粒灌浆速率变化Fig.7 Change of grain filling rate of wheat under different treatments表3 小麦籽粒灌浆模拟方程及籽粒灌浆特征参数Table 3 Grain filling parameters and grain filling process model of wheat
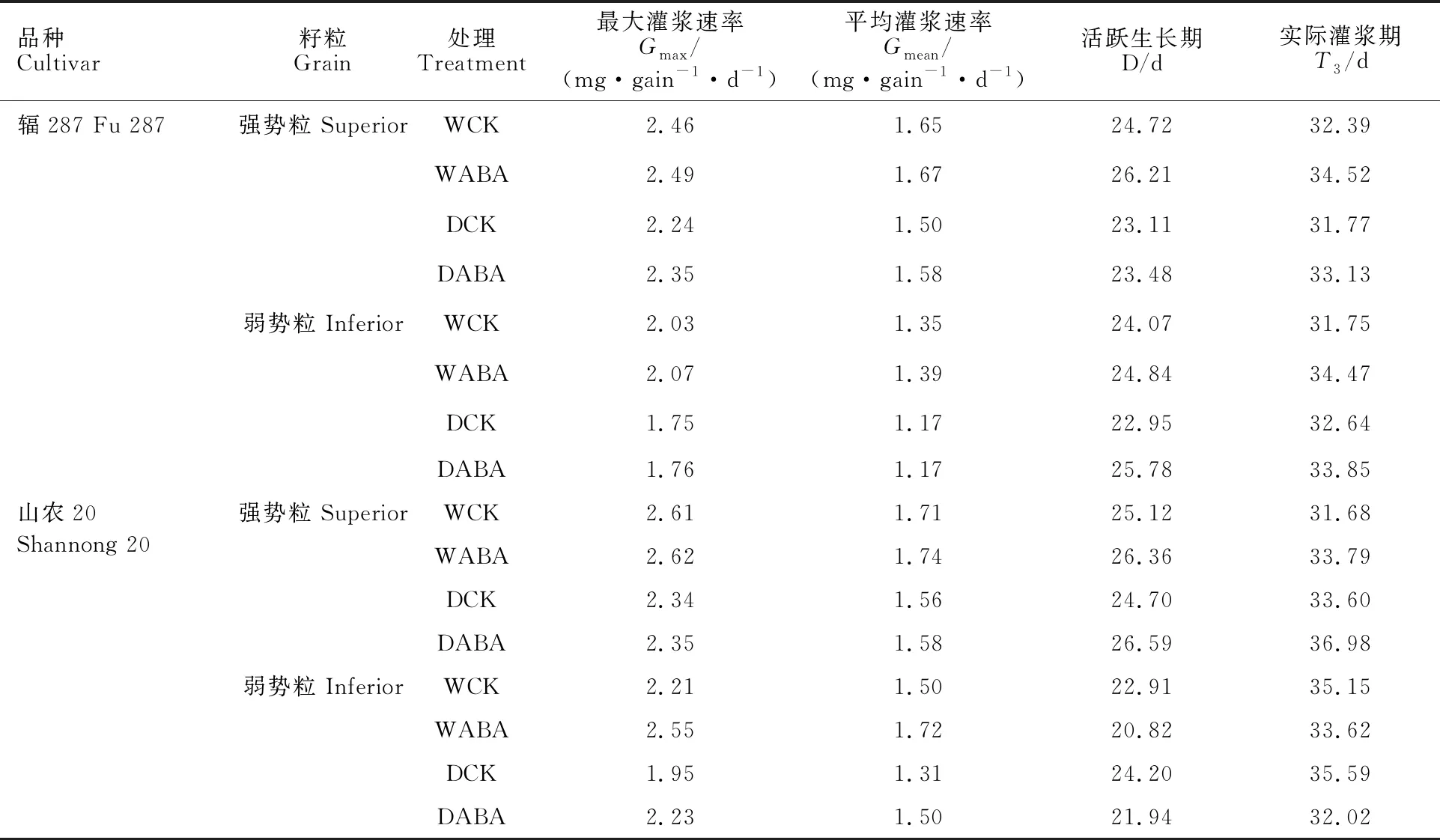
品种Cultivar籽粒Grain处理Treatment最大灌浆速率Gmax/(mg·gain-1·d-1)平均灌浆速率Gmean/(mg·gain-1·d-1)活跃生长期D/d实际灌浆期T3/d辐287 Fu 287强势粒 SuperiorWCK2.461.6524.7232.39WABA2.491.6726.2134.52DCK2.241.5023.1131.77DABA2.351.5823.4833.13弱势粒 InferiorWCK2.031.3524.0731.75WABA2.071.3924.8434.47DCK1.751.1722.9532.64DABA1.761.1725.7833.85山农20 强势粒 SuperiorWCK2.611.7125.1231.68Shannong 20WABA2.621.7426.3633.79DCK2.341.5624.7033.60DABA2.351.5826.5936.98弱势粒 InferiorWCK2.211.5022.9135.15WABA2.551.7220.8233.62DCK1.951.3124.2035.59DABA2.231.5021.9432.02
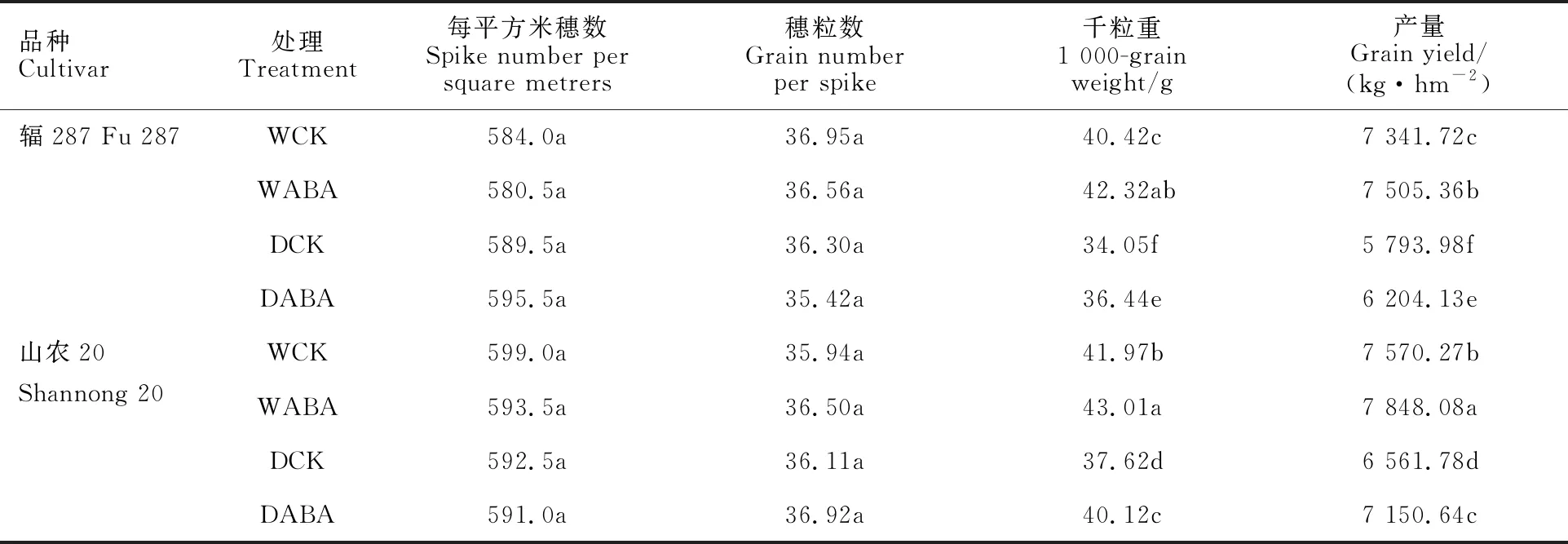
表4 不同处理下小麦产量及其构成因素差异Table 4 Difference in grain yield and its components of wheat among different treatments after anthesis
3 讨 论
本试验结果表明,灌浆期干旱胁迫条件下两品种粒重及产量均出现了不同程度的下降,且耐旱型品种山农20降幅显著小于水分敏感型品种辐287,说明耐旱型小麦具有显著稳产优势。这与前人研究结果基本一致[21]。杨东清等[22]研究表明,高温胁迫条件下,喷施外源ABA可以提高内源 ABA含量,促使籽粒胚乳细胞分裂速率提高,数目增大,进而引起籽粒产量显著提高。本试验中,干旱条件下喷施外源ABA后两品种千粒重及产量均显著提高。
小麦花后至成熟期是籽粒形成的关键时期,在籽粒灌浆的过程中叶片光合作用的强弱对最终产量的形成具有重要意义[23]。前人研究认为,小麦旗叶面积与其光合能力及穗粒重间存在密切关系[24-25]。本试验中,水分敏感型品种辐287较耐旱型品种山农20有较大的旗叶面积,但辐287的净光合速率及产量均显著低于山农20,这是由于群体及旗叶面积较大,导致有限的光资源分配比例减小,叶片间遮荫作用增大,从而引起群体光合能力降低,最终导致产量下降[26]。通过分析叶绿素荧光动力学参数,可以评估对光系统和光合电子传递链的活性[27],同时这些参数也是评价光合机构的功能和光合同化速率的重要指标[28]。本试验结果显示,干旱处理加剧对旗叶放氧复合体的损伤,降低了光合机构吸收光能及光系统的电子传递能力。这是因为过剩的光能会导致细胞内活性氧增多,加剧了光合机构的损伤,最终影响光合作用[29]。汪月霞等[30]研究表明,外源ABA能抑制光系统II原初光能转化效率降低,进而促进光合作用。本试验中,干旱条件下喷施外源ABA可以显著提高PIabs和φ0值,降低Vj和Wk值,说明外源ABA改善了干旱胁迫对光合机构造成的负面影响。这可能是由于外源 ABA 处理能够明显缓解因干旱胁迫引起的psbA基因转录水平降低,从而加快新D1蛋白的合成以修复受损 PSII复合体[31]。Kobata等[32]研究认为,灌浆期水分胁迫造成功能叶衰老加速、光合能力下降是小麦籽粒产量降低的主要原因。本研究表明,干旱处理后两品种气孔导度及蒸腾速率均显著降低,且中后期两品种各处理的胞间二氧化碳浓度不断降低。这表明干旱处理后两品种中后期光合速率降低均为非气孔限制因素导致[33]。此外。山农20的气孔导度及蒸腾速率降幅显著高于辐287,导致其叶温显著高于辐287,但山农20的叶绿素相对含量及净光合速率下降相对缓慢。这表明当供水不能满足植物蒸腾需求时,耐旱型品种水分蒸发量小,蒸腾散热减少,冠层温度升高较快,也说明耐旱型品种光合持续期较长且保水能力较强[30-34]。干旱条件下喷施ABA可以减小叶片同化能力降低幅度。这与Travaglia等[17]和杨东清等[22]的研究结果基本一致。另外,干旱胁迫下外源ABA可以显著降低蒸腾速率和气孔导度,增强叶片保水能力,导致CTD的降低。这是由于ABA会诱导叶片细胞质膜上的信号传导,导致叶片气孔不均匀关闭,提高叶片气孔阻力,减少水分蒸腾散失量,提高叶片相对含水量,进而增强植株自身调节能力和抵御干旱的能力[35-36]。
前人研究表明,小麦籽粒产量形成主要来源于花后光合同化物的积累及花前营养器官贮藏干物质向籽粒的转运[37-38]。本试验结果表明,辐287籽粒产量的形成既依赖于花前营养器官贮藏同化物向籽粒的转运,同时需要花后光合同化物的积累,但山农20花前贮藏同化物转运量较少,籽粒产量的形成主要依赖于花后光合同化物的积累。这说明小麦营养器官贮藏同化物的转运主要受基因型的影响[39]。不同时期的光合同化物对耐旱型品种和水分敏感型品种产量的贡献率不同。干旱条件下两品种小麦花前同化物的贡献率均显著提高,这与Foulkes等[40]研究结果基本一致。籽粒灌浆速率和籽粒灌浆持续期决定小麦粒重,对产量变化有显著影响[41]。张伟杨等[42]研究认为,重度水分胁迫会显著降低小麦籽粒灌浆速率和粒重。本试验中,干旱处理显著降低了两品种强、弱势粒灌浆速率,缩短了强势粒灌浆的活跃生长期,与水分敏感型品种辐287相比,耐旱型品种山农20主要是通过提升强势粒的灌浆速率和活跃生长期来增大粒重。这与前人研究结果基本一致[43]。此外,随着籽粒灌浆的进行,穗温不断升高,穗叶温差加大,这可能是由于后期穗部含水量的降低速度显著快于叶片的衰老速率。杨东清等[22]的研究结果显示,高温胁迫下喷施ABA可以提高籽粒的灌浆速率。本试验表明,干旱条件下喷施外源ABA后,延长了灌浆的活跃生长期并显著提高强、弱势粒灌浆速率,最终提高粒重及产量。
综上所述,耐旱型品种产量高于水分敏感型品种的主要原因是由于其叶片衰老较慢,叶片保水能力强,具有较强的光合能力和较长的光合持续期,并且其花后光合积累量大,有利于籽粒灌浆增重,最终促进千粒重及产量的提高。喷施外源ABA有利于提高小麦旗叶PIabs、φ0值、叶绿素相对含量及净光合速率,降低Vj、Wk、蒸腾速率和气孔导度,增强叶片保水能力和光合机构活性,延长光合持续时间,减弱干旱处理对植株衰老的影响;同时其可以提高灌浆速率及同化物积累量和分配至籽粒的比例,延长籽粒活跃生长期,降低穗叶温差,获得更高的粒重及产量。因此,当灌浆期发生水分胁迫时,喷施ABA可以显著提高小麦叶片光合性能,优化同化物分配,进而实现小麦的抗旱稳产。

