6种常见食材抗氧化及抑制乙酰胆碱酯酶活性
王馨悦 陈华国 周欣


摘要:以黑莓、桑椹、红布李、紫薯、黑米、黑豆为试验材料,乙醇为溶剂,对6种食材进行花青素提取;采用DPPH和ABTS 2种方法测定6种提取物的抗氧化活性,利用Pearson原理分析6种提取物中花青素含量与抗氧化活性的相关性,初步探索二者规律;并采用分光光度法测定花青素提取物对乙酰胆碱酯酶抑制活性,以期为花青素的深度研究及开发利用提供参考。结果表明,6种食材提取物均具有良好的抗氧化活性,清除自由基能力大小顺序为红布李>桑椹>黑莓>紫薯≈黑米>黑豆,其中红布李提取物清除DPPH自由基能力与维生素C相近,其IC50值为39.38 μg/mL,且花青素含量与抗氧化能力显著正相关;研究发现5种食材花青素提取物均对乙酰胆碱酯酶有抑制作用。
关键词:花青素;抗氧化;抑制乙酰胆碱酯酶;DPPH;ABTS
中图分类号: Q946.83+6
文献标志码: A
文章编号:1002-1302(2019)15-0208-04
随着人们生活水平的提高,健康养生已成为人们关注的焦点。花青素是广泛存在于植物花瓣、果实组织及茎叶的表面细胞与下表皮层中的一类可溶于水的天然色素,具有抗氧化、降血糖、降血脂、减肥、抗炎、改善视力等多种药理作用,因此花青素成为当今国内外科技工作者研究的热点之一。富含花青素的植物尤以果蔬居多,据初步统计:在27个科,73个属植物组织中均含有一定含量的花青素,如桑椹、紫薯、葡萄、紫甘蓝等[1],另外多数黑色杂粮也富含花青素,黑米,黑豆是工业中提取矢车菊素的常见原料。
目前对花青素的研究集中在花青素的提取分离纯化方法、抗氧化活性方面以及少部分的含量测定和组分鉴定的研究,研究内容和形式略显单一,大多数研究仅限于对某一种样品(蓝莓、紫甘蓝等)的提取工艺或某一类物质(特别是矢车菊素)的含量测定及抗氧化活性的单方面研究,对常见食材如水果红布李等的研究及其他生物活性特别是抑制乙酰胆碱酯酶活性的研究略为缺乏。因此,多方面、多维度深度综合评价花青素的性质已是一种趋势。众所周知,乙酰胆碱酯酶是目前治疗阿尔茨海默症的有效靶点之一,通过对乙酰胆碱酯酶的可逆性抑制,可有效缓解或治疗老年痴呆症。本研究选择6种不同植物来源的食材为研究对象,其中包括蔬菜(紫薯)、水果(黑莓、红布李、桑椹)、粮食(黑米、黑豆),对其花青素提取物的含量与抗氧化活性进行对比,并进行相关性分析,初步探索花青素含量与抗氧化活性的规律,并对6种样品提取物抑制乙酰胆碱酯酶活性进行研究。
1 材料与方法
1.1 材料与试剂
黑莓、桑椹、红布李、紫薯、黑米、黑豆均采购于贵州省贵阳市云岩区富水北路北京华联超市。
所用药品试剂有2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)(分析纯,美国Sigma公司生产);5,5′-二硫代双(2-硝基苯甲酸)(DTNB)(分析纯,贵州迪大科技有限责任公司生产);1,1-二苯基-2-三硝基苯肼(DPPH)(分析纯,贵州迪大科技有限责任公司生产);矢车菊-3-O-葡萄糖苷,维生素C(分析纯,贵州迪大科技有限责任公司生产);乙酰胆碱酯酶(AChE)(分析纯,大连美仑生物技术有限公司生产);碘代硫代乙酰胆碱(ATCI)(分析纯,大连美仑生物技术有限公司生产);乙腈(色谱纯,美国Tedia公司生产)。
1.2 仪器与设备
Agilent 1260高效液相色谱仪(美国Agilent公司生产);Spectra Max Plus 384酶标仪(美国Molecular Devices公司生产);XS 105十万分之一分析天平、AL 204万分之一分析天平[梅特勒-托利多仪器(上海)有限公司生产];R-200旋转蒸发仪(瑞士BUCHI公司生产);电热恒温水浴锅(天津市泰斯特仪器有限公司生产);Eppendorf research plus微量移液器(德国Eppendorf公司生产);TD5M低速離心机(长沙迈佳森仪器设备有限公司生产);三洋微波炉EM-202MS1(合肥荣事达三洋电器有限公司生产);美的搅拌机MJ-220BP01A(广东美的生活电器制造有限公司生产)。
1.3 试验方法
整个试验于2017年在贵州师范大学山地环境重点实验室完成。
1.3.1 样品的制备 花青素的提取:参照文献[2]并略作修改,新鲜果蔬粉碎匀浆后,以1 ∶ 10的料液比加入52%的乙醇溶液,微波提取4 min(微波功率469 W),提取液于低速离心机3 500 r/min离心5 min后取上清液减压浓缩,存放于 -4 ℃,备用。花青素的纯化:参照笔者所在实验室前期工作[3],将粗提物加水稀释至花青素浓度为0.75 mg/mL,HCl调节pH值为1。聚酰胺树脂(60~100目)用95%乙醇煮沸4 h后以纯水洗净,作为填料,装柱,将稀释后的样品提取物以5 BV/h的速度上柱5 BV,随后用3 BV纯水洗脱,再用pH值为3的80%乙醇以5 BV/h的速度洗脱3.5 BV,洗脱液经减压浓缩后真空冷冻干燥得样品粉末,装于棕色瓶,保存在干燥器中。花青素的水解:取1 mL样品溶液(约1 mg/mL)加入到比色管中,再加入4 mL高浓度盐酸水解液(盐酸 ∶ 水 ∶ 甲醇体积比=1 ∶ 1 ∶ 2)摇匀,沸水中水浴1 h,冷却至室温,备用。
1.3.2 样品中花青素含量的测定 取1 mL花青素样品溶液(以52%乙醇溶液为空白)加入到10 mL比色管中,加入 5 mL 的1%盐酸甲醇溶液让其显色,充分振荡摇匀,50 ℃水浴10 min,取出,冷却至室温,于530 nm处测定其吸光度[2]。
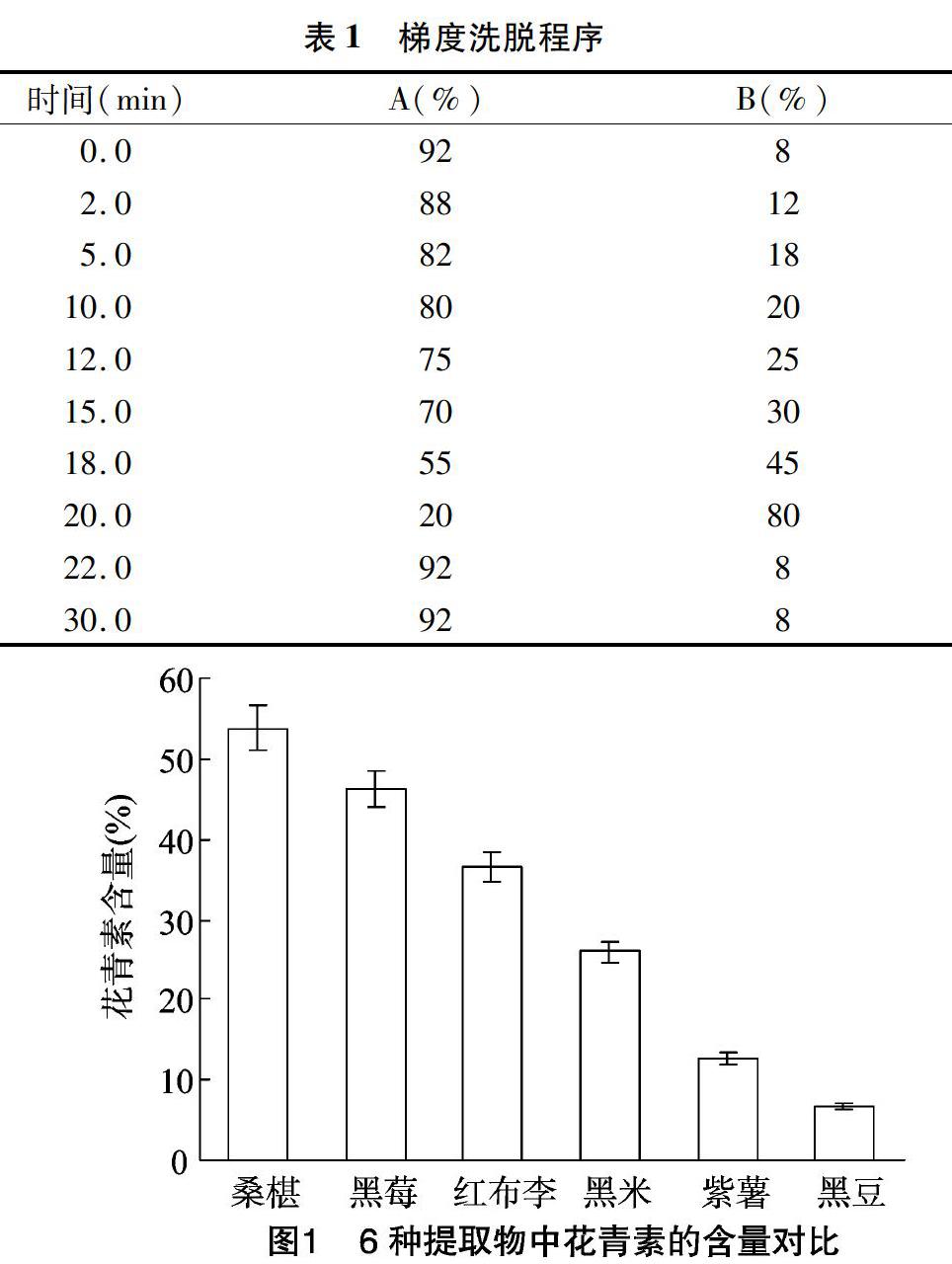
1.3.3 6种样品花青素成分分析 采用高效液相色谱法对样品中花青素种类进行初步分析,液相色谱条件参照胡莉等方法[4]并稍作修改。色谱柱为Hypersil GOLD C18柱(250 mm×4.6 mm)。流动相A为水(含0.33%甲酸),B为乙腈;进样量为20.0 μL,柱温为35 ℃,检测波长为530 nm,梯度洗脱程序见表1。
1.3.4 ABTS自由基清除能力测试 ABTS自由基溶液[5]由14 mmol/L ABTS溶液和5 mmol/L K2S2O8水溶液以1 ∶ 1的比例混合后避光反应12~16 h后使用,使用时稀释50倍。样品溶液(Di)的制备,分别取0.2 mL不同浓度的花青素样品溶液于1.5 mL的离心管中,再加入0.8 mL ABTS自由基溶液混合均匀,室温避光反应6 min,于734 nm处测定吸光度。以0.8 mL 52%乙醇代替ABTS溶液为对照(Dj),测定吸光度,空白(D0)以相同体积水代替样品溶液,根据计算公式:清除率=(D0-Di-Dj)/D0×100%;计算样品ABTS自由基清除率。以维生素C为对照品,以维生素C浓度(μg/mL)为横坐标,以ABTS自由基清除率(%)为纵坐标,得出线性回归方程:y=5.330 8x-29.260 0(r2=0.951 9)。花青素样品的ABTS自由基清除能力以IC50(μg/mL)表示。
1.3.5 DPPH自由基清除能力测试 参考Kim等的方法[6]略有改动,进行DPPH自由基清除试验。称取9.86 mg DPPH溶于无水乙醇溶液中,定容100 mL,现配现用。分别取 0.2 mL 不同浓度的花青素样品溶液于1.5 mL离心管中,加入0.8 mL DPPH乙醇溶液,37 ℃避光反应30 min后,以乙醇作对照,在波长517 nm处测定吸光度,空白溶液以相同体积52%乙醇代替样品反应,计算样品DPPH自由基清除率。以维生素C为对照品,以维生素C浓度(μg/mL)为横坐标,以DPPH自由基清除率(%)为纵坐标,得出线性回归方程:y=1.1092x-7.237 2(r2=0.997 0)。花青素样品的DPPH自由基清除能力以IC50(μg/mL)表示。
1.3.6 抑制乙酰胆碱酯酶活性测试 采用改良的Ellman等的分光光度法[7]对6种不同果蔬的花青素提取物进行乙酰胆碱酯酶活性抑制研究。方法如下:将样品以52%乙醇溶解稀释至不同质量浓度的样液。整个反应在酶标板中进行,反应体系中各加入20 μL样液、120 μL 0.1 mol/L PBS(pH值72)、20 μL乙酰胆碱酶(0.64 μg/mL)和20 μL 75 mmol/L ATCI溶液,在37 ℃保温20 min后加入20 μL DTNB溶液,室温下避光放置20 min后立即在波长405 nm处测量吸光度(D样品)。52%乙醇代替样品溶液测得空白值为D空白;PBS代替酶溶液的空白溶液吸光度为D空白本底,PBS代替酶溶液测定样品溶液的吸光度为D样品本底。以氢溴酸加兰他敏为阳性对照,乙酰胆碱酯酶活性抑制率=[(D空白-D空白本底)-(D样品-D样品本底)]/(D空白-D空白本底)×100%,试验重复3次,求平均值。
1.4 数据处理
试验重复3次,数据以平均值表示,使用Excel 2016和SPSS 21.0软件对数据进行统计学分析。
2 结果与分析
2.1 6种提取物中花青素含量的测定
由图1可知,经初步纯化后6种样品的花青素含量高低顺序为桑椹>黑莓>红布李>黑米>紫薯>黑豆。桑椹样品中花青素含量最高,为53.78%;其余5种样品的含量依次为46.14%、36.44%、26.05%、12.63%、6.80%。据相关文献报道,黑莓中还含有丰富的非花色苷类多酚类物质,主要是黄烷醇和黄酮醇等,红布李中也含有丰富的酚类物质。
2.2 6种提取物中花青素成分分析
由于自然界中游离态花青素苷元极少,多数花青素通过糖基化或酰基化而稳定存在果蔬中,这使得花青素种类繁多且极性相近,给研究带来诸多不便[8],因此,以水解后的样品提取物及矢车菊-3-O-葡萄糖苷为对象简要分析各样品中所含花青素的苷元種类。水解后的矢车菊-3-O-葡萄糖苷在11.895 min处有强吸收,如图2-A所示。从图2-B可知,紫薯中所含花青素种类较多,在11.917 min处的吸收较弱说明矢车菊素及其衍生物含量较低,但在15.823 min有强吸收峰,该色谱峰为芍药色素,与相关文献报道的紫薯花青素主要为芍药色素及其衍生物,也含有少量的矢车菊素的结论一致。另外,根据图2-C中与矢车菊3-O-葡萄糖苷标准品的水解色谱图出峰时间对比可知,桑椹、黑莓、黑米、红布李提取物水解后的主要产物为矢车菊素,说明这4种样品提取物中所含花青素主要为矢车菊素及其衍生物,因此工业中常用黑米或黑豆作为提取矢车菊素-3-O-葡萄糖苷的原料。文献报道黑莓中所含花青素也是主要为矢车菊素-3-O-葡萄糖苷,经过色谱图比对可知黑米中也含有少量的芍药色素,这与Fabroni等的研究结论[9]一致。
2.3 抗氧化活性
维生素C是一种公认的具有强抗氧化活性的物质,常作为抗氧化活性研究的阳性对照,通过与维生素C对比可评价被测物质的抗氧化能力强弱。DPPH和ABTS自由基清除能力的结果通过SPSS 21.0软件对数据进行统计学分析,以IC50值表示,IC50值越小,说明DPPH和ABTS自由基清除能力越强。根据表2可知,6种样品中红布李的抗氧化活性最强,DPPH的IC50值最小,为39.38 μg/mL,其DPPH自由基清除能力接近于维生素C(38.55 μg/mL),高于矢车菊素3-O-葡萄糖苷(42.65 μg/mL),其余5种样品相对较弱,以黑豆提取物最弱。各提取物对ABTS自由基的清除能力都较强,矢车菊素、红布李、桑椹三者的清除能力接近。总的来说,各个样品对ABTS和DPPH自由基清除能力的趋势基本一致。其中DPPH自由基清除率大小顺序为维生素C>红布李>矢车菊素-3-O-葡萄糖苷>桑椹>黑莓>紫薯>黑米>黑豆,ABTS自由基清除率大小顺序为维生素C>矢车菊素-3-O-葡萄糖苷>红布李>桑椹>黑莓>黑米>紫薯>黑豆。
[4]胡 莉,仲伶俐,毛建霏,等. 高效液相色谱测定粮食、蔬菜和水果中的花青素[J]. 分析试验室,2012(12):43-47.
[5]Re R,Pellegrini N,Proteggente A,et al. Antioxidant activity applying an improved ABTS radical cation decolorization assay[J]. Free Radical Biology and Medicine,1999,26(9/10):1231-1237.
[6]Kim D O,Jeong S W,Lee C Y. Antioxidant capacity of phenolic phytochemicals from various cultivars of plums[J]. Food Chemistry,2003,81(3):321-326.
[7]Ellman G L,Courtney K D,Andres V,et al. A new and rapid colorimetric determination of acetylcholinesterase activity[J]. Biochemical Pharmacology,1961,7(2):88-95.
[8]毛建霏,周 虹,雷绍荣,等. 高效液相色谱法测定紫甘薯花青素含量[J]. 西南农业学报,2012,25(1):123-127.
[9]Fabroni S,Ballistreri G,Amenta M,et al. Screening of the anthocyanin profile and in vitro pancreatic lipase inhibition by anthocyanin-containing extracts of fruitcs,vegetables,legumes and cereals[J]. Journal of the Science of Food and Agriculture,2016,96(14):4713-4723.
[10]刘 翠,陈素华,陈少云,等. 中国野生笃斯越橘花青素的初步分离和分析[J]. 中国生物化学与分子生物学报,2009,25(1):57-64.
[11]Krikorian R,Shidler M D,Nash T A,et al. Blueberry supplementation improves memory in older adults[J]. Journal of Agricultural and Food Chemistry,2010,58(7):3996-4000.
[12]Ryu H W,Curtislong M J,Jung S,et al. Anticholinesterase potential of flavonols from paper mulberry (Broussonetia papyrifera) and their kinetic studies[J]. Food Chemistry,2012,132(3):1244-1250.
[13]Gutierres J M,Carvalho F B,Schetinger M R,et al. Anthocyanins restore behavioral and biochemical changes caused by streptozotocin-induced sporadic dementia of Alzheimers type[J]. Life Sciences,2014,96(1/2):7-17.
[14]Costa P,Grosso C,Goncalves S,et al. Supercritical fluid extraction and hydrodistillation for the recovery of bioactive compounds from Lavandula viridis LHér[J]. Food Chemistry,2012,135(1):112-121.
[15]Gupta A,Gupta R. A survey of plants for presence of cholinesterase activity[J]. Phytochemistry,1997,46(5):827-831.
[16]劉 翠. 中国野生笃斯越橘花青素的提取分离、组分分析及抗氧化活性的研究[J]. 青岛:中国海洋大学,2009.杨新周,杨兰芬,田孟华,等. 不同产地白花蛇舌草傅里叶红外光谱识别[J]. 江苏农业科学,2019,47(15):212-219.

