NaCl对冰菜生长发育及重要品质的影响
刘慧颖 韩玉燕 蒋润枝 周志疆 张桢 程立宝


摘要:冰菜对盐胁迫具有较强的适应能力,为了探究NaCl对其生长发育及重要品质的影响,用0.1%、0.3%、0.5%、0.7% NaCl分别处理冰菜种子和4叶期幼苗,分析并总结种子萌发率、株高、株幅、叶绿素含量、过氧化物酶(POD)活性、超氧化物歧化酶(SOD)活性、可溶性膳食纤维含量和黄酮含量等生理生化指标的变化。结果表明,不同浓度的NaCl均能抑制冰菜种子萌发和植株的高度,且浓度越大,抑制效果越显著。在处理10~20 d内,除了0.7% NaCl处理外,其他浓度处理后冰菜株幅与对照相比无明显差异,在處理30~50 d内,0.5%、0.7% NaCl处理显著高于对照和其他处理。植株生长前期,高浓度的NaCl(0.7%)显著抑制了植株叶绿素含量,而30~50 d内,NaCl浓度越高,叶绿素含量也越大。对照和处理植株的POD、SOD活性总体上呈先升高后降低的趋势,0.1%、0.3% NaCl处理的植株中POD和SOD活性显著高于对照和其他处理,而0.5%、0.7% NaCl处理的2种酶活性总体小于对照。处理前期,0.1%、0.3%、0.5% NaCl处理显著提高了植株可溶性膳食纤维含量,40 d后,各处理的可溶性膳食纤维含量显著低于对照植株。同时NaCl处理(除第10天外)显著地降低了植株体内黄铜含量,各个处理在20~50 d内黄酮含量均显著低于对照。综合以上研究结果,低浓度的NaCl(0.1%、0.3%)处理有利于植株生长发育,这为扩大冰菜种植范围和利用冰菜改良盐碱土地具有重要的现实意义。
关键词:冰菜;盐胁迫;生长发育;叶绿素;品质
中图分类号: S636.901
文献标志码: A
文章编号:1002-1302(2019)15-0184-04
盐是影响植物生长发育的重要环境因子之一,随着全球环境不断恶化,土壤盐碱化已成为全球共同面临的环境问题。据不完全统计,世界盐渍土面积约9.5亿hm2,我国约占据了10%[1]。这些天然固有的盐碱土地、沿海滩涂和设施次生盐渍化土壤均已严重制约了农作物分布、产量和品质[2-3]。盐胁迫是目前自然界中主要的非生物胁迫之一,对植物种子萌发、形态发育、光合特征、生理生化特性和离子稳态等均有一定的影响。王鹏山等研究表明,随着NaCl浓度增加,狼尾草种子发芽相关指标均显著下降[4]。而光果甘草种子的发芽率随着NaCl浓度增加呈先增加后降低的趋势[5]。郭艳超等发现,低盐胁迫促进了甜菜单株叶面积的增加,而高盐胁迫导致甜菜叶片生长受阻[6]。近年来,随着科学技术的发展,人们对利用盐碱地或沿滩地有了充分的认识。通过引进或培育耐盐植物品种,因地制宜地开展耐盐碱农作物栽培,既充分利用了土地,同时提高了经济效益[7]。
冰菜(Mesembryanthemum crystallinum Linn.)为番杏科(Aizoaceae)日中花属(Mesembryanthemum L.)一二年生草本耐盐植物,其产品富含多种有机营养物质(黄酮、芒柄醇、肌醇和松醇)和矿质元素(钙、钠和钾),同时也具有一定的医疗价值[7]。冰菜起源于非洲,近期先后引进到我国,在黄河流域及其以南地区均有种植。冰菜对盐碱胁迫具有一定的适应性,植株可在低浓度盐碱土壤中维持正常生长。冰菜属于泌盐植物,能够把盐运输到叶表面的冰晶状液泡中。根据发育特点,冰菜生长分为5个时期,即萌发期、幼苗期、营养生长期、生殖生长期和凋亡期。研究发现,冰菜萌发期和幼苗期,适宜的盐浓度有利于植株营养生长,同时抑制了生殖生长,盐浓度过高,植株生长也会受到抑制[8]。
江苏省海岸线较长,是全国沿海滩涂面积最大的省,滩涂已成为开发潜力最大的土地后备资源。滩涂土壤盐碱含量高,常规农作物难以维持正常生长,因此选择种植耐盐冰菜植物,既充分利用盐碱土壤,提供具有特殊营养和保健价值的功能性食品,同时对改善土壤环境具有一定的作用。由于冰菜在国内种植时间较短,相关研究比较滞后,所以本试验主要研究了冰菜在不同浓度NaCl溶液处理下,种子萌发率、植株株高、株幅、叶绿素含量、POD活性、SOD活性、可溶性膳食纤维含量和黄酮含量等指标的变化,为今后开展盐碱土地种植冰菜提供理论依据。
1 材料与方法
1.1 试验材料
试验材料:J0810-2冰草品种,由江苏丰收大地种业发展有限公司提供。于2017年11月4日种植于扬州大学园艺与植物保护学院蔬菜生理生化实验室,栽培措施参照常规的大田管理,试验结束于2018年10月30日。
1.2 试验设计
将冰菜种子分为2份,1份用0.1%、0.3%、0.5%、0.7% NaCl溶液进行浸种,清水浇灌作对照,3次重复,每个重复50粒。另外1份用清水浸种,种子催芽3 d后,单株播种于育苗盘,待幼苗长至4张真叶时移入直径为200 mm的花盆。缓苗后,用0.1%、0.3%、0.5%、0.7% NaCl溶液浇灌1次,清水浇灌作对照。白天生长温度为26 ℃,夜晚20 ℃,光周期为白天16 h/晚上8 h,每隔10 d取1次样,共取样5次测定相关指标。
1.3 测定指标与方法
1.3.1 种子萌发率测定 种子开始萌发后,每天统计发芽数量,共统计6 d。萌芽率=萌芽株数/播种粒数×100%。
1.3.2 株高和株幅的测定 用直尺测量冰菜的株高(茎基部到最高点的距离)和株幅(植株最宽处的宽度),每隔10 d统计1次,每次结果取3个重复处理的平均值,共统计5次。
1.3.3 叶绿素含量的测定 0.1%、0.3%、0.5%、0.7% NaCl溶液处理4张叶的冰菜植株后,利用SPAD叶绿素仪(SPAD-502,Konica Minolta,日本)每隔10 d测定幼嫩冰菜叶片SPAD的含量,具体方法详见文献[9]。
1.3.4 过氧化物酶(POD)活性的测定 采用过氧化物酶试剂盒测定样品中过氧化物酶的活性。0.1%、0.3%、0.5%、0.7% NaCl溶液处理4张叶的冰菜植株后,每隔10 d分别选取幼嫩叶片进行测定。不同植株鲜样混合后在液氮中研磨,然后将0.1 g混合样进行测定,具体方法详见文献[10]。
1.3.5 超氧化物歧化酶(SOD)活性的测定
1.3.5.1 样品处理 利用0.1%、0.3%、0.5%、0.7% NaCl溶液处理4张叶的冰菜植株后,每隔10 d分别选取幼嫩叶片进行测定。按照組织质量 ∶ 提取液体积为1 g ∶ 10 mL的比例,称取0.3 g混样,加入3 mL提取液,进行冰浴匀浆,4 ℃、8 000 r/min 离心10 min,去上清,置冰上待测。测定步骤如下:首先分光光度计或酶标仪预热30 min以上,调节波长至560 nm,蒸馏水调零。测定前将试剂一、试剂二和试剂四室温放置5 min以上,并按照表1所示进行样品处理。样品处理后,在微量石英比色皿或96孔板中按顺序加入上述试剂,充分混匀,室温静置30 min后,560 nm处测定各管吸光值D。
1.3.5.2 SOD活性的计算 按照下列公式计算抑制百分率:抑制百分率=(D对照管-D测定管)÷D对照管×100%,然后计算SOD活性,SOD活性(U/g鲜质量)=[抑制百分率÷(1-抑制百分率)×V反总]÷(m×V样÷V样总)×样品稀释倍数=11.11×抑制百分率÷(1-抑制百分率)÷m× 样品稀释倍数。式中:V反总表示反应体系总体积,mL;V样表示加入样本体积,mL;V样总表示加入提取液体积,mL;m表示样本质量,g。
1.3.6 可溶性膳食纤维含量的测定 0.1%、0.3%、0.5%、0.7% NaCl溶液处理4张叶的冰菜植株后,每隔10 d分别选取幼嫩叶片进行测定,具体方法详见文献[11]。
1.3.7 黄酮含量的测定 0.1%、0.3%、0.5%、0.7% NaCl溶液处理4张叶的冰菜植株后,每隔10 d分别选取幼嫩叶片进行测定,具体方法详见文献[12]。
1.4 数据处理与分析
试验数据采用SPSS 16.0软件中One-Way ANOVA、Excel 2010分析Duncans法(P<0.05)进行统计分析。
2 结果与分析
2.1 不同浓度NaCl溶液处理对冰菜种子萌芽率的影响
从图1可以看出,不同浓度NaCl溶液处理种子的萌发率在6 d内均随着培养天数的增加而增大,但与对照相比,NaCl溶液处理显著地抑制了种子的萌发,并且随着处理浓度的增大,抑制效果越显著。第6天时,对照种子萌发率已超过70%,而0.7% NaCl溶液处理的种子萌发率不足20%,暗示虽然冰菜植株对盐具有一定的耐性,但种子萌发过程对盐敏感,即使低浓度的盐也会对其萌发产生影响。
2.2 不同浓度NaCl溶液处理对冰菜株高的影响
冰菜株高反映了植株生长发育状态,所以本研究利用不同浓度NaCl溶液处理冰菜植株后,研究株高的变化。由图2可知,不同处理的植株株高在10~50 d内均随着发育时间的延长而增加。在10~30 d内,各个浓度NaCl溶液处理的植株株高增加幅度显著低于对照,并且随着浓度的增加,抑制增高效果越显著。在40~50 d内,0.1%、0.3% NaCl溶液处理的植株株高增加幅度和对照相比不显著,而0.7% NaCl溶液处理的植株株高显著低于其他处理,说明高浓度的NaCl对植株高度生长具有显著的抑制作用。
2.3 不同浓度NaCl溶液处理对冰菜株幅的影响
由图3可以看出,随着调查时间的推移,不同浓度NaCl溶液处理的冰菜植株株幅逐渐增大。在10~20 d内,0.1%、0.3%、0.5% NaCl溶液处理的植株株幅和对照相比差异不显著,0.7% NaCl溶液处理显著低于对照。在植株生长到40 d时,0.5%、0.7% NaCl溶液处理株幅显著大于对照和其他盐处理,0.1%、0.3% NaCl溶液处理和对照相比差异不显著。在50 d时,各种盐浓度处理株幅均高于对照,并且浓度越高,幅度增加越大。
2.4 不同浓度NaCl溶液处理对冰菜叶绿素含量的影响
叶绿素含量在某种程度上能够反映植株光合速率的大小。由图4可以看出,NaCl溶液处理后能够影响植物叶片中叶绿素含量的变化。在10、20 d时,0.1%、0.3% NaCl溶液处理的植株叶绿素含量和对照相比差异不显著,0.5%、0.7% NaCl溶液处理的植株显著低于对照。30 d以后,0.3%、05%、0.7% NaCl溶液处理的植株叶绿素含量显著高于对照,而0.1% NaCl溶液处理与对照相比无明显差异。
2.5 不同浓度NaCl溶液处理对冰菜POD活性的影响
POD活性反映了植株对外界环境胁迫的适应性。由图5可知,不同处理的植株在调查的50 d内,POD活性总体呈先上升后下降的变化趋势,各处理在20 d时达到最大值。在 10 d 时,各处理之间POD活性总体差异不显著,而在20 d时,所有浓度的NaCl溶液处理植株体内POD活性显著高于对照。30 d以后,各个处理之间POD活性总体差异不显著。
2.6 不同浓度NaCl溶液处理对冰菜SOD活性的影响
由图6可知,用不同浓度NaCl溶液处理对冰菜后,除对照外,各处理的SOD活性均呈先上升后下降再上升的趋势。对照在40 d时,POD活性最大,而其他盐处理植株的SOD活性在20 d时达到最大值。10~30 d内,与对照相比,0.1% NaCl溶液处理的植株SOD活性显著高于对照,而 0.3% NaCl溶液处理只有20 d时显著高于对照,10、30 d时与对照相比差异不显著,40 d以后,SOD活性显著低于对照。0.5%、07% NaCl溶液处理冰菜后,除20 d外,SOD活性在调查天数内的其他时间均显著低于对照及 0.1%、0.3% NaCl溶液处理。
2.7 不同浓度NaCl溶液处理对冰菜可溶性膳食纤维含量的影响
由图7可知,在10~30 d内,0.1%、0.3% NaCl溶液处理植株的可溶性膳食纤维含量均显著高于对照和其他盐浓度处理,0.7% NaCl溶液处理的植株总体上低于对照。在40~50 d内,除了0.1% NaCl溶液处理的可溶性膳食纤维含量与对照无明显差异外,其他处理均低于对照,暗示NaCl处理能够影响植株的食用品质。
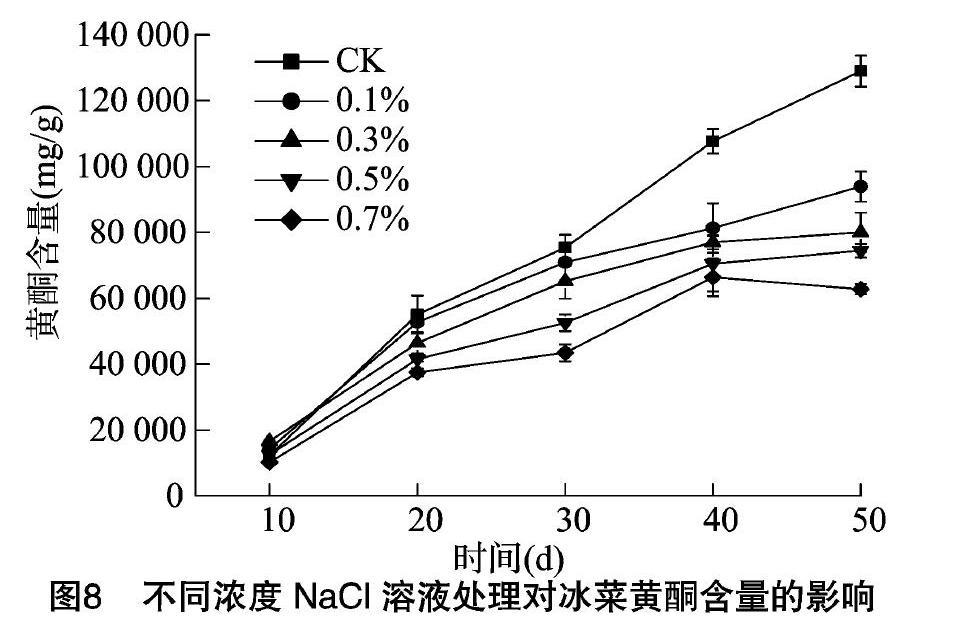
2.8 不同浓度NaCl溶液处理对冰菜黄酮含量的影响
由图8可知,在10~50 d内,所有 NaCl溶液处理后冰菜的黄酮含量均逐渐升高。在10 d时,0.3% NaCl溶液处理后植株黄酮含量显著高于对照,其他盐浓度处理和对照相比差异不显著。20~50 d内,对照的黄酮含量均高于所有浓度NaCl溶液处理的植株,并且NaCl溶液浓度越高,冰菜黄酮含量越低,说明NaCl抑制了冰菜植株体内黄酮的合成。
3 结论
本研究发现,不同浓度NaCl溶液处理后冰菜种子萌芽率均显著低于对照,同时也显著抑制了前期冰菜株高的增加,并随着处理浓度的增大,抑制作用越来越明显。盐浓度对冰菜株幅的影响主要在植株生长后期,且浓度越大,株幅增加越快。对叶绿素含量而言,低浓度的盐(0.1% NaCl溶液处理)对植株叶绿素含量影响不显著,而0.3%、0.5%、0.7% NaCl溶液处理显著提高了植株后期的叶绿素含量。0.3% NaCl溶液处理显著地提高了植株前期(10、20 d)的POD和SOD活性。NaCl对冰菜品质具有一定的影响,0.3% NaCl溶液处理能够显著提高冰菜发育前期的可溶性膳食纤维含量和加速黄酮的合成,但后期黄酮含量降低,NaCl浓度越大,降低趋势越明显。
4 讨论
盐胁迫危害植物生长发育的途径有3种,即渗透胁迫、离子毒害和营养元素亏缺[13]。一般来说,在逆境胁迫下,植物要维持正常的生命活动,其体内会发生一系列适应性反应,其中通过提高体内抗氧化物质含量来消除或减轻由胁迫引发的活性氧伤害为多数植物抵抗逆境的有效方式之一。荣海燕研究发现,盐能够抑制植株的生长,且浓度越高,抑制作用越明显[14],本试验结果与之基本一致。郭坤元等的研究发现,NaCl处理的野葛种苗叶绿素含量均呈现出下降的趋势,处理浓度越高、时间越长,下降的趋势越明显[15]。上述结果与朱秀红等的研究泡桐1201幼苗叶绿素含量随着盐胁迫浓度的增加而减小[16]的结果相似,说明NaCl可能通过抑制叶绿素的合成,进而影响光合作用,最后导致植株生长发育受到阻碍。本试验发现,冰草在0.3%、0.5%、0.7% NaCl溶液处理下,虽然植株高度受到影响,但株幅增加较大,这可能与提高叶片中叶绿素含量有关。POD和SOD是一种广泛存在于植物体内的氧化还原酶,通过清除因胁迫或逆境条件下细胞内产生的活性氧自由基、抑制膜内不饱和脂肪酸的过氧化、维持细胞膜的稳定性和完整性等途径提高植物抗逆性。研究表明,低浓度盐短时间胁迫下能诱导保护酶活性升高,而处理浓度和时间增加则使抗氧化酶活性显著下降[17]。POD与植物生理生化代谢过程密切相关,目前POD可作为植物对盐胁迫适应性反应的重要生理指标[18]。韩晴等在对槐种子发育过程的研究中发现,在花后60~90 d,种子叶细胞过氧化物酶活性从低到高,然后又呈现降低的变化趋势[19],本试验结果与之相似。超氧化物歧化酶能够响应多种胁迫,专一地清除超氧阴离子自由基( O-2 ·
),是一种保护性抗氧化酶[20]。吴月燕等研究发现,低盐浓度处理下,植株体内SOD活性显著升高,植株表现轻微的盐伤害,但随着盐浓度的增加,SOD活性呈现出先上升后下降的趋势,说明低浓度下植株能够通过增加SOD含量提高植株的抗性,但当盐浓度超过一定范围时,SOD活性可能受到影响,进而导致植株死亡[21]。马剑等研究发现,随着NaCl胁迫浓度的升高,文冠果叶片SOD活性先上升后下降[22],本研究结果与之非常相似,进一步说明SOD活性在冰菜盐胁迫适应反应时起到重要作用。膳食纤维与人体健康具有重要关系,也是衡量食物品质的标准之一。解春艳用茶薪菇发酵麦麸制备可溶性膳食纤维进行肠道微生物试验,结果显示膳食纤维不仅能够促进乳酸菌的生长,还能够抑制大肠杆菌的繁殖,有效改善肠道中有益菌群和有害菌群的比例[23]。相对不可溶性膳食纤维而言,可溶性膳食纤维在降低血清胆固醇含量和餐后血糖含量的作用更為明显。石榴中的可溶性膳食纤维在人体肠胃中不会被酶分解,通过吸收肠胃中的水分而发生体积增大,从而扩大了肠道中粪便的体积,可有效预防便秘,同时还可以缓解腹泻等症状[24]。本试验研究发现,前期0.1%、0.3% NaCl溶液处理能够提高冰菜生长前期可溶性膳食纤维含量,说明盐对提高冰菜品质方面具有一定的作用。黄酮是一种强的抗氧化剂,可有效清除体内的氧自由基,具有保护心血管、增强机体免疫力、抗肿瘤等功效。万世杰等研究发现,一定浓度的NaCl胁迫可以提高胀果甘草子叶愈伤组织的甘草黄酮含量[25]。草珊瑚在50、100 mmol/L盐处理下黄酮含量与对照组相比较分别提高了34.7%和 9.3%,总黄酮合成周期明显缩短[26]。而本试验结果发现,0.3% NaCl溶液处理能够在10 d时显著增加植株体内的黄酮含量,而当浓度高于0.3%时,在整个生育期黄酮含量显著下降,说明0.3% NaCl溶液处理能够加速黄酮的合成。综上所述,本研究表明,除了种子萌发外,NaCl浓度在0.1%~03%的范围内,能够增加冰菜的生长速度,提高植株生育前期的品质。
参考文献:
[1]杜 艳,裴 蕾,高志英,等. 盐胁迫对2种基因型波斯菊种子萌发和幼苗生长的影响[J]. 江苏农业科学,2018,46(3):128-131.
[2]王东明,贾 媛,崔继哲. 盐胁迫对植物的影响及植物盐适应性研究进展[J]. 中国农学通报,2009,25(4):124-128.
[3]孙令强,耿广东,王 倩,等. 设施蔬菜土壤次生盐渍化原因及解决途径[J]. 西北园艺(蔬菜),2005(1):4-6.
[4]王鹏山,慈华聪,田晓明,等. 不同钠盐胁迫对狼尾草种子萌发及幼苗生长的影响[J]. 安徽农业科学,2014,42(21):7007-7010.
[5]张建国,张阿凤,王永东,等. 光果甘草种子萌发的最适温度和最佳盐分条件研究[J]. 西北农林科技大学学报(自然科学版),2017,45(2):182-188.
[6]郭艳超,王文成,周汉良,等. 盐胁迫对甜菜叶、根主要生理指标的影响[J]. 中国糖料,2011(3):20-22.
[7]Zhu J K. Plant salt tolerance[J]. Trends in Plant Science,2001,6(2):66-71.
[8]张洪磊,刘孟霞. 冰菜特征特性及控盐高产栽培技术[J]. 陕西农业科学,2015,61(3):122-124.
[9]周丽珠,谷 瑶,曾永明,等. 香茅草叶绿素含量分析[J]. 安徽农业科学,2018,46(10):170-171,178.
[10]蒋润枝,马翠亭,冯先楚,等. 激素和叶面剪除对莲藕实生苗不定根形成及POD活性的影响[J]. 江苏农业科学,2018,46(13):142-146.
[11]任 庆,孙 波,于敬鑫,等. 白菜渣可溶性膳食纤维酸法提取工艺优化及理化性质测定[J]. 食品科学,2015,36(10):70-75.
[12]陈 亮. 芹菜黄酮类物质提取与富集工艺研究[D]. 湖南农业大学,2007.
[13]刘庆鑫,方 慧,李宗耕,等. 自然光植物工厂多层立体栽培补光对生菜产量和品质的影响[J]. 中国农业大学学报,2019,24(1):92-99.
[14]荣海燕. 不同NaCl浓度胁迫对冰菜种子萌发和组培苗生长的影响[J]. 天津农业科学,2016,22(12):42-44.
[15]郭坤元,穆 森,郭汉玖,等. 氯化钠胁迫对野葛种苗生理特性的影响[J]. 时珍国医国药,2019(2):453-455.
[16]朱秀红,王美红,孙喜营,等. ‘泡桐1201幼苗对钠盐胁迫的生理响应[J]. 西北农业学报,2019(4)641-648.
[17]徐 静,董宽虎,高文俊,等. NaCl和Na2SO4胁迫下冰草幼苗的生长及生理响应[J]. 中国草地学报,2011,33(1):36-41.
[18]韩 涛,李丽萍. 果实和蔬菜中的过氧化物酶[J]. 食品与发酵工业,2000,26(1):69-73.
[19]韩 晴,冯建岭,韩 浩,等. 茄子过氧化物酶的特性研究[J]. 山东食品发酵,2014(2):7-12.
[20]Guo Z,Tan J,Zhuo C,et al. Abscisic acid,H2O2 and nitric oxide interactions mediated cold-induced S-adenosylmethionine synthetase in Medicago sativa subsp.falcata that confers cold tolerance through up-regulating polyamine oxidation[J]. Plant Biotechnology Journal,2014,12(5):601-612.
[21]吳月燕,李 波,张燕忠,等. 盐胁迫对杜鹃生理生化与叶绿体亚显微结构的影响[J]. 浙江大学学报(农业与生命科学版),2011,37(6):642-648.
[22]马 剑,刘贤德,张芬琴,等. NaCl胁迫对文冠果生长及生理生化指标的影响[J]. 干旱区资源与环境,2018,32(2):182-187.
[23]解春艳. 茶薪菇发酵制备麦麸膳食纤维与阿魏酰低聚糖及其生物活性研究[D]. 南京:南京农业大学,2010.
[24]张 丽,张建辉,常晓途. 膳食纤维与人类健康的研究进展[J]. 食品安全导刊,2017(33):60.
[25]万世杰,梁玉玲. NaCl胁迫对胀果甘草子叶愈伤组织总黄酮合成的影响[J]. 科技创新导报,2013(4):151-152.
[26]苏 虎,周春丽. 不同逆境胁迫条件对草珊瑚总黄酮含量的影响[J]. 安徽农业科学,2009,37(17):7995-7996.贾代顺,宁德鲁,陈 福,等. 间种模式对核桃林地土壤性质及树体生长量的影响[J]. 江苏农业科学,2019,47(15):188-191.

