血清胃泌素-17、癌胚抗原及胃蛋白酶原对胃癌的诊断价值分析
王德友,张升波,赵善峰
济南市人民医院胃肠外科,济南271100
研究发现,胃癌的发病率可超过697/10万人,在具有基础性高危因素或胃癌家族史的人群中,胃癌的发病率可进一步升高[1-2]。临床上胃癌的早期诊断具有重要意义,血清学指标检测可为胃癌的早期诊断提供一定的参考依据。胃泌素-17(gastrin-17,G-17)能够通过促进胃液的分泌,促进胃黏膜腺体上皮细胞的持续性增殖和分化,进而参与早期胃黏膜的病变过程[3]。癌胚抗原(carcinoembryonic antigen,CEA)是非特异性肿瘤相关糖蛋白,可在肿瘤细胞异常分裂的过程中高表达,可用于评估恶性肿瘤的发生风险。胃蛋白酶原(pepsinogen,PG)可反映局部胃酸分泌状态及胃底部或胃幽门等部位分泌胃酸的功能,有研究表明,肿瘤的发生可影响PG的活性[4]。本研究分析胃癌患者的血清G-17、CEA及PG表达水平,探讨3项指标单独及联合检测对胃癌的诊断价值,现报道如下。
1 对象与方法
1.1 研究对象
选择2015年2月至2018年1月济南市人民医院收治的80例胃癌患者作为胃癌组。纳入标准:①胃癌的诊断参考《中国早期胃癌筛查及内镜诊治共识意见》[5]中的相关标准;②经病理学检查确诊为胃癌;③未接受过放化疗或免疫治疗。排除标准:①转移性胃癌患者;②合并脑血管疾病的患者;③合并重大创伤的患者;④长期使用糖皮质激素或免疫抑制剂等药物的患者;⑤合并其他系统重大疾病的患者。选择同期于济南市人民医院经胃镜检查确诊为胃炎的80例患者为对照组,胃炎的诊断参考《中国慢性胃炎共识意见》[6]中的相关标准。胃癌组中,男44例,女36例;年龄43~75岁,平均年龄为(58.0±9.2)岁;TNM分期:Ⅰ期14例,Ⅱ期30例,Ⅲ期28例,Ⅳ期8例;分化程度:高分化22例,中分化34例,低分化24例。对照组中,男49例,女31例;年龄40~75岁,平均年龄为(60.2±10.4)岁;萎缩性胃炎48例,非萎缩性胃炎32例。两组患者的年龄、性别比较,差异均无统计学意义(P>0.05),具有可比性。本研究经医院医学伦理委员会审批通过,所有患者均对本研究知情并签署知情同意书。
1.2 检测方法
采集两组研究对象的肘部静脉血5 ml,取上清液进行检测。采用电化学发光法检测血清CEA水平,UniCel DxI 800电化学发光仪购自美国贝克曼库尔特公司,试剂盒购自北京九强生物技术股份有限公司。采用酶联免疫吸附试验检测血清G-17和PG水平,方法如下:采用十字交叉法测定抗原浓度,采用碳酸盐缓冲液稀释抗原,加入96孔酶标板中,盖上酶标板盖后置于4℃冰箱过夜,蒸馏水冲洗3次,每次5 min,轻轻叩击酶标板甩干。每孔中加入5%的脱脂牛奶200 μl,置于4℃冰箱过夜,蒸馏水冲洗3次,每次5 min,加入稀释过的抗体(1∶800),蒸馏水冲洗3次,每次5 min,每孔中加入100 μl底物,显色后在酶标仪上检测吸光度。
1.3 评价标准
依据试剂盒上的标准,血清G-17的正常值<7.0 pmol/L,血清CEA的正常值<5.0 ng/ml,血清PGⅠ的正常值范围为50.0~130.0 g/L,血清PGⅡ的正常值范围为0.0~1.0 g/L,高于正常值范围则判定为阳性。血清G-17、CEA及PGⅡ三项指标联合检测时,三者均为阴性即判断为阴性,任何一项阳性即判断为阳性。以病理诊断结果为金标准,分析血清G-17、CEA、PGⅡ单独及联合检测对胃癌的诊断价值。灵敏度=真阳性例数(/真阳性+假阴性)例数×100%,特异度=真阴性例数(/真阴性+假阳性)例数×100%,准确度=(真阳性+真阴性)例数/总例数×100%,约登指数=灵敏度+特异度-1。
1.4 统计学方法
采用SPSS 21.0软件对数据进行统计分析,符合正态分布的计量资料以均数±标准差(±s)表示,组间比较采用t检验;计数资料以例数和率(%)表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 血清学指标的比较
胃癌组患者的血清G-17、CEA及PGⅡ水平均明显高于对照组,差异均有统计学意义(P<0.01);两组患者的血清PGⅠ水平比较,差异无统计学意义(P>0.05)。(表1)
表1 两组患者血清学指标的比较(±s)
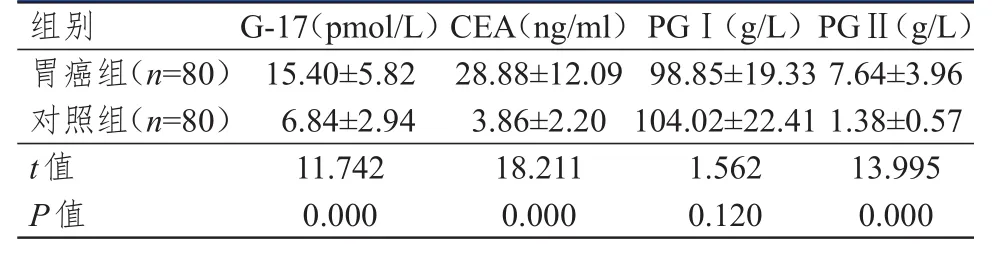
表1 两组患者血清学指标的比较(±s)
组别G-17(pmol/L)CEA(ng/ml)PGⅠ(g/L)PGⅡ(g/L)胃癌组(n=80)对照组(n=80)t值P值15.40±5.82 6.84±2.94 11.742 0.000 28.88±12.09 3.86±2.20 18.211 0.000 98.85±19.33 104.02±22.41 1.562 0.120 7.64±3.96 1.38±0.57 13.995 0.000
2.2 血清G-17、CEA、PGⅡ单独及联合检测对胃癌的诊断价值
以病理诊断结果为金标准,血清G-17单独诊断胃癌的灵敏度、特异度、准确度、约登指数分别为 57.50%(46/80)、65.00%(52/80)、61.25%(98/160)、0.225;血清CEA单独诊断胃癌的灵敏度、特异度、准确度、约登指数分别为46.25%(37/80)、56.25%(45/80)、51.25%(82/160)、0.025;血清PGⅡ单独诊断胃癌的灵敏度、特异度、准确度、约登指数分别 55.00%(44/80)、68.75%(55/80)、61.88%(99/160)、0.238;血清G-17+PGⅡ+CEA联合诊断胃癌的灵敏度、特异度、准确度、约登指数分别为88.75%(71/80)、80.00%(64/80)、84.38%(135/160)、0.688。其中,联合诊断的灵敏度、特异度、准确度、约登指数最高。(表2、表3)
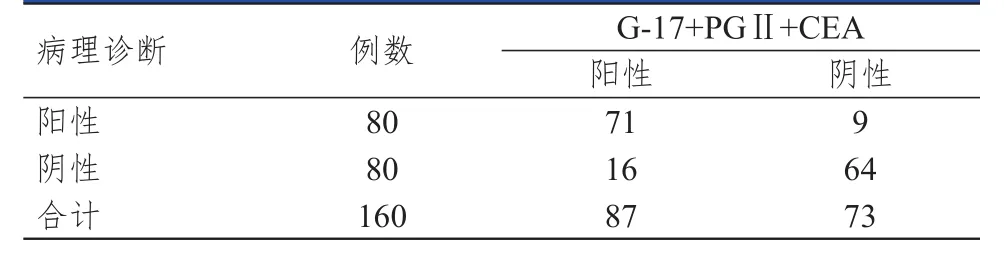
表3 血清G-17+CEA+PGⅡ联合诊断胃癌与病理诊断结果的对照
3 讨论
胃黏膜腺体上皮细胞的异常分裂或分化均能促进胃癌的发生,在合并慢性萎缩性胃炎或幽门螺杆菌感染的患者中,胃癌的发病率和病死率可进一步升高[6]。临床研究发现,胃癌患者发生多器官功能衰竭的风险可超过15%,其总体生存时间不超过38个月[7-8]。现阶段主要采用胃镜下活检提高胃癌的诊断水平,胃镜下活检虽然是诊断胃癌的金标准,但胃镜检查的费用较高,且属于有创检查,患者的接受程度较低。血清糖类抗原19-9(carbohydrate antigen 19-9,CA19-9)虽然在胃癌的发生过程中具有一定的作用,但有研究认为,单纯依靠血清CA19-9诊断胃癌的灵敏度不足35%,其与病理诊断结果的符合率不足40%[9]。本研究分析胃癌患者的血清G-17、CEA及PG水平,探讨三项指标单独及联合检测对胃癌的诊断价值,旨在为临床中胃癌的诊断提供新的参考。
G-17是一种胃泌素刺激因子,可通过诱导胃泌素的分泌,提高胃黏膜腺体上皮细胞核DNA的分裂速度。G-17还能够提高胃黏膜上皮细胞间质成分的异常分化风险,导致异常分裂象的出现,最终促进胃癌的发生[10]。在肿瘤细胞线粒体异常分裂的过程中,部分凋亡的肿瘤细胞可促进CEA的合成和释放。在胃癌细胞纺锤体的形成过程中,胃癌细胞周期调控紊乱可促进CEA的异常释放。有研究者探讨了CEA表达与胃癌的关系,结果发现,胃癌患者中CEA的表达水平明显升高[11]。PG是胃蛋白酶家族成员,PGⅠ为胃底部分泌的胃蛋白酶,PGⅡ为胃幽门部分泌的胃蛋白酶,均能够反映胃黏膜分泌胃酸的功能[12]。
本研究发现,胃癌组患者的血清G-17、CEA及PGⅡ水平均明显高于对照组(P<0.01),提示血清G-17、CEA及PGⅡ水平升高均可能影响胃癌的发生发展过程。分析具体原因如下[13-14]:①G-17水平升高能够持续性促进胃黏膜上皮细胞的异常分裂,导致胃癌细胞内促分裂原活化的蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路激活,促进腺体细胞的持续性增殖;②CEA的水平可反映胃癌腺体上皮细胞的增殖状态及胃癌细胞的增殖活性;③PGⅡ水平可反映胃幽门部分黏膜上皮组织分泌胃酸的功能。刘刚等[15]研究发现,胃癌患者血清G-17的阳性表达率可平均上升30%以上,在具有明显腹腔内转移或肌层浸润的胃癌患者中,G-17蛋白的表达水平可进一步升高。本研究结果还显示,G-17、CEA及PGⅡ单独检测对胃癌具有一定的诊断价值,但其灵敏度和特异度均较低,临床漏诊和误诊的风险较高;而G-17+CEA+PGⅡ联合检测可提高胃癌诊断的灵敏度和特异度,其灵敏度和特异度分别为88.75%和80.00%。临床中对于胃癌高危人群,可通过检测血清G-17、CEA及PGⅡ水平评估其发病风险。
综上所述,胃癌患者的血清G-17、CEA及PGⅡ水平均较高,血清G-17、CEA及PGⅡ联合检测对胃癌具有一定的诊断价值,值得在临床推广。

