基于高通量测序的鱼菜共生池塘与普通池塘微生物群落结构比较
杨天燕 孟 玮 高 攀 胡建勇 林红喜 高天翔
(1. 浙江海洋大学水产学院, 舟山 316022; 2. 新疆维吾尔自治区水产科学研究所, 乌鲁木齐 830000;3. 乌鲁木齐市百汇鱼生渔业科技有限公司, 乌鲁木齐 830026)
鱼菜共生(Aquaponics)最早可追溯到1500年前东南亚地区的稻田养鱼, 是一项涉及鱼类、微生物和植物三者共营共生的新型复合耕作技术, 通过系统内部可持续性的物质循环和能量流动, 将水产养殖(Aquaculture)和水耕栽培(Hydroponics)两种农耕技术有机结合, 达到鱼-菜-菌的和谐互利共生, 从而实现“养鱼不换水、种菜不施肥”的高效、清洁、健康的生态循环养殖模式[1]。近年来, 在食品安全问题备受关注的背景下, 鱼菜共生健康养殖模式由于其独特的生态、环保和安全优势, 目前已在国内外得到广泛推广和应用[2]。相较传统的线性池塘养殖模式而言, 在鱼菜共生系统中, 鱼类排泄物可作为植物营养, 而植物代谢作用既可改善水质、残根又可供鱼类食用, 微生物作为中间者能够有效调节鱼类和植物间的微生态平衡。新疆作为我国西北典型干旱缺水地区, 为了实现池塘养殖节水和资源循环利用, 近年来部分地区陆续开展了鱼菜共生体系的试验示范。目前关于鱼菜共生的研究多集中在养殖模式的设计和优化[3—6], 而对于环境微生物对水质调节机理方面的研究较少。
细菌作为养殖池塘生态系统的重要组成部分,其群落结构与多样性组成在水质调节、疾病控制及维持生态系统稳定等方面发挥着重要作用, 很大程度影响着水产动物的健康与生存。基因组(Metagenome), 又称微生物环境基因组(Microbial Environmental genome)或元基因组, 由美国威斯康辛大学麦迪逊分校 Handelsman等[7]在前人研究的基础上于1998年首次提出, 指一定环境中整个微生物群落所有遗传物质的总和。宏基因组学(Metagenomics)是主要依靠生物信息学手段, 分析和比较微生物群落结构、功能及其进化关系的新型技术方法,目前对宏基因组测序主要包括16S rRNA和全基因组测序两种方法[8], 其中16S rRNA作为揭示生物物种的特征核酸序列, 具有大小适中且突变率小的特点, 被认为是最适合细菌系统发育和分类鉴定的指标[9,10]。近年来随着分子生物学的发展, 尤其是高通量测序技术的研发及应用, 为微生物分子生态学的研究策略注入了新的力量, 并逐渐成为研究微生物群落多样性的首选实验手段[11—13]。
本文以新疆水生野生动物救护中心和乌鲁木齐市米东区长山子镇水源地养殖基地鱼菜共生池塘为研究对象, 基于宏基因组学的方法, 采用Illumina HiSeq高通量测序技术, 从环境微生物角度探讨鱼菜共生系统中环境微生物和根系微生物群落组成差异及多样性水平, 以期为科学地解释鱼菜共生养殖模式水质调节机理, 以及池塘养殖水体生物调控技术的推广与应用提供参考资料。
1 材料与方法
1.1 实验地点概况
实验地点位于新疆水生野生动物救护中心和乌鲁木齐市米东区长山子镇水源地养殖基地两处环境条件类似的标准化养殖池塘。池塘面积0.43 hm2,平均水深1.80 m, 具有独立的进排水系统, 水源为地下深井水, 水质符合GB11607渔业水质标准, 2017年5月18日放养品种为80—100 g/尾的大规格罗非鱼鱼种, 放养量为15000尾/hm2。
1.2 浮床制作及蔬菜移植
池塘水面架设直径为75 mm的PVC排水管制作的浮床, 浮床规格为360 cm×120 cm。聚乙烯网片分上下两层包裹浮床, 其中上层为疏网, 网眼直径3 cm; 下层为密网, 网眼直径0.8 cm。网片用塑料扎带绷紧, 上下网片形成2—3 cm的间距。2017年6月中旬, 剪取长度为15 cm提前在菜地育成的空心菜茎秆, 使用扦插法将其按10 cm株距插入浮床网片中。空心菜茎杆露出下层网片约3—4 cm。将移植好空心菜的浮床用绳子串联, 分8行排布于池塘下风处, 每行12个, 共计96个。浮床面积共计415 m2,覆盖率约为池塘养殖面积的10.4%。经过一定时间的生长, 待空心菜长至30 cm时开始采摘, 15d左右采摘1次。乌鲁木齐市米东区长山子镇水源地养殖基地鱼菜共生池塘在整个养殖期空心菜共收获5茬,总产量6250 kg, 单产15.1 kg/m2, 而新疆水生野生动物救护中心鱼菜共生池塘空心菜生长状况较差, 未能形成采摘规模(图 1)。
1.3 样品采集及DNA提取

图 1 空心菜长势情况Fig. 1 The growth of water spinach in different ponds

表 1 样品信息Tab. 1 Sampling information
除两处鱼菜共生池塘外, 另各自选取1口未架设生物浮床的普通池塘作空白对照, 2017年9月10日分别采集水样进行实验, 采集信息详见表 1。每口池塘随机选取8个取样点, 采集距离水面约15 cm深处的10 mL等体积水样, 均匀混合后装入灭菌塑料螺口离心管。将随机剪取的空心菜根系悬浮于PBS缓冲液(0.15 mol/L NaCl, 0.1 mol/L Na2EDTA,pH 8.0)中, 充分摇匀后使用孔径0.22 μm (Millipore)无菌滤膜对水样进行过滤, 并将滤膜剪碎置于无菌冷冻管中。上述所有样品均置于-20℃保存。采用CTAB法[14]对水样基因组DNA进行提取, 紫外分光光度法检测DNA纯度和浓度, 并取适量的DNA样品于离心管中, 使用无菌水稀释至1 ng/μL备用。
1.4 PCR扩增及产物回收
以稀释后的基因组DNA为模板, 针对细菌16S rRNA的V3—V4双可变区域, 使用带Barcode的特异引物338F/806R进行扩增, 引物序列为338F(5′-ACTCCTACGGGAGGCAGCA-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)。使用New England Biolabs公司的Phusion®High-Fidelity PCR Master Mixwith GC Buffer和高保真聚合酶进行PCR。50 μL PCR反应体系为: 2×Phusion GC buffer 25 μL, 正反向引物各2.5 μL(10 μmol/L), 模板DNA 15 ng, 加去离子水至终体积至50 μL。PCR反应条件为: 95℃预变性3min; 95℃变性30s, 55℃退火30s, 72℃延伸45s, 30个循环; 最后72℃延伸10min。使用浓度为2%的琼脂糖凝胶对PCR产物进行电泳检测, 使用QIAgen公司的QIAquick Gel Extraction Kit试剂盒对目的条带进行回收, 并送至陕西博瑞德生物科技有限公司测定。
1.5 文库构建及高通量测序
使用 TruSeq®DNA PCR-Free Sample Preparation Kit建库试剂盒进行文库构建, 构建好的文库经过Qubit和Q-PCR定量, 合格后使用Illumina Hiseq 2500 PE250测序平台进行高通量测序。
1.6 测序数据分析
在截去Barcode和引物序列后, 使用FLASH1.2.11软件[15]对每个样品的reads进行拼接, Qiime1.7.0软件[16]对拼接后的数据(Raw Tags)进行过滤处理得到高质量的Tags数据(CleanTags)。使用UCHIME 4.1基于Gold database数据库比对后去除嵌合体序列[17]。Uparse7.0.1001软件[18]对最终有效数据(Effective Tags)进行聚类, 将相似性大于97%的序列定义为OTUs (Operational Taxonomic Units)。筛选OTUs中出现频数最高的序列作为代表, 采用 Mothur方法与SILVA[19]的SSUrRNA数据库[20]进行物种注释分析(设定阈值为0.8—1.0)。
采用MUSCLE3.8.31软件[21]对OTUs进行序列比对, Qiime1.7.0软件计算Unifrac距离并构建UPGMA聚类树, 并同时计算Chao1指数、Shannon指数、Simpson指数和PD_whole_tree等多样性参数。基于R语言软件绘制样品稀释曲线, 并进行Alpha多样性指数的组间差异分析和无度量多维标定法(Non-Metric Multi-Dimensional Scaling, NMDS)统计。
2 结果
2.1 样品测序质量及复杂度分析
6个样品得到的原始序列为56444条, 用于构建OTU分类信息单元且获得注释信息的平均tags数(Taxon Tags)为53421条, 有效数据量达到94.64%。在相似度大于97%的水平上检测到OTU平均数为945 (图 2)。
稀释曲线(Rarefaction Curve)是常见的用于描述组内样品多样性的曲线, 可直接反映测序数据量的合理性, 并间接反映样品中物种的丰富程度。对样品随机抽样, 以抽取的测序数据量与对应的物种数构建稀释曲线如图 3所示, 当随机抽取的测序数量大于30000条时, 曲线趋向平坦, 表明测序数据量渐进合理, 更多的数据量对发现新的OTU边际贡献率较小。而当测序数量相同时, 细菌群落OTU数量表现为JH.KX>JH.C>MD.C>JH.R>MD.R>MD.KX,表明JH.KX微生物丰度明显高于其他样品。Rank Abundance曲线(图 4)直观的反映了样品中物种的丰富度和均匀度。在水平方向上曲线跨度较大, 表明物种的丰富度较高; 而在垂直方向上曲线平滑程度较小, 表明测定样品中物种的均匀程度相对较低。
2.2 细菌微生物群落组成
根据物种注释结果, 选取每个样品在各分类水平上最大丰度排名前10的物种, 绘制物种相对丰度柱状图, 以门(Phylum)的水平为例绘制物种相对丰度柱状图如图 5所示, 分别为柔膜菌门(Tenericutes)、螺旋体菌门(Saccharibacteria)、梭杆菌门(Fusobacteria)、绿菌门(Chlorobi)、蓝菌门(Cyanobacteria)、疣微菌门(Verrucomicrobia)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)和未分类菌群(Others)。从门分类水平上细菌相对丰度变化趋势来看, 除MD.R (23.86%)以外, 其余样品中检测到的优势菌群主要为变形菌门(Proteobacteria), 所占比例均在49%以上, 其中JH.R高达85.84%。柔膜菌门(Tenericutes)在JH.C、MD.R和MD.KX中均未检测到。实验组水环境微生物群落(JH.KX和MD.KX)中拟杆菌门(Bacteroidetes)、蓝菌门(Cyanobacteria)和梭杆菌门(Fusobacteria)相对丰度均高于各自对照组(JH.C和MD.C), 而疣微菌门(Verrucomicrobia)的相对丰度均明显低于其对照组; 在实验组空心菜根系微生物群落(JH.R和MD.R)中, JH.R微生物群落中变形菌门(Proteobacteria)相对丰度显著偏高, 而MD.R拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes)占绝对优势, 比例分别为29.60%和35.79%。
从空心菜长势情况来看, 乌鲁木齐市米东区长山子镇水源地养殖基地鱼菜共生池塘空心菜长势较好, 无论其根系水样(MD.R)还是池塘水样(MD.KX)中, 厚壁菌门(Firmicutes)和放线菌门(Actinobacteria)细菌占比均高于新疆水生野生动物救护中心鱼菜共生池塘。在两处无空心菜生长的池塘中, 拟杆菌门(Bacteroidetes)细菌占比均低于种植空心菜池塘、疣微菌门(Verrucomicrobia)细菌占比均高于种植空心菜池塘。
对每个分组的物种分类结果, 筛选特别关注的物种(默认选择最大相对丰度前10的属)进行物种分类树统计(图 6)[22]。图中扇形面积的大小代表分组在该分类上相对丰度的比例, 下方数字表示所有分组在该分类上的平均相对丰度百分率, 前者表示占所有物种的百分率, 后者表示占所选取物种的百分率。从目的水平上来看, MD.R样品中占优势地位的为拟杆菌门(Bacteroidetes)、拟杆菌纲(Bacteroidia)的拟杆菌目(Bacteroidales)和厚壁菌门(Firmicutes)、梭菌纲(Clostridia)的梭菌目(Clostridiales);JH.R样本中大量检测到变形菌门(Proteobacteria)、变形菌纲(Alphaproteobacteria)的根瘤菌目(Rhizobiales)和鞘脂单胞菌目(Sphingomonadales)以及γ-变形菌纲(Gammaproteobacteria)的气单胞菌目(Aeromonadales)和假单胞菌目(Pseudomonadales)的类群, MD.KX的优势菌群来自于蓝菌门(Cyanobacteria/Chloroplast); 红螺菌目(Rhodospirillales)和海洋螺菌目(Oceanospirillales)细菌在JH.C中占优势。
根据OTU聚类分析结果和研究需求, 当样品数大于5时, 对所有样品进行均一化处理, 分析不同样品之间共有和特有的OTU并绘制花瓣图(图 7)。从图中可以直观的看出不同样品OTU数目组成相似性及重叠情况, 6个样品共有的OTU数目为165, 不同样品中特有OTU表现为JH.KX最高(137), JH.R最低(30), 而MD.R和JH.C数量相同, 均为85。
2.3 样品复杂度分析

图 2 各样品的OTUs聚类和注释情况统计Fig. 2 OTUs clustering and annotation statistics of each sample

图 3 样品的稀释曲线图Fig. 3 Rarefaction curve of water samples
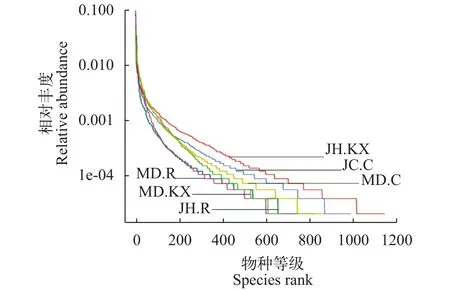
图 4 样品的Rank Abundance曲线图Fig. 4 Rank Abundance curve of water samples
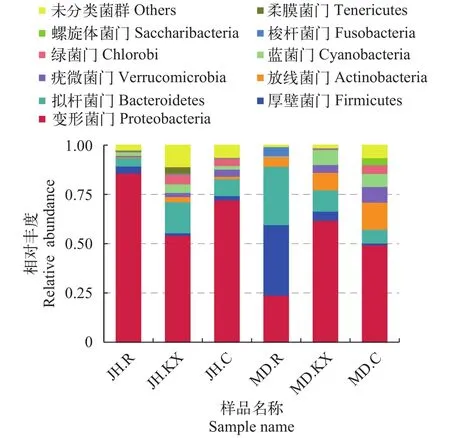
图 5 门水平上的物种相对丰度柱状图Fig. 5 Relative abundance histogram of species on Phylum level
Alpha多样性分析 Alpha多样性主要关注局域生境或样品内(Within-community)的微生物群落多样性[23], 通过单样本的多样性分析可以反映样品内的微生物群的丰富度和多样性, 进而评估各样品中微生物群落的物种丰富度和多样性的差异。序列相似度大于97%的情况下可聚类成一个OTU,通常被认为是源自同一个种(Species boundary)。利用Mothur软件对不同样品在97%相似度阈值下的多样性进行分析, 为排除因样本测序数量不同而造成的误差, 以序列最少的样品序列数为基准, 分别进行10次抽样重复, 所得的Alpha多样性指数取平均值如表 2所示。分析表明, 所有取样点的多样性测序结果Coverage均高于99%, 表明测序结果覆盖度好且具有较高可信度, 能够代表样本的真实情况。Shannon指数和Simpson指数是反映物种丰富度和均匀度的2个重要参数, 其值越大表明个体分配越均匀、群落多样性越高, 从表 2可以看出, 6个水样菌落的Shannon多样性指数和Simpson多样性指数排序分别为JH.KX>MD.C>JH.C>MD.KX>MD.R>JH.R和JH.KX>MD.C>MD.KX>JH.C>JH.R>MD.R, 结果表明空心菜根系水样(MD.R和JH.R)中细菌微生物群落多样性相对较低。Chao1指数和ACE指数是生态学中用于估算样本物种丰度的常用指数, 本研究中二者的变化趋势大体一致, 均表现为JH.KX值最大、MD.KX最低, 表明前者中含有的OTU数目最多, 即细菌种类数量最多、群落的丰度也最高, 而后者丰度最低。
无度量多维标定法分析 无度量多维标定法(Non-Metric Multi-Dimensional Scaling, NMDS)统计是一种将多维空间样本简化到低维空间进行数据分析的方法, 能够很好地反映生态学数据的非线性结构[24,25]。NMDS统计结果以点的形式反映在多维空间上, 各样点间的距离体现了彼此差异程度, 距离越近代表相似度越高。基于OTU水平的NMDS排序结果见图 8, 从图中可以看出在排序的胁强系数(Stress, S)小于0.001的情况下, JH.KX与JH.C差异最小, JH.R和MD.R位于第一象限, MD.KX和MD.C分别位于第二和第四象限。
2.4 聚类分析
为了进一步得到不同样品间群落结构差异, 对OTU进行多序列比对并基于Weighted Unifrac距离矩阵构建非加权组平均聚类树(Unweighted Pairgroup Method with Arithmetic Mean, UPGMA), 并将聚类结果(左侧)与各样品在门水平上的物种相对丰度分布(右侧)整合展示, 结果如图 9所示, JH.KX与JH.C相似度最高, 与NMDS分析结果类似。MD.R与其他样品间距离最远, 相似度最低。
3 讨论
3.1 细菌群落结构分析
从各组细菌物种分类树可以看出, JH样本中占绝对优势的细菌主要来自变形菌门(Proteobacteria),其中来自于空心菜根系样本JH.R的根瘤菌目(Rhizobiales)、鞘脂单胞菌目(Sphingomonadales)、假单胞菌目(Pseudomonadales)、气单胞菌目(Aero-monadales)和交替单胞菌目(Alteromonadales)占优势。促生菌是一类具有固氮、溶磷、解钾、解硫、硝化、反硝化等作用, 参与无机盐循环或能产生植物激素直接或间接促进植物生长的菌[26]。氮循环是鱼菜共生系统的核心过程, 长期以来科研界普遍认为微生物对植物生长的促进作用主要体现在固氮作用和磷转化[27]。其中与固氮作用密切相关的根瘤菌是一类与豆科植物根系共生, 形成根瘤并固定空气中的氮气供植物营养的革兰氏阴性细菌, 在农业生产和固氮生态体系中起着极其重要的作用[28]。按照Jordan在1984年出版的《伯杰氏系统细菌学手册》中分类标准, 将根瘤菌目划分为四个科, 分别为: 慢生根瘤菌科(Bradyrhizobiaceae)、生丝微菌科(Hyphomicrobiaceae)、叶杆菌科(Phyllobacteriaceae)和根瘤菌科(Rhizobiaceae)[29]。有研究发现, 根瘤菌可侵入非豆科植物根内, 对促进植物生长有益, 尤其是对某些水生植物, 如水稻的生长和增产大有帮助[30]。王旭明[31]通过研究证实, 空心菜对污水中氮、磷的去除率分别可达87.36%和76.4%, 石焱等[32]通过大规模养殖试验表明人工浮床水培水雍菜对池塘养殖废水中氨氮、总氮和总磷有良好的去除效果。在本实验中空心菜根系样本中检测到根瘤菌的存在, 推测其改变了根系对无机营养盐和矿物质吸收的生理活动, 从而促进空心菜的生长。此外, 鞘脂单胞菌目(Sphingomonadales)中包含的新鞘氨醇杆菌属(Novosphingobium)可以降解芳香族化合物, 如苯酚、苯胺、硝基苯和菲[33], 这些细菌有利于改善水质、降低有机物污染,促进水生植物生长, 降低水中鱼类受这些化合物的污染, 从而改善水产品质。然而, JH.R中假单胞菌目(Pseudomonadales)所包含的鱼类致病菌Pseudomonas anguilliseptica数量明显高于MD.R, 可能干扰了鱼类的正常代谢[34], 其负面影响高于益生菌的作用, 影响了空心菜的生长, 这可能是新疆水生野生动物救护中心鱼菜共生池塘空心菜生长较差一个重要原因。另外, 从池塘水质理化数据来看, pH(9.26)高于米东区长山子镇水源地养殖基地鱼菜共生池塘(8.05), 这对于喜中偏酸性环境的空心菜而言, 不利于其生长。而氨氮、钙、镁含量(0.525、25.2和7.462 mg/L)明显低于后者(0.834、125.94和46.056 mg/L), 这些营养物质的缺乏也使得空心菜长势较差。

图 6 各分组中特定物种分类树Fig. 6 Species taxa tree in each group
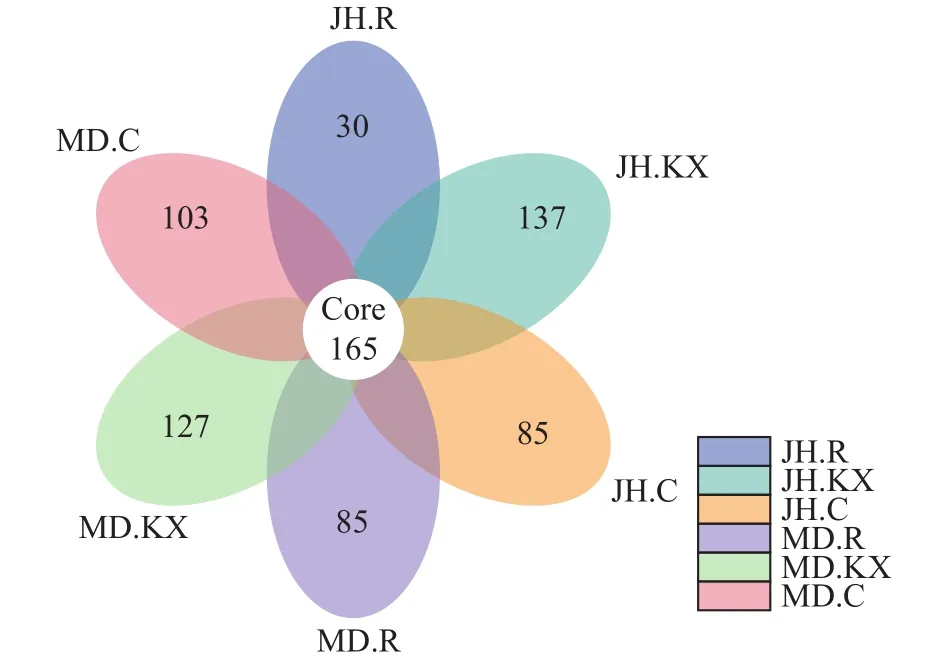
图 7 基于OTUs绘制的花瓣图Fig. 7 Petal graph based on OTUs
3.2 水质条件和细菌多样性的关系
米东区长山子镇水源地养殖基地池塘样本中独有且占优势的类群为拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)和蓝菌门(Cyanobacteria), 其中前两者在根系中占优势。拟杆菌门(Bacteroidetes)涵盖了三大类革兰氏阴性菌, 即非孢子形成菌、厌(需)氧菌和杆状细菌, 它们广泛分布在土壤、沉积物和海水环境中, 以及动物的内脏和皮肤中。厚壁菌门(Firmicutes)下的Proteocatella属, 包含一些厌氧耐寒的细菌[35], 这些细菌在冬季温度较低时仍能够改变池塘水质。蓝菌门(Cyanobacteria)的蓝藻类是产生水华的主要原因, 也是水体富营养化的征兆[36,37], 推测这可能是米东区长山子镇水源地养殖基地池塘中空心菜生长较好的原因之一, 此外, 空心菜的生长有利于净化水质, 消除富营养化,利于水中鱼类的生存。JH.R和MD.R二者共有的细菌类群为气单胞菌目 (Aeromonadales)和交替单胞菌目(Alteromonadales), 气单胞菌目下的气单孢菌属(Aeromonas)普遍存在于淡水和半咸水中[38]。交替单胞菌目下的希瓦氏菌属(Shewanella), 大部分发现于温度较低的水体中[39], 这与西北地区水体温度较低的状况相一致。希瓦氏菌属(Shewanella)常用于环境的生物修复, 能够降低水中有毒物质和重金属的毒性, 从而提高生物浮床系统对污染物的去除效率。
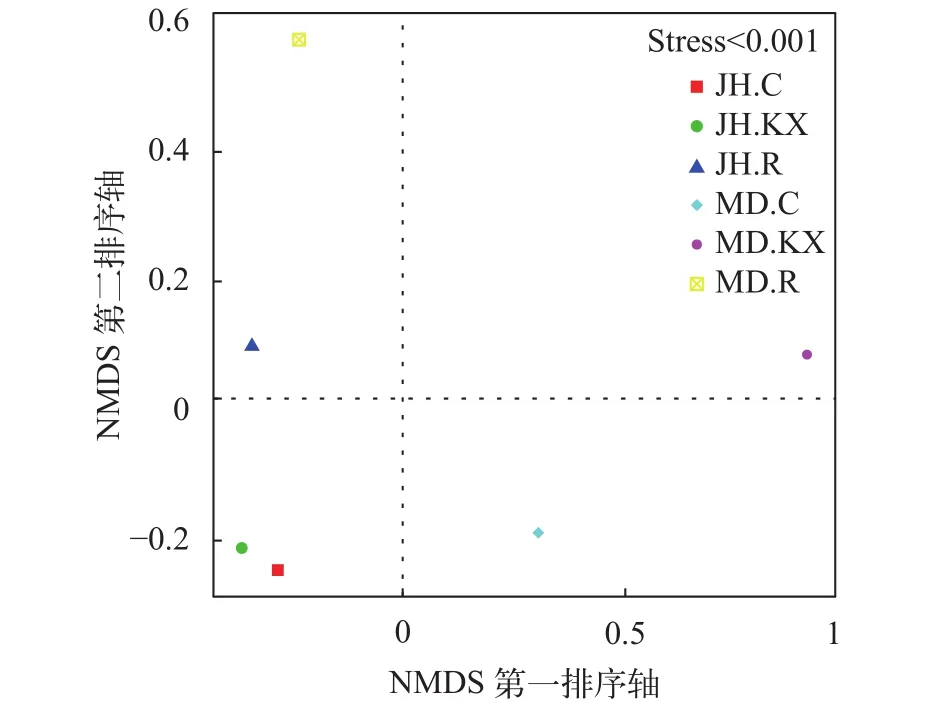
图 8 不同样本的NMDS排序图Fig. 8 NMDS ordination diagram of samples
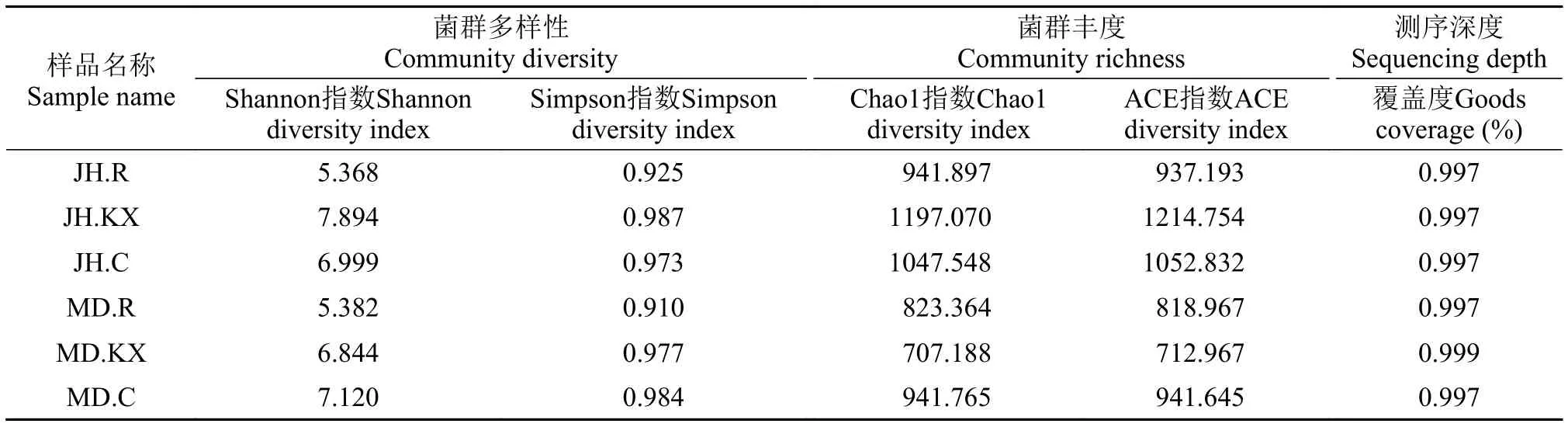
表 2 微生物群落多样性指数Tab. 2 Diversity indices of different microbial communities
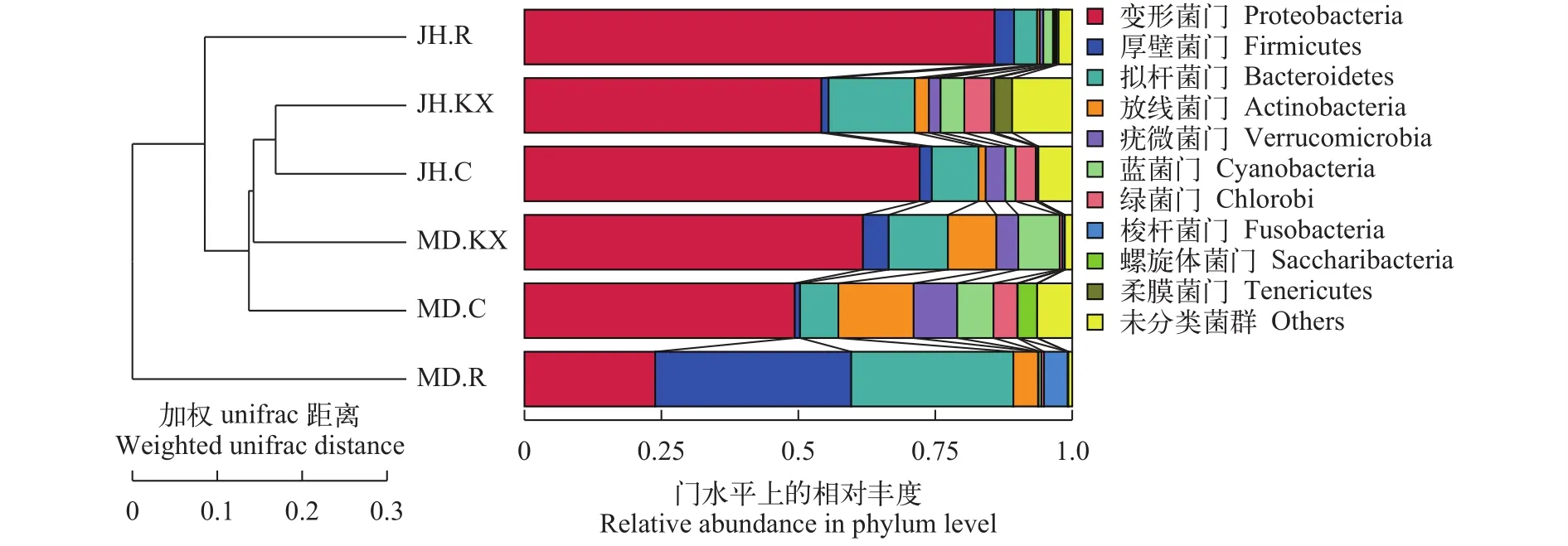
图 9 基于Weighted Unifrac距离构建的UPGMA聚类树Fig. 9 The UPGMA phylogenetic tree constructed based on Weighted Unifrac distance
3.3 细菌组成对水培蔬菜生长的影响
门水平上的物种丰度图显示MD.R样本中来自于变形菌门(Proteobacteria)、蓝菌门(Cyanobacteria)和厚壁菌门(Firmicutes)的细菌占优势, 且分布均匀, 占比相差不大。与其他组比较, 前者明显偏低, 而后两者明显偏高。有研究证实, 种植基质中微生物组成多样性越高、群落结构越复杂, 越能促进植物的生长, 单一细菌与真菌菌群对植物生长甚至产生抑制作用[40]。从本实验的结论以及现场抽样检测来看, 来自于米东区长山子镇水源地养殖基地鱼菜共生池塘的空心菜长势较好, 与其根系细菌分布均匀度呈正相关。这表明植株根际附近微生物生理活动更为活跃, 各种代谢功能也更为频繁。
从花瓣图中特有OTU可以看出, 种植空心菜的水样中的OTU数量最多, 明显高于未种植空心菜水样。水培蔬菜不仅增加水体的溶解氧含量, 根系还为微生物的生长和繁殖提供了场所, 其分泌物能促进某些固氮细菌、嗜磷细菌的生长, 降低水体中含氮化合物的浓度、改善养殖环境中的微生态平衡[41],与此同时, 植物根际微生物数量的增加, 在其周围构建起一个物理屏障保护了植物根系, 从而减少病原菌和虫害的入侵。本研究结果证实了水培植物的种植有利于池塘水体中细菌微生物生长, 而这些共生细菌的存在反过来也极大地促进了蔬菜的生长。
对比两处试验点空心菜根系上特有OTU, 发现米东区长山子镇水源地养殖基地鱼菜共生池塘空心菜根系(MD.R)中特有OTU明显高于新疆水生野生动物救护中心(JH.R), 而这些特有OTU可能与该池塘空心菜生长较好有关。刘志敏等[42]通过研究发现, 根际细菌在提高蔬菜对环境胁迫的抗逆性上有着十分重要的作用, 能有效促进植物的生长。因此, 从某种意义上来讲, 蔬菜根际和种植环境中细菌微生物之间存在相互促进、相互调节的作用机制。
NMDS排序图显示JH.C与JH.KX处于同一象限, 且相聚最近, 表明两者微生物群落结构相似, 而MD.C与MD.KX位于不同象限, 显示两者微生物群落结构相差较大, 这可能是因为米东区长山子镇水源地养殖基地(MD)池塘空心菜生长较旺盛, 对水质改善较大, 改变水体细菌结构组成多样性的程度较高。此外, JH.R和MD.R也处于同一象限, 表明二者存在生长于空心菜根系上的共有细菌。在UPGMA聚类图中, 鱼菜共生池塘水中的细菌与对照水体较为相似, 而与根系上的细菌差别较大也证明了此点。这可能是由于受到根系的影响, 使得植物根际的微区域环境与其周围的环境主体在物理、化学和生物方面存在很大差别。

