Sb3+-OH-体系中锌粉置换锡的动力学
孙彬彬,张兴勇,韩云亮,白金印,秦英然,汤 研,蒋家超
(1.中国矿业大学环境与测绘学院,江苏徐州 221116;2.江苏中科睿赛污染控制工程有限公司,江苏盐城 224000)
金属锡具有耐腐蚀及延展性好等优异性能,被广泛应用于汽车制造业、电子工业及锂电池行业[1-2]。近年来,随着中国锡矿资源的日渐衰竭,以及锡需求量不断增长,从含锡电子废弃物[3-4]、含锡电镀废渣[5]等二次资源中回收金属锡已成为研究热点。湿法冶金技术因具有明显的环境友好性和能耗较低等优点而被广泛应用于从二次资源中回收金属锡。湿法技术分为酸法和碱法,相比于酸法,碱法具有大多数杂质金属离子均不会进入体系中的优点,因此,在碱性(OH-)体系中回收金属锡具有更广阔的应用前景。
前期研究表明,可利用锌粉从碱液中置换回收锡,同时置换液可通过电沉积方式回收锌粉(ρ(Sn4+)<100 mg/L)[6-10]。在Sb3+-OH-体系中,锌粉置换锡反应速率快,反应时间短,得到的产物更为分散且纯度更高。为进一步研究Sb3+对锌粉置换锡反应的促进机制,研究了此反应的动力学。
1 试验部分
1.1 试验试剂
氢氧化钠,锡酸钠(Na2SnO3·4H2O),氧化锌,酒石酸锑钾(C8H4K2O12Sb2),均为分析纯,国药集团化学试剂有限公司产品;试验用水为去离子水。
Sb3+-OH-体系通过在碱性溶液中投加一定量酒石酸锑钾配制。
1.2 锌粉制备
锌粉采用碱锌溶液电沉积法制备。称取121.6 g NaOH和21.87 g ZnO,用去离子水溶解并定容至500 mL,配成质量浓度为35 g/L Zn2+和质量浓度200 g/L NaOH的碱锌溶液。取450 mL溶液置于500 mL塑料烧杯中,放入阴阳极板(阴极极板为镁钛合金,阳极极板为钢板,浸没有效面积为7 cm ×7 cm),用直流电恒流(4.5 A)电解1 h。电解所得锌粉从阴极板刮净,用去离子水反复冲洗至中性,在真空干燥箱中烘干得高纯电沉积锌粉(>99.5%)。
1.3 锌粉置换锡
称取47.98 g Na2SnO3·4H2O和120 g NaOH用去离子水溶解定容到1 000 mL,配制成质量浓度20 g/L Sn4+和120 g/L NaOH溶液。量取200 mL所配溶液倒入250 mL锥形瓶中,锥形瓶上倒置漏斗(用于回流)。锥形瓶放入磁力搅拌水浴锅中,加热至指定温度,之后调节搅拌速度为500 r/min并快速在锥形瓶里倒入一定质量自制电沉积锌粉。每镉5 min取3 mL样品,通过EDTA配合滴定法[11]测定溶液中Zn2+质量浓度和剩余Sn4+质量浓度。

(1)
2 试验结果与讨论
2.1 Sb3+对锌粉置换锡的影响
在碱质量浓度120 g/L、Sn4+质量浓度20 g/L、反应温度90 ℃、搅拌速度500 r/min、n(Zn)∶n(Sn)=3∶1条件下,Sb3+质量浓度对锌粉置换锡的影响试验结果见表1。可以看出:随Sb3+质量浓度增大,锌粉置换锡的反应速率加快,反应45 min后即达置换终点(ρ(Sn4+)<100 mg/L),说明Sb3+的存在能显著提高碱液中锌粉置换锡的反应速率;随Sb3+质量浓度增大,析氢副反应(见式(2))加剧,参与析氢副反应的锌粉占比越大导致生成的氢气越多,溶液中气泡(H2)越多,溶液越浑浊,说明Sb3+的存在加速了碱液中锌粉析氢副反应,导致锌粉消耗量增大。试验过程中发现,Sb3+质量浓度越大,生成的产物锡分散度越好,晶体颗粒越细,这是由于生成的氢气在溶液中起到了充分鼓泡搅拌作用,导致生成的锡不易团聚而形成分散颗粒。
(2)

表1 Sb3+质量浓度对锌粉置换锡的影响
2.2 锌粉置换锡的动力学分析
置换反应是液-固多相反应,根据文献,可采用缩核模型[12-13]分析其反应动力学。碱液中锌粉置换锡的反应过程分为3步:
1)膜扩散控制:碱液中的Sn4+通过锌粉表面的液膜层扩散到锌粉表面,并生成产物锡沉积层;
2)内扩散控制:Sn4+通过渗透、扩散作用,透过产物锡沉积层至未反应锌粉颗粒表面;
3)化学反应控制:到达未反应锌粉颗粒表面的Sn4+与锌粉发生化学反应。
膜扩散控制、内扩散控制和化学反应控制模型的动力学方程式如下:
x=kt;
(3)
(4)
(5)
式中:x为锡置换率,%;k为反应速率常数,min-1;t为反应时间,min。
在NaOH质量浓度120 g/L、Sn4+质量浓度20 g/L、搅拌速度500 r/min、n(Zn)∶n(Sn)=3∶1条件下,考察Sb3+质量浓度(0,100 mg/L)、反应温度对锡置换率的影响,反应时间45 min,每隔5 min取一次样。将计算所得x代入式(3)~(5)并对时间t进行拟合。较高温度下,置换反应过程随反应时间延长及产物团聚现象的发生,反应速率会有一定幅度下降,因此,根据实际试验数据进行分段拟合。结果如图1~3所示。
由图1~3看出:OH-体系,1-3(1-x)2/3+2(1-x)-t拟合曲线较另2种控制模型有更好的拟合度,因此说明,在OH-体系中,锌粉置换锡反应受内扩散控制。
由图1~3看出:Sb3+-OH-体系,当添加了100 mg/L Sb3+之后,1-(1-x)1/3与时间t的拟合直线较另2种控制模型有更好的线性关系,因此说明,在Sb3+-OH-体系中,锌粉置换锡的反应主要受化学反应控制。
根据图1~3计算3种不同控制模型下的反应速率常数,结果见表2。
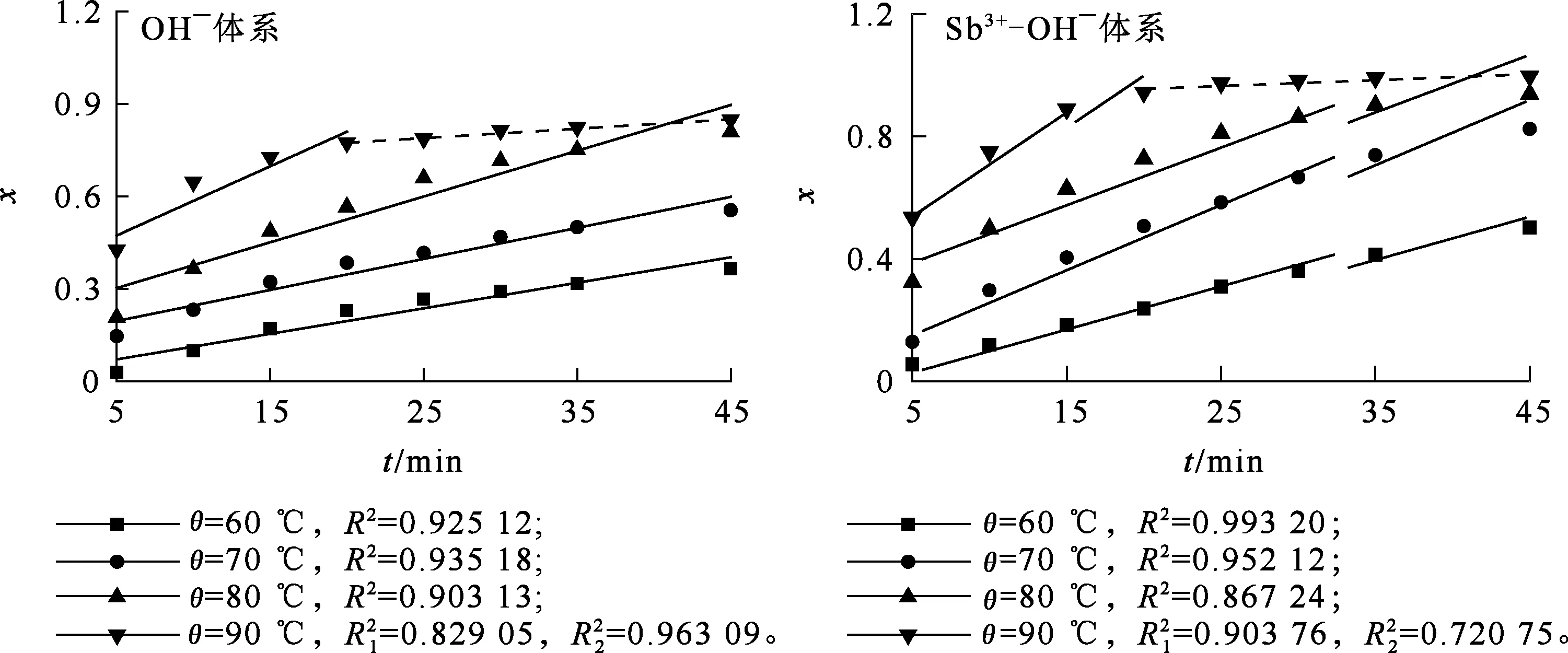
图1 不同体系和温度下,x与t之间的关系

图2 不同体系和温度下,1-3(1-x)2/3+2(1-x)与t之间的关系
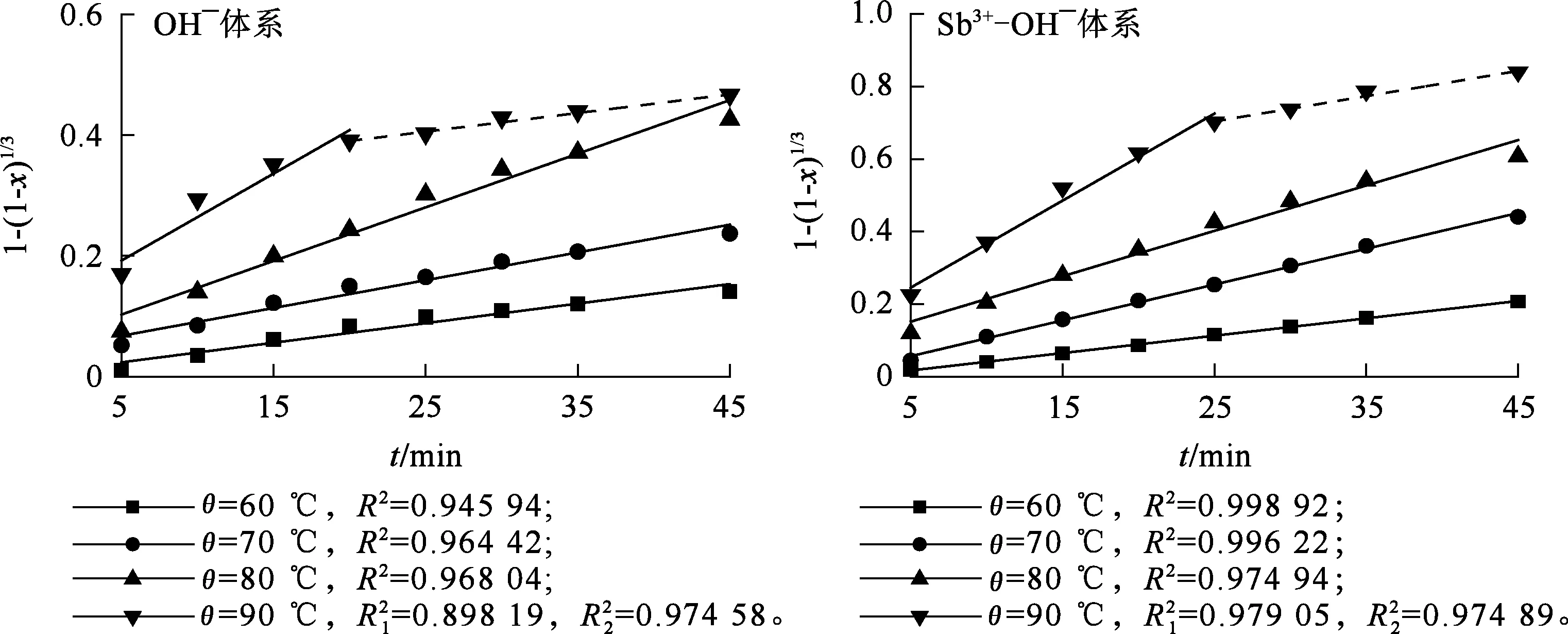
图3 不同体系和温度下,1-(1-x)1/3与t之间的关系
由表2看出:Sb3+-OH-体系中,置换反应速率常数要远大于OH-空白体系;随温度升高,置换反应速率常数增大,在90 ℃时,出现2段拟合,且第2段置换速率常数(k2)要远小于第1段置换反应速率常数(k1)。这是因为随反应进行,溶液中剩余锡离子浓度下降,导致同一时间内生成的锡更少,且高温下生成的锡易与锌粉团聚,增大了锌粉的扩散阻力。因此,90 ℃时,锌粉置换锡的反应速率大幅下降。
为进一步探索Sb3+-OH-体系中锌粉置换锡的反应动力学,计算锌粉置换锡反应活化能(Ea),计算过程及公式[14-15]如下:

表2 3种不同控制模型下的反应速率常数
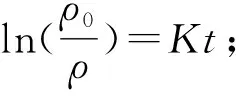
(6)
(7)
式中:ρ0为溶液中Sn4+初始质量浓度,mg/L;ρ为碱液中Sn4+实时质量浓度,mg/L;K为斜率,s-1;t为反应时间,min;k为传质系数,cm/s;S为锌粉反应面积,cm2;V为溶液体积,cm3。
(8)
式中:k为传质系数,cm/s;A为指前因子;Ea为反应活化能,kJ/mol;T为热力学温度,K;R为理想气体常数,8.314 J/(mol·K)。
图4为OH-和Sb3+-OH-体系中,ln(ρ0/ρ)与t的线性拟合曲线;图5为OH-和Sb3+-OH-体系中,锌粉置换锡的阿伦尼乌斯曲线。OH-和Sb3+-OH-体系中ln(ρ0/ρ)与t之间的拟合参数见表3。其中:传质系数(k)通过式(7)计算求得;反应活化能(Ea)由阿伦尼乌斯公式(8)及阿伦尼乌斯曲线(图5)计算求得。
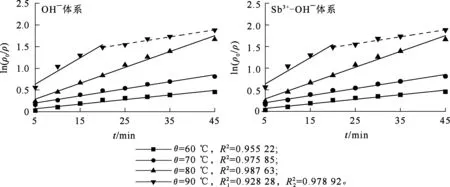
图4 不同体系和温度下,ln(ρ0/ρ)与t之间的拟合关系曲线
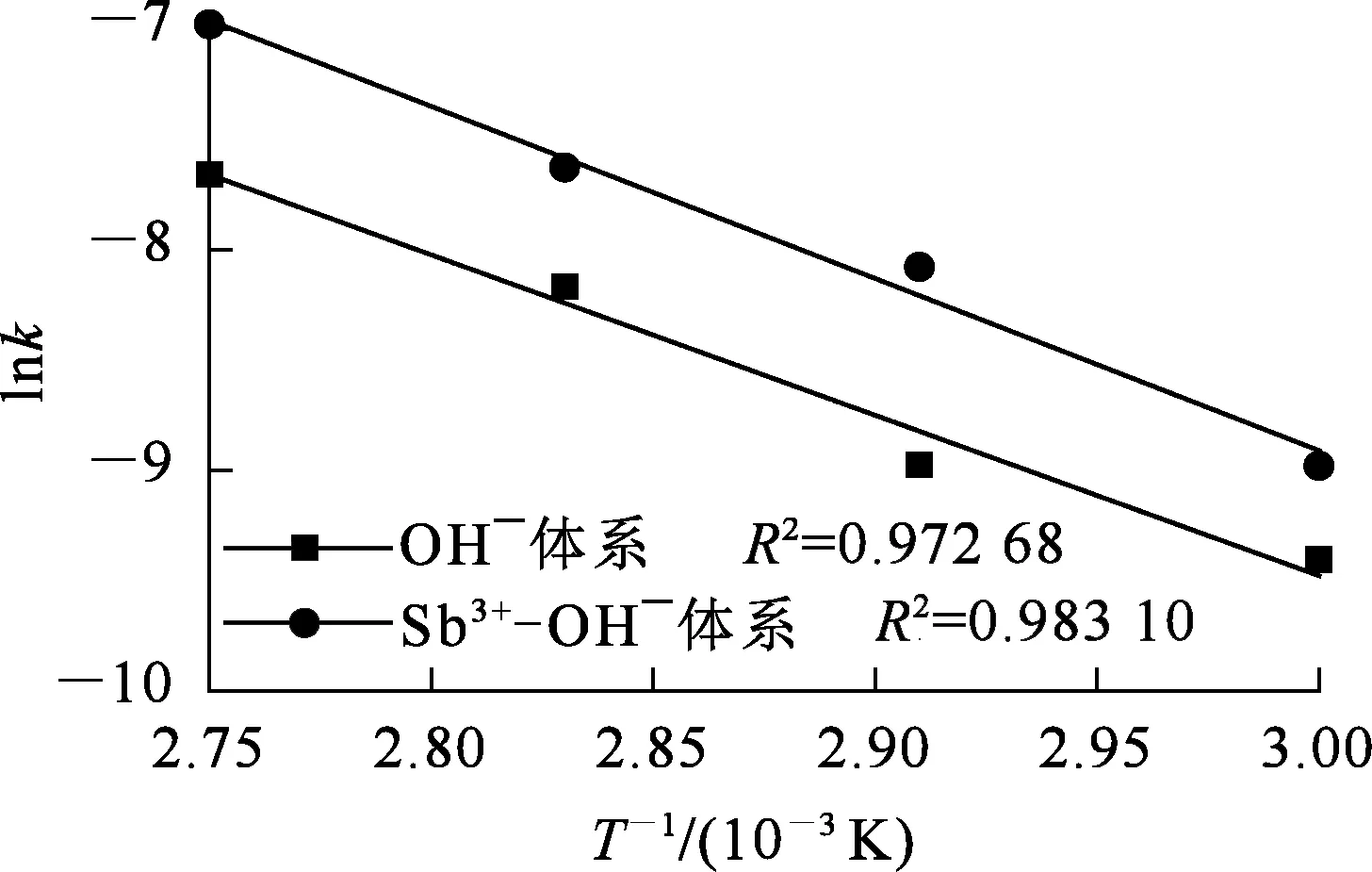
图5 不同体系下锌粉置换锡的阿伦尼乌斯曲线
由表3看出:在Sb3+-OH-体系中的锌粉置换锡反应过程传质系数大于在OH-体系中的,且随温度升高,两者之间的差值加大,这说明在Sb3+-OH-体系中,反应速率明显增大,且随温度升高表现得更充分;两个体系中,反应活化能基本一致,而OH-体系中的指前因子(A=0.23×106)要远小于Sb3+-OH-体系中的指前因子(A=1.95×106)。这说明:Sb3+-OH-体系中,反应活化能未发生改变,Sb3+的存在未改变置换反应机制,反应位点和反应路径与OH-空白体系基本相同;Sb3+-OH-体系中,指前因子较在OH-体系中变大,说明参与反应的锌粉的活性位点增多[16]。所以,添加Sb3+可分散产物锡和锌粉的团聚,进而可以使锌粉充分暴露在溶液中,提供更多的活性位点,从而加快反应速率。

表3 OH-和Sb3+-OH-体系中ln(ρ0/ρ)与t之间的拟合参数
3 结论
在Sb3+-OH-体系中,锌粉置换锡的反应速率加快,反应时间缩短,析氢副反应增强,产物锡颗粒更为分散。
锌粉置换锡的反应,在OH-体系中受内扩散控制,在Sb3+-OH-体系中受化学反应控制。两体系中的反应活化能基本一致。Sb3+-OH-体系中的置换反应指前因子(A=1.95×106)远大于OH-体系中置换反应指前因子(A=0.23×106),表明Sb3+的添加未改变置换反应机制。Sb3+的存在加快了置换反应速率,这是析氢副反应产生的大量氢气泡分散了锌粉与产物锡颗粒的团聚,从而增加了锌粉反应活性位点数。

