湿法炼锑过程中锑铁的水解分离
饶泽文,田德柱,欧阳臻,陈永明,叶龙刚
(1.湖南工业大学冶金与材料工程学院,湖南株洲 412007;2.中南大学冶金与环境学院,湖南长沙 410083)
湿法炼锑工艺包括碱法(以NaOH-Na2S为浸出剂)和酸法(以FeCl3/Cl2为浸出剂)[1-3]。碱法存在的主要问题是电流效率低,有多硫化物增生;酸法所得浸出液通过隔膜电积获得金属锑[4-5],解决了SO2排放问题,但在酸浸过程中会有一定量铁矿物被溶解,造成锑电积后液中铁离子增生,最终影响电锑质量和电流效率,锑电积后液无法返回循环利用。试验研究了以水解法从锑电积后液中分离锑、铁,利用锑和铁水解性质差异沉淀锑。
针对锑铁混合溶液的主要分离方法有溶剂萃取法和蒸发结晶法。溶液中离子价态具有的复杂性会导致萃取剂选择性差、锑铁共萃、锑铁分离不充分的问题[6-7],同时含铁有机相容易乳化,导致回收困难;蒸发结晶法也需要预先进行锑、铁分离,而且成本较高。其他的方法包括离子交换法、生物吸附法和膜分离法主要适用于低浓度锑铁溶液的净化,对于高酸、高离子浓度的浸出液不适用[8]。由于锑具有独特的水解特性,其在 H+浓度为1.0 mol/L 以下就开始大量水解,这一性质被用于制备锑氧[9-10]和含锑废水净化[11]。但对从高浓度锑铁溶液中水解分离锑铁和制备氧化锑尚无研究报道,铁的水解对氧化锑产品形貌和纯度影响如何,锑、铁分离效果和酸度损失都是该方法能否适用于锑、铁溶液分离的关键所在,因此,试验研究了从锑铁溶液中水解分离锑,并转型制备氧化锑产品,以求解决以产品化的形式实现锑铁分离难题。
1 试验部分
1.1 试验原料及仪器
试验所用试剂:三氯化锑,氯化亚铁,氨水(1+1),酒石酸,乙二胺四乙酸(EDTA),氢氧化钠,碳酸钠,均为分析纯。
模拟溶液:用分析纯三氯化锑、氯化亚铁配制,其中,Sb、Fe、H+质量浓度分别为25.85、14.37、2.38 g/L,与生产中的锑电积后液接近。
磁力恒温水浴锅(DF-101S,湖南力辰仪器科技有限公司);高酸pH计(雷磁PHSJ-5,上海仪田精密仪器有限公司);锥形瓶,分液漏斗。
1.2 试验方法及原理
水解:试验在磁力恒温水浴锅中进行。每次移取100 mL锑铁模拟液至锥形瓶中;加入一定量氨水于分液漏斗中,控制滴加速度,打开电磁搅拌,向锥形瓶中滴加氨水;氨水滴加完成后继续保温搅拌30 min,之后冷却、静置;待溶液澄清后测定pH,并过滤分离水解产物;滤渣用pH=1的稀盐酸溶液洗涤,之后烘干并称重,取渣和滤液分析锑、铁含量。水解过程可能发生的反应如下:

(1)

(2)

(3)
水解产物物相由X射线粉末衍射仪(Rigaku D/max 2550VB+18 kW,日本理学公司)测定,产物形貌采用扫描电子显微镜(JSM-6490LV,日本JEOL公司)观察,元素组成采用X射线荧光光谱仪(Axios型,荷兰PANalytical公司)测定,溶液中锑含量采用电感耦合等离子发射光谱仪(Avio200型,美国PerkinElmer公司)分析。根据分析结果,分别计算锑、铁水解率,见式(4)(5)。
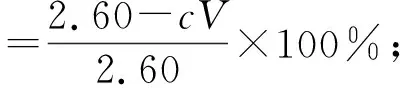
(4)
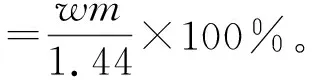
(5)
式中:c—滤液中锑质量浓度,g/L;V—滤液体积,L;w—渣中铁质量分数,%;m—水解渣质量,g。
水解产物转型:试验在恒温水浴中进行,电磁搅拌,反应时间30 min,温度为40 ℃,转型剂为酒石酸(6 g/L)和EDTA(6 g/L),液固体积质量比为5/1,转型终点pH≈10。反应后过滤得滤渣和滤液,滤渣烘干后称重。水解所得产物在转型过程中发生反应(6)~(8),氯氧化锑转型为氧化锑。

(6)

(7)

(8)
2 试验结果与讨论
2.1 水解温度对锑、铁水解的影响
根据预试验结果,选取体系终点pH=0.5,即取39 mL氨水(1+1)加入到100 mL锑铁混合液中,氨水滴加时间30 min(滴加速度1.3 mL/min),水解温度对锑、铁水解的影响试验结果如图1所示,不同温度条件下所得水解产物的XRD分析结果如图2所示。
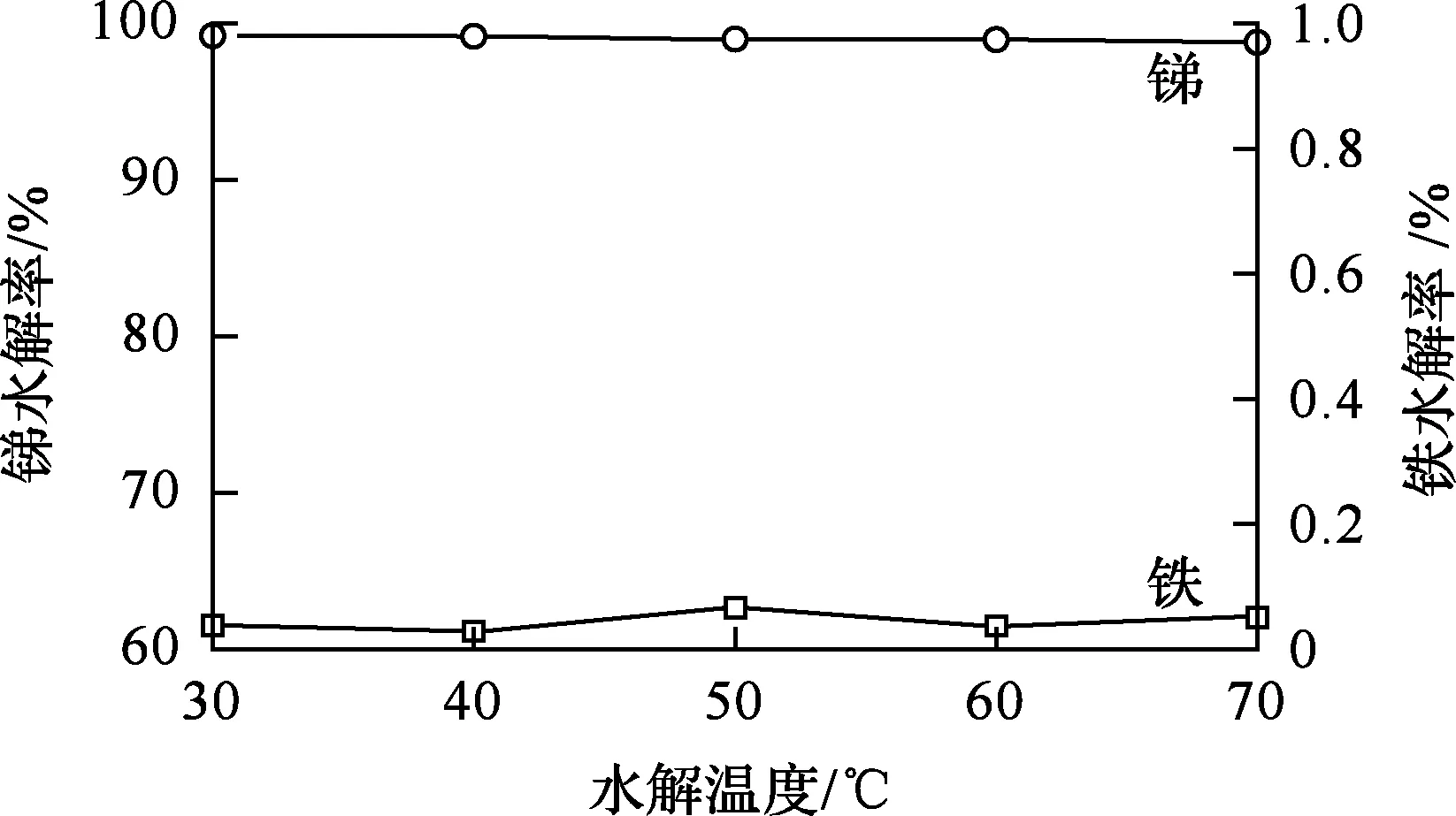
图1 水解温度对锑、铁水解的影响
由图1看出,水解温度对锑和铁水解率的影响均不大,锑水解率维持在98.5%以上,铁水解率稳定在0.1%以下。但随水解温度升高,氨水挥发速度加快,影响水解反应进行;若水解温度过高,水解产物溶解量加大,水解率会稍有降低。铁水解率远远低于锑水解率,因此锑、铁分离效果较好。
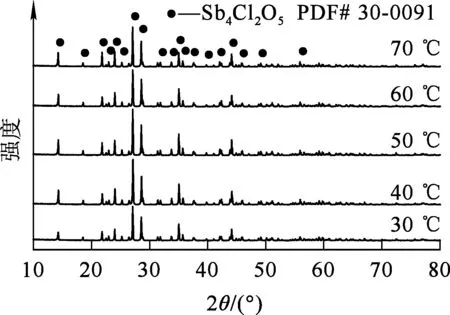
图2 不同水解温度条件下所得产物的XRD图谱
由图2看出,不同温度条件下所得产物的衍射峰基本一致,均为Sb4O5Cl2衍射峰。表明温度对峰强度和位置没有影响,进一步验证了锑水解率在不同温度条件下相差不大,水解所得氯氧锑结晶性好、纯度高的结论。
2.2 体系终点pH对锑、铁水解及产物形貌的影响
控制温度30 ℃,氨水滴加速度1.3 mL/min,通过调节氨水加入量改变体系终点pH,考察体系终点pH对锑、铁水解率及产物形貌的影响。试验结果分别如图3、4所示。
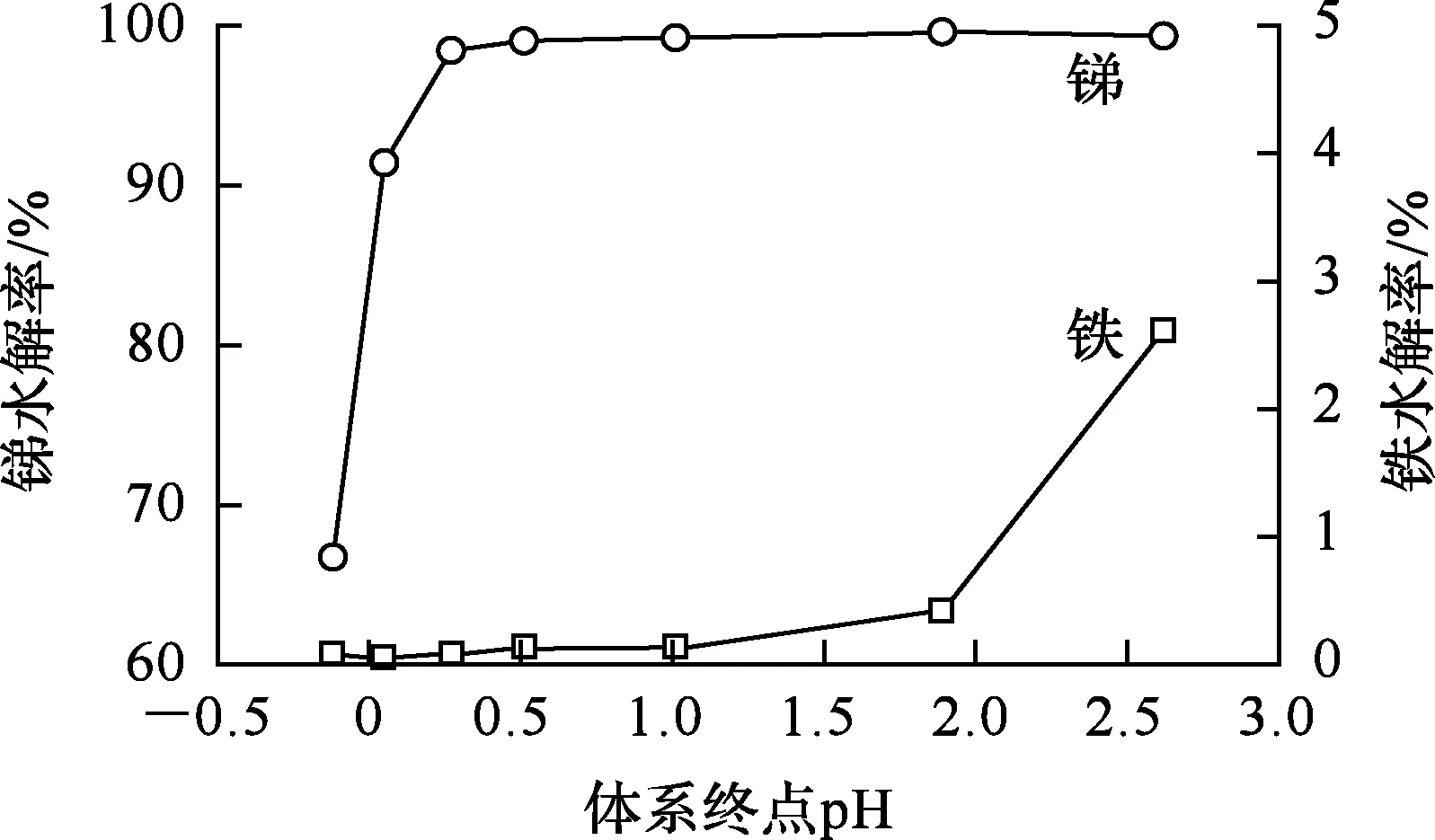
图3 终点pH对水解的影响
由图3看出,水解终点pH对锑、铁水解率影响较大:终点pH在-0.1~0.3范围内,锑水解率随pH升高而快速提高;终点pH=0.5和pH=1.0时,锑水解率分别达99.04%和99.24%,已基本水解完全;但pH超过1.0后,铁水解率快速提高,在pH=3.0时,铁水解率为2.6%。可见,控制体系终点pH低于1.0,可使锑、铁较好分离。

a—pH=-0.1;b—pH=0;c—pH=0.5;d—pH=2.6。
由图4看出:pH=-0.1时,氯氧锑晶型较为杂乱,多呈片簇状,颗粒结晶度不高;随溶液pH升高,氯氧锑结晶度更好,呈现较为规则的锥体结构;尤其在pH为0~0.5时,氯氧锑呈粒度均匀、外形规整、结晶完好的方锥结构;而在pH=2.6时则有无规则、结晶性差的聚状物出现,此为铁水解物。综合考虑,选择反应终点pH=0.5,既可降低氨水用量,也可控制铁的水解,从而得到颗粒均匀、结晶度好的氯氧锑。
2.3 氨水流速及滴加时间对锑、铁水解的影响
水解温度30 ℃,体系终点pH=0.5,氨水流速及滴加时间对锑、铁水解的影响试验结果分别如图5、6所示。
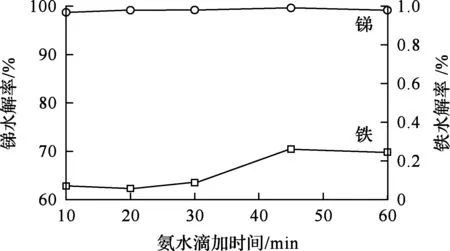
图5 氨水滴加时间对锑、铁水解的影响
由图5看出,随氨水流速减小,锑、铁水解率都有缓慢提高趋势。氨水流速减小,反应时间延长,水解反应更充分,但水解率提高幅度有限,锑水解率从10 min的98.7%提高到45 min的99.7%;铁水解率在反应45 min后超过0.2%。

a—10 min;b—20 min;c—45 min;d—60 min。
由图6看出,氨水加入速度对水解产物晶型有一定影响:流速太快,局部pH过高,颗粒形貌杂乱,结晶性差;随流速降低,水解产物的结晶性更好,60 min时,产物具有规则的锥体结构,没有不规则物和絮状物。缓慢滴加氨水,溶液pH变化梯度小,允许氯氧锑更好地成核和长大。综合考虑,最终选择氨水滴加时间为30 min,即流速为1.3 mL/min。
2.4 氯氧锑晶体转型
在优化水解条件(水解温度30 ℃,体系终点pH=0.5,氨水滴加时间30 min)下进行扩大试验,产出100 g氯氧锑。在体系中添加相同量添加剂(酒石酸+EDTA),同时,加入3种不同的转型剂对氯氧锑进行转型,考察转型剂种类对氯氧锑转型的影响。试验结果见表1和图7。
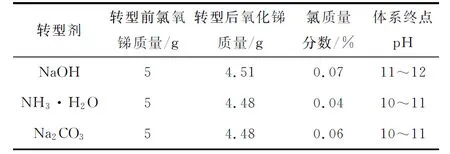
表1 转型剂种类对氯氧锑转型的影响
由表1看出,用3种不同转型剂转型后均可得到接近理论转型质量(4.45 g)的氧化锑,其中氯质量分数均在0.1%以下,说明转型反应较为充分。
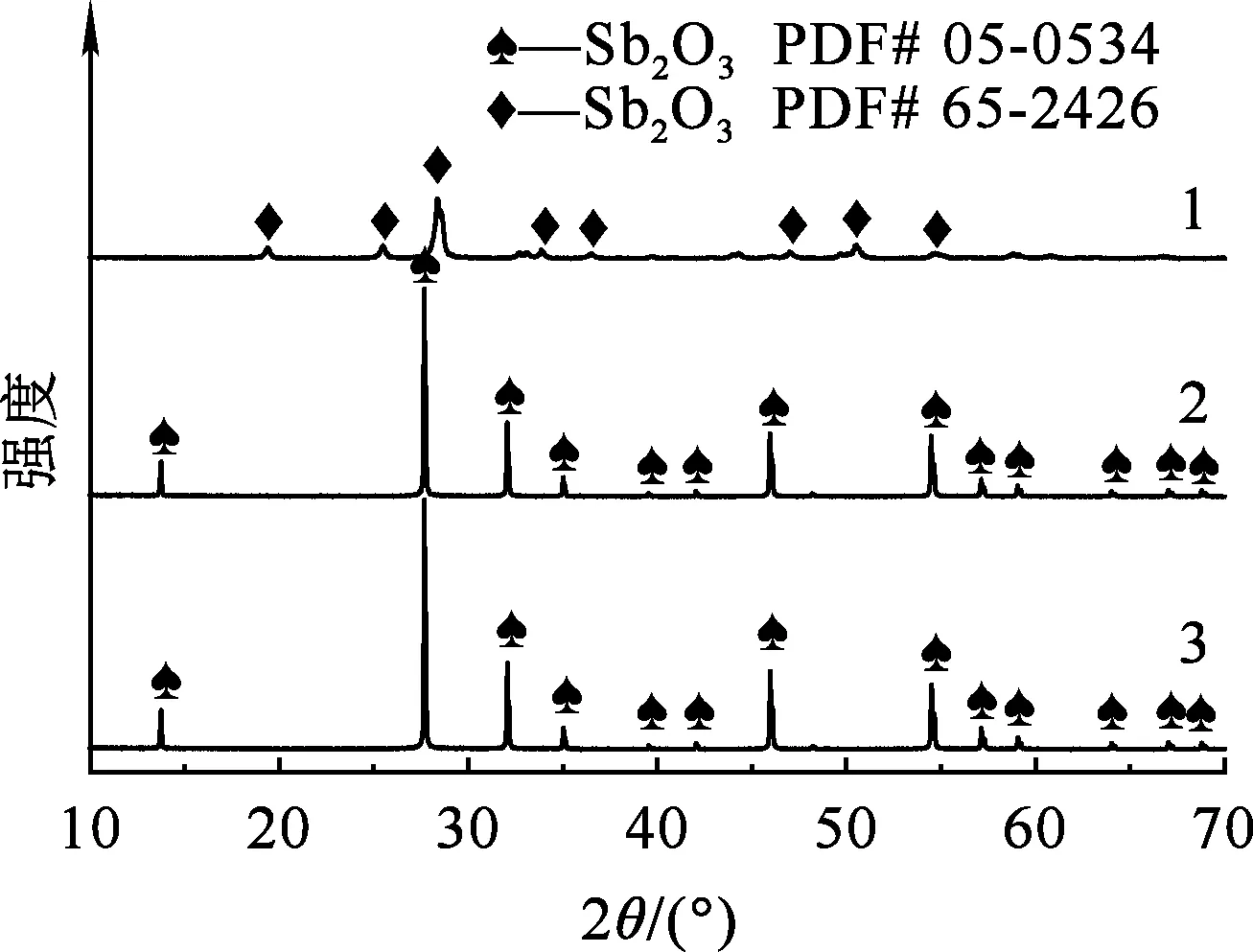
1—NaOH;2—NH3·H2O;3—Na2CO3。
由图7看出,转型产物的图谱与标准卡片匹配较好,无其他杂峰出现,表明水解产物为纯净的Sb2O3。对比看出:以NaOH为转型剂,所得产物氧化锑为斜方晶型结构(晶格常数:a=0.492 nm,b=1.246 nm,c=0.543 nm);而以NH3·H2O和Na2CO3为转型剂所得产物氧化锑为立方晶型结构(晶格常数:a=b=c=1.11 nm),峰型尖锐,半峰宽窄,结晶性更好。
3 结论
采用水解法可将锑电积后液中的锑、铁分离。适宜的水解条件为水解温度30 ℃,体系终点pH=0.5,氨水加入速度1.3 mL/min。在此条件下,锑、铁水解率分别为99.2%和0.08%,同时得到结晶良好的氯氧锑。
针对水解所得氯氧锑,以NaOH为转型剂可将其转化为斜方晶系氧化锑,但晶型杂乱、颗粒细小;以NH3·H2O或Na2CO3为转型剂可将其转化为立方晶系氧化锑,结晶良好,颗粒规整,更符合阻燃剂等行业对锑白产品的质量要求。

