低频振动对小鼠骨髓间充质干细胞成骨分化及相关基因表达的影响
曹文娟 罗政强 徐飞 郑泽航 吴骁伟
平板振动疗法是近年来临床上广泛应用的一种治疗方式,振动疗法的治疗效果与振动频率、振动幅度及振动时间相关。低频振动是指频率低于100 Hz的振动,低频振动对于肌肉萎缩性疾病有一定的疗效[1],其产生作用的机制主要为振动作用通过力学信号系统转导至细胞内产生作用。在骨骼系统中,力学信号同样有重要作用。机械应力信号能通过细胞表面的感受器转化为生物学信号发挥作用[2]。低频振动对骨骼系统产生作用是现阶段的研究热点之一[3]。振动可以增加人体的平衡感,增强肌力;同时,振动被认为可以促进成骨细胞活性,抵消衰老对骨质的影响,防止骨质流失[4]。现阶段有较多振动对骨骼系统影响的研究,但结果并不一致,其原因可能为各研究的振动频率和幅度不同[5-9]。
骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)是骨骼系统中骨形成的主要来源细胞,其不仅可分化为成骨细胞而且能分泌相关细胞因子影响破骨细胞的形成与分化[10]。本研究采用低频振动干预BMSCs 向成骨分化的进程,并检测相关分泌因子,以明确低频振动对BMSCs 成骨分化的影响。
材料与方法
一、分离、培养及鉴定小鼠BMSCs
取3 周龄C57BL/6 小鼠(由华中科技大学同济医学院实验动物中心提供,动物实验遵守我院伦理委员会相关规定),麻醉后采用颈椎脱臼法处理小鼠。收集小鼠的双侧股骨与双侧胫骨,注射器冲洗取其内的BMSCs,采用全骨髓培养法进行培养,培养基为a-MEM(Hyclone 公司,美国)[10%胎牛血清(fetal calf serum, FCS;Gibico 公司,美国)+1%抗生素]。72 h进行换液,以后每3 d进行换液,细胞长到90%进行传代。培养的第3代细胞分别进行诱导成骨细胞分化、脂肪细胞分化及软骨细胞分化,诱导分化结束进行碱性磷酸酶(alkaline phosphatase,ALP)染色,油红O 染色及阿利新蓝染色(Sigma 公司,美国),并采用流式细胞学技术测定其细胞相关表面标志物。
二、体外低频振动干预小鼠BMSCs的成骨分化
取第3 代BMSCs 进行成骨诱导,成骨诱导培养基为a-MEM含10%FCS,10 mmol/L β-甘油磷酸钠,0.1 μmol/L 地塞米松,50 mg/L 维生素C。在诱导过程中采用平板振动台(Juvent Health 公司,美国)进行低频振动(15 Hz,垂直加速度0.3 g)干预,干预方式为每天一次,一次45 min,于干预第7天及第14天收获细胞。对照组细胞,每天只将细胞放置在平板振动台上45 min,但不进行振动干预,同样于第7天及第14天收获细胞。
三、ALP染色及茜素红染色
将收获的第7天细胞进行ALP染色,步骤如下:采用10%甲醛固定1 min,然后磷酸盐缓冲液(PBS)冲洗3次,加入BCIP染色液,避光环境下染色15 min。自来水下冲洗,保持稍湿润。将收获的第14天的细胞进行茜素红染色,染色步骤如下:吸去培养基,PBS小心漂洗3次,4%的多聚甲醛固定30 min;吸去固定液,去离子水漂洗3 次,加入茜素红染色液(pH 4.1~4.3),常温下避光孵育45 min;小心吸去染色液,去离子水漂洗细胞至少4 次;最后一次加入PBS 保持细胞湿润。
四、Real-time PCR分析
干预14 天后收获细胞,每107个细胞加入1 ml Trizol 进行裂解,冲打后冰上静置5 min,将Trizol 移至1.5 ml EP 管,加入0.2 ml 三氯甲烷,孵育3 min,4 ℃、1 200×g 离心15 min,将上层清液转移到一个新的EP 管中,并加入0.5 ml 异丙醇,4 ℃、1 200×g离心10 min,EP管底部即为RNA,弃上清,再用75%乙醇洗涤所提RNA 一次,并调整两组总RNA 浓度一致,采用逆转录试剂盒进行逆转录为cDNA。Real-time PCR 检测:Ⅰ型胶原蛋白(collagen type Ⅰ,ColⅠ),骨桥蛋白(osteopontin,OPN),骨钙素(osteocalcin,OCN),骨保护素(osteoprotegerin, OPG)和破骨细胞分化因子(receptor activator of NF-κB ligand,RANKL)等基因的表达(内参选用18S)。所用引物序列如表1所示。
五、培养上清酶联免疫吸附试验(ELISA)分析
在诱导分化的第12 天将成骨诱导培养基的FCS含量更换为0.5%,培养48 h后,换为无血清成骨诱导培养基,24 h 后收集上清液。按照ELISA 试验盒(USCN)操作指南测定培养上清液中OPG 及RANKL的含量。
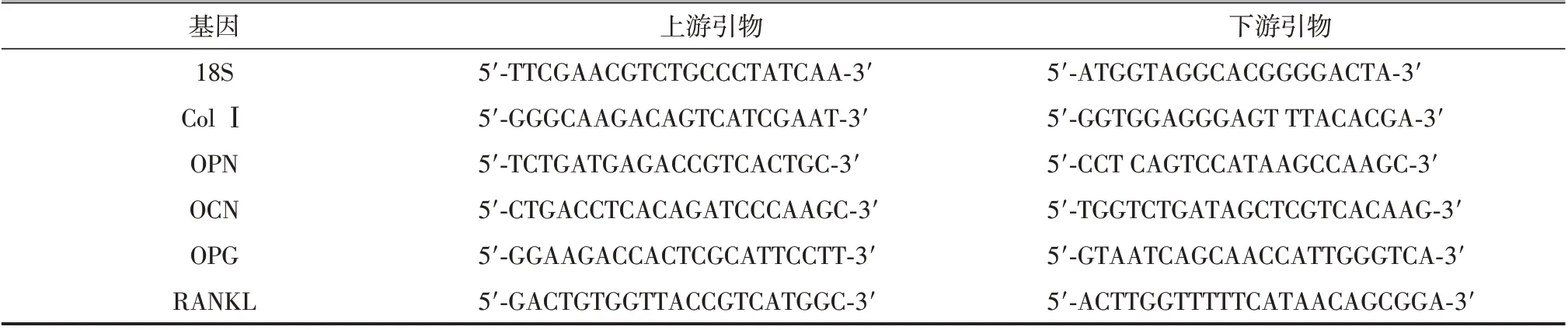
表1 Real-time PCR所用引物序列
六、统计学处理
应用SPSS 20.1统计软件(IBM公司,美国)进行统计学分析,计量资料用均数±标准差(±s)表示,两组间比较采用t 检验,多组间比较采用单因素方差分析,P<0.05为差异具有统计学意义。
结 果
一、BMSCs的鉴定
将培养的第3 代细胞进行诱导分化,成骨诱导7 d进行ALP染色,成脂诱导7 d进行油红O染色,成软骨诱导14 d进行阿利新蓝染色。三系分化均为阳性(图1),所分离细胞具有向成骨细胞、脂肪细胞及软骨细胞的多项分化潜能;流式细胞学检测,显示其表面标志物Scal-1(+)、CD29(+)、CD11b(-)、CD45(-)(图2)。
二、低频振动促进BMSCs成骨分化
通过低频振动刺激7 d,两组细胞均进行ALP染色。低频振动组ALP 活性明显高于对照组。刺激14 d 后,低频振动组钙节结形成量明显多于对照组(图3),说明低频振动对BMSCs 向成骨分化起促进作用。
三、低频振动能改变成骨细胞相关基因表达
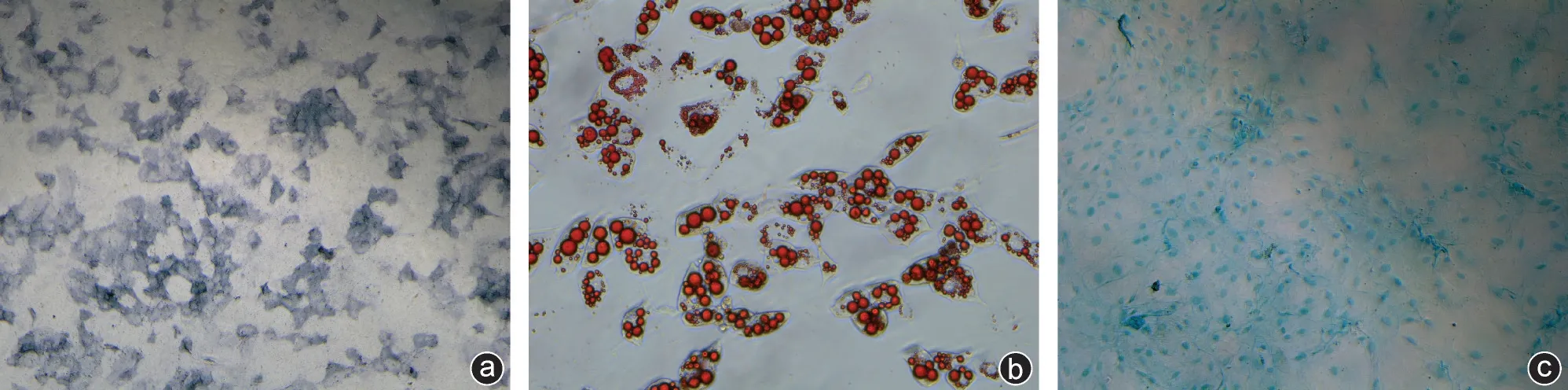
图1 三系分化染色均为阳性(×4) a:ALP染色;b:油红O染色;c:阿利新蓝染色

图2 流式细胞术检测示表面标志物 a:对照组;b~e:Scal-1(+)、CD29(+)、CD11b(-)、CD45(-)
低频振动干预14 d后收获细胞提取RNA,逆转Real-time PCR 检测了Col Ⅰ、OPN、OPG、RANKL、OCN等相关基因的表达。与对照组相比,低频振动组Col Ⅰ、OPN、OCN、OPG基因表达增加,RANKL基因表达下降(图4)。且细胞培养上清中,低频振动组OPG 含量为(55.9±2.8)μg/L,较对照组的(30.5±1.8)μg/L 增高,RANKL 含量(3.5±0.1)μg/L,较对照组的(5.2±0.2)μg/L 下降,且差异具有统计学意义(P<0.05,如图5)。RANKL 能诱导破骨细胞生成,而OPG 通过竞争性抑制RANKL 的作用来抑制破骨细胞分化。这表明低频振动能提高BMSCs 的成骨能力,且能通过分泌OPG、RANKL 等蛋白来参与对破骨细胞分化的调控。
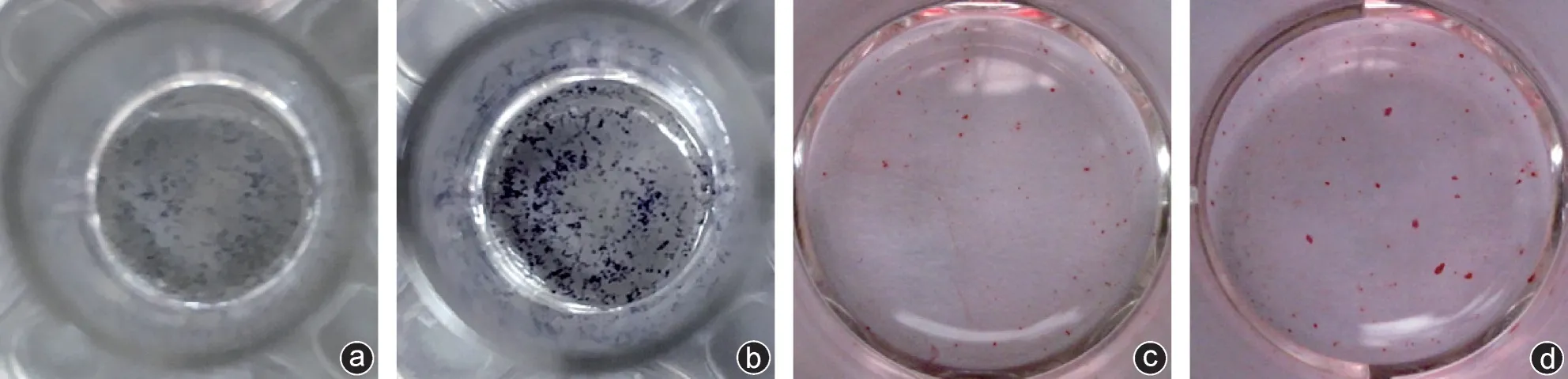
图3 细胞染色(大体观) a:对照组ALP染色;b:低频振荡组ALP染色;c:对照组茜素红染色;d:低频振荡组茜素红染色
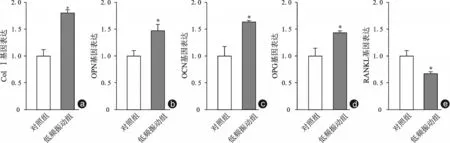
图4 Col Ⅰ、OPN、OCN、OPG及RANKL基因表达(以18S作为内参进行标准化处理) 与对照组相比,*P<0.05
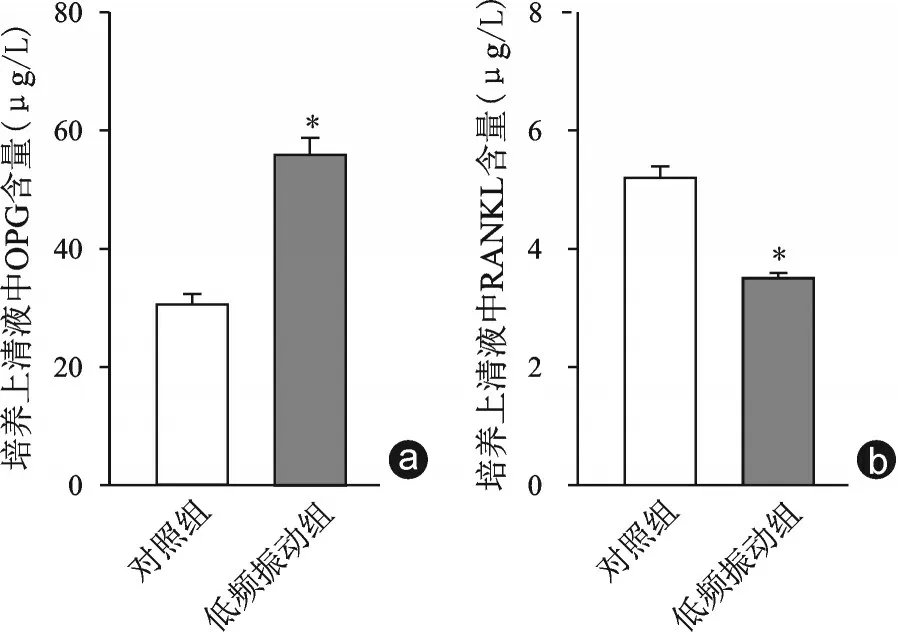
图5 两组培养基上清液中OPG 及RANKL 含量 与对照组相比,*P<0.05
讨 论
BMSCs 是存在于骨髓腔内的主要细胞之一,在不同的条件下可分化为成骨细胞、脂肪细胞与软骨细胞等,具有一定的干细胞特性。本研究中通过全骨髓贴壁培养法获取了小鼠的BMSCs,在体外成功地诱导为成骨细胞、脂肪细胞及软骨细胞;同时,采用流式细胞术检测了其表面抗原标志物,结果显示Scal-1(+)、CD29(+)、CD11b(-)、CD45(-),与相关研究表达一致[11,12]。BMSCs 向成骨分化的过程中,有多种因素可影响其分化结果,比如细胞因子、磁场与力学刺激等[13-15]。
生物机械应力及力学信号转导在细胞分化方向调控过程中发挥重要作用。BMSCs 表面存在力学转导的相关蛋白,能将力学信号转导至细胞内发挥相关作用。细胞膜上的整合素、G 蛋白和离子通道等感受到外界应力后,通过细胞骨架及相关信号通路将信号转导至细胞内,作用于细胞核[16],其中重要的一条细胞信号通路为MAPKs 通路[17]。过度应力可激活p38 及ERK 破坏软骨基质,介导软骨细胞的凋亡。活化的激酶随后转入细胞核,通过活化转录因子调控相关基因的表达,从而将力学信号刺激从细胞外传至细胞核,并介导产生基质金属蛋白酶(matrix metallo proteinases, MMPs)在内的多种炎症因子[18,19]。同时,外界应力刺激转导至细胞内后可磷酸化I-κB,导致I-κB被降解、I-κB与NF-κB解聚、NF-κB被激活并发生核转位,以p65/p50异二聚体的形式结合至DNA 上的相应位点,调控下游含有NFκB结合序列的靶基因的转录表达,从而影响细胞的功能[20]。
低频振动作为力学刺激的一种,在医疗上应用广泛。低频振动在康复方面对肌萎缩有较好的疗效,其机制为刺激肌肉过量表达IGF-I、MyoD,Myostatin 的表达减少,通过推动骨骼肌蛋白合成、抑制骨骼肌蛋白分解,从而推动骨骼肌萎缩的恢复[21]。低频振动作用于BMSCs后,在诱导其向成骨分化过程中,ALP活性增高,且钙结节数目增加,OCN、OPG表达增加,RANKL表达下降。ALP是评价成骨细胞分化过程中早期标志之一,钙结节是评价成骨细胞功能的晚期指标,形成钙结节的多少与成骨细胞功能呈正相关。RANKL 是单核细胞向破骨细胞分化过程中的一种重要蛋白,OPG是RANKL的一种竞争性抑制剂[22]。本研究结果表明,低频振动对骨代谢起正性调节作用,一方面可促进骨生成,另一方面可通过成骨细胞分泌的相关蛋白来抑制破骨细胞的生成。
本研究亦存在相关不足,低频振动是如何促进成骨生成的,并没有深入研究,其机制如何,是否有NF-κB、MAPKs 通路的参与暂不得而知。我们计划下一步继续进行相关研究。对于低频振动的频率,我们仅采用了一种频率,因为我们预试验显示此频率有较好的诱导成骨效果。
综上所述,低频振动有较好的诱导骨髓间充质细胞成骨作用,且能通过成骨细胞分泌相关蛋白抑制破骨细胞的生成。同时,低频振动具有无创伤、副作用小的优点,在应用上前景广泛,临床使用价值高。

