促分裂原活化的蛋白激酶与表皮生长因子受体在三阴性乳腺癌患者中的表达及临床意义△
蒋威华,熊廷川,王晓文,张晨光,伊丽娜,欧江华
新疆医科大学第三临床医学院/新疆医科大学附属肿瘤医院乳腺外科,乌鲁木齐830011
三阴性乳腺癌(triple negative breast cancer,TNBC)的研究一直是乳腺癌研究的热点问题,其在诊断、治疗和预后等方面困扰着不少学者。虽然分子生物学研究的不断发展为肿瘤治疗提供了新的途径,但TNBC目前在基因水平的治疗仍缺乏有力的证据,因此亟待寻找TNBC的新靶点以指导TNBC的诊断和治疗。促分裂原活化的蛋白激酶(mitogen-activated protein kinase,MAPK)对 TNBC的发生发展起重要作用,它是一组丝氨酸-苏氨酸蛋白激酶,能被不同细胞外因素刺激激活,目前所发现的3条MAPK信号通路中,胞外信号调节激酶(extracellular signal-regulated kinase,ERK)通路和c-Jun氨基末端激酶/应激活化的蛋白激酶(c-Jun N-terminal kinase/stress-activated protein kinase,JNK/SAPK)通路均在TNBC的发生机制中起重要作用[1-2]。表皮生长因子受体(epidermal growth factor receptor,EGFR)参与了很多复杂的细胞信号转导途径,作为原癌基因c-ErbB1的表达产物,其在间充质、上皮及神经源性组织中都有一定程度表达,对细胞的增殖分化有重要作用[3],与TNBC细胞的生长密切相关[4]。本研究旨在研究MAPK及EGFR在TNBC中的表达及临床意义,现报道如下。
1 资料与方法
1.1 一般资料
收集2011年1月至2013年12月于新疆医科大学附属肿瘤医院住院手术经病理证实为TNBC患者的病历资料。纳入标准:①首次治疗并进行手术治疗的患者;②雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)、人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)表达均为阴性的浸润性乳腺癌;③有完整病理资料及随访资料。排除标准:ER、PR、HER2表达均为阴性的原位癌。根据纳入、排除标准,共纳入TNBC患者200例,年龄25~72岁,中位年龄48.5岁。选取TNBC患者的200例TNBC组织及80例癌旁组织(距肿瘤>2 cm)进行研究。
1.2 检测方法及结果判读
采用免疫组织化学SP法测定组织中MAPK、EGFR的表达,实验操作严格按照质量控制内容进行,采取双盲法观察切片。
1.2.1 MAPK结果判读MAPK定位于细胞质及部分细胞核,阳性细胞为细胞核、细胞质或细胞膜呈棕黄色而背景清晰。随机取5个高倍视野,同时每个视野计数100个细胞,根据染色强度及阳性细胞所占百分比进行评分。阳性细胞所占百分比:<25%为1分,25%~50%为2分,51%~75%为3分,>75%为4分。染色强度:无色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。两项得分相乘为综合评分,结果≥3分为阳性,<3分为阴性。
1.2.2 EGFR结果判读 EGFR定位于细胞膜。>10%区域呈棕色或棕褐色染色,但细胞膜染色不连续者为1分;>10%区域呈棕色或棕褐色染色且细胞膜染色连续,但形态不完整者为2分;>10%区域呈棕色或棕褐色染色,细胞膜染色连续,且形态完整为3分。此外,细胞轻度棕褐色为1分,中度棕褐色为2分,重度棕褐色为3分。将两项分值相加,总分≤2分为阴性,>3分为阳性。
1.3 观察指标
比较MAPK、EGFR在TNBC组织及癌旁组织中的表达差异及与TNBC患者淋巴结转移、临床分期、预后的关系。局部复发是指同侧乳腺、胸壁或区域淋巴结复发;远处转移为通过临床特征、影像学检查以及组织活检以获得确认,经病理学诊断为乳腺癌的转移。
1.4 随访
随访截至2018年6月。无瘤生存时间定义为患者手术开始至复发转移的时间,总生存时间定义为自患者确诊之日至患者死亡的时间。
1.5 统计学方法
采用SPSS 18.0统计软件进行数据处理。计数资料以例数及率(%)表示,组间比较采用χ2检验;相关性分析采用Spearman秩相关分析;采用Kaplan-Meier法绘制生存曲线,Log-rank法比较生存情况。以P<0.05为差异有统计学意义。
2 结果
2.1 TNBC组织及癌旁组织中MAPK与EGFR表达情况的比较
TNBC组织中MAPK及EGFR的阳性表达率均明显高于癌旁组织,差异均有统计学意义(P<0.01)。(表1)
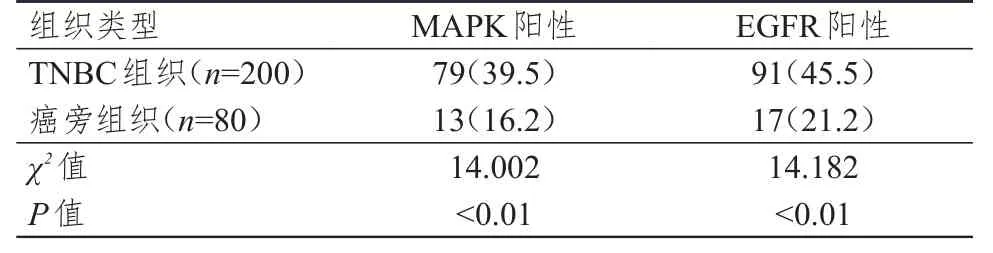
表1 TNBC组织及癌旁组织中MAPK与EGFR表达情况的比较[n(%)]
2.2 TNBC组织中MAPK与EGFR表达的相关性
TNBC组织中MAPK与EGFR的表达呈正相关(r=0.494,P<0.01)。
2.3 不同临床特征TNBC患者的TNBC组织中MAPK及EGFR表达情况的比较
不同临床分期及有无淋巴结转移的TNBC患者的TNBC组织中MAPK蛋白表达情况比较,差异均有统计学意义(χ2=6.982、4.547,P<0.05);不同临床分期及有无淋巴结转移的TNBC患者的TNBC组织中EGFR蛋白表达情况比较,差异均有统计学意义(χ2=16.515、9.362,P<0.05)。(表2)
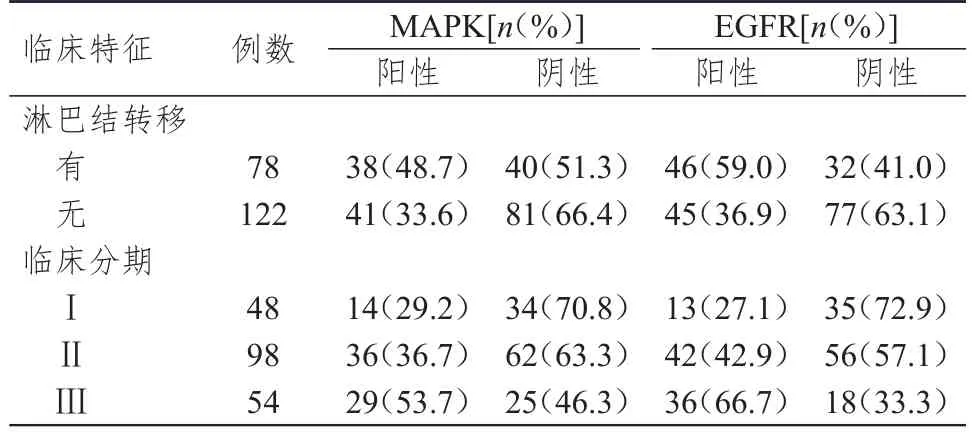
表2 不同临床特征TNBC患者的TNBC组织中MAPK及EGFR的表达情况
2.4 TNBC组织中MAPK及EGFR的表达情况与复发转移的关系
至随访截止日期,200例TNBC患者中共55例(27.5%)患者出现复发转移。55例复发转移TNBC患者的TNBC组织中MAPK、EGFR阳性表达率分别为54.5%(30/55)和65.5%(36/55),均明显高于无复发转移患者的33.8%(49/145)和37.9%(55/145),差异均有统计学意义(χ2=7.186、12.181,P<0.01)。
2.5 TNBC组织中MAPK及EGFR的表达情况与生存的关系
MAPK阳性表达患者5年无瘤生存率为62.0%,明显低于MAPK阴性表达患者的79.3%,差异有统计学意义(χ2=7.354,P<0.01)。EGFR阳性表达患者5年无瘤生存率为60.4%,明显低于EGFR阴性表达患者的82.6%,差异有统计学意义(χ2=12.404,P<0.01)。(图1、图2)
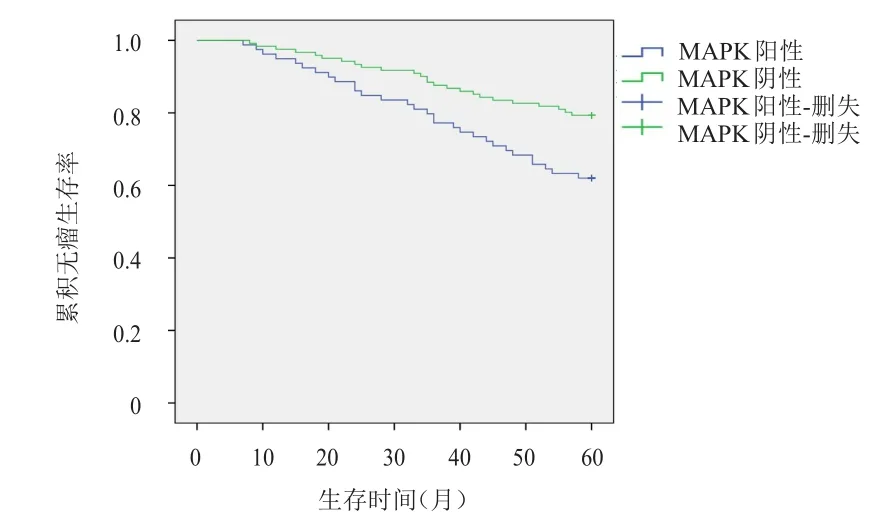
图1 MAPK阳性表达(n=79)及阴性表达(n=121)TNBC患者的无瘤生存曲线
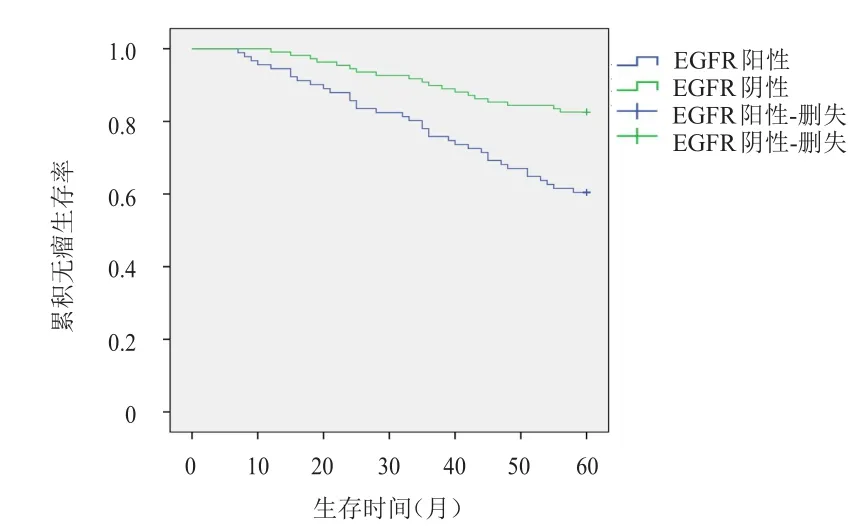
图2 EGFR阳性表达(n=91)及阴性表达(n=109)TNBC患者的无瘤生存曲线
3 讨论
目前,基于分子水平的研究可使人类肿瘤被重新分类为多种亚型,不同亚型在疾病进展和对治疗的反应方面不同。TNBC是乳腺癌的一种特殊亚型,其对许多治疗方法均具有抗性,由于缺乏有效的治疗选择,研究人员一直在探索与TNBC细胞增殖有关的分子途径,阐明其分子机制,从而帮助改善预后。
MAPK信号转导通路是TNBC关键的信号转导途径之一[5-6]。乳腺癌患者较短的生存时间与升高的MAPK活性相关,而EGFR过度表达或持续激活可活化MAPK[7]。在TNBC的进展过程中,EGFR通过与配体结合的方式形成同源或异源二聚体,然后激活磷脂酰肌醇3-羟激酶/蛋白激酶B(phosphatidylinositol 3-hydroxy kinase/protein kinase B,PI3K/PKB,又称PI3K/AKT)、MAPK/ERK等多条信号转导通路,起到促进肿瘤细胞增殖、侵袭、转移等作用[8]。本研究中MAPK及EGFR在TNBC组织中的阳性表达率分别为39.5%与45.5%,与国内研究报道相似[9],通过相关性分析,结果显示MAPK与EGFR的表达呈正相关(r=0.494,P<0.01),提示二者在TNBC的发生发展过程中可能存在协同作用。
研究显示,MAPK及EGFR高表达的患者易出现早期复发转移,预后也较差[10-12]。但也有不同结论者,国内外有研究显示MAPK阳性表达与患者淋巴结转移情况无关[2,9],而本研究结果显示MAPK及EGFR阳性表达不仅与TNBC患者的淋巴结转移有关,也与患者的临床分期有关,TNBC患者淋巴结转移和临床分期是判断预后的重要依据,并可为临床治疗方案的选择提供一定参考。MAPK及EGFR可作为TNBC分子靶向治疗新的尝试方向,应考虑针对TNBC患者的不同MAPK及EGFR表达状态,而采取不同的个体化治疗,进一步改善患者的预后。
随访结果显示,MAPK及EGFR的表达均与患者复发转移有关,复发转移患者MAPK及EGFR的阳性表达率均明显高于无复发转移患者,差异均有统计学意义(P<0.01)。在无瘤生存率方面,MAPK及EGFR阳性表达患者预后较阴性表达患者差,无瘤生存率更低。这与国外报道一致[13-14],说明了MAPK及EGFR在TNBC的发生发展过程中起到了一定作用,有可能成为TNBC患者生存情况的预测指标和治疗新靶点。可通过调控MAPK通路抑制TNBC细胞的生长,而达到治疗目的[15-16]。
本研究为回顾性研究,且样本量较小,建议扩大样本量深入分析,以期获得两分子指标的临床指导价值。总之,MAPK及EGFR蛋白的过表达及活化,在TNBC的发生发展过程中发挥了一定作用,可考虑作为TNBC基因治疗的新靶点。

