BRAFV600E基因突变与甲状腺微小乳头状癌临床病理特征的相关性
禹 乐,朱启淦,温路生,魁国菊,杨立民,孟加榕,陈淑敏
(1联勤保障部队第909医院,厦门大学附属东南医院病理科,漳州 363000;2漳州卫生职业学院病理学教研室;*通讯作者,E-mail:1274801787@qq.com)
甲状腺癌是内分泌系统最为常见的一类恶性肿瘤,甲状腺乳头状癌(papillary thyroid carcinoma,PTC)是其最常见的病理类型,约占80%-90%。近年来随着高频彩超的广泛应用,肿块直径≤10 mm的甲状腺微小乳头状癌(papillary thyroid microcarcinoma,PTMC)检出率呈明显的增长趋势[1]。以往认为PTMC的生物学行为较温和,死亡率较低,但早期仍可见淋巴结转移,使初次手术的方式和术后的治疗存在争议。鼠类肉瘤滤过性毒菌致癌同源体B1(V-raf murine sarcoma viral oncogene homolog B1,BRAF)基因突变是甲状腺癌中最常见的遗传学事件,BRAFV600E基因突变与PTC的高侵袭性密切相关[2,3],但对于原发灶很小的PTMC的报道相对较少。本研究旨在探讨BRAFV600E基因突变情况与PTMC临床病理特征的相关性,为PTMC患者的临床管理和预后提供依据。
1 资料与方法
1.1 研究对象
选取2012-01~2018-12期间在联勤保障部队第909医院收治的临床资料完整的PTMC手术患者作为研究对象,所有患者均符合无甲状腺病史和甲状腺相关药物服用史,接受患侧甲状腺叶全切、峡部切除或全甲状腺切除术,并行预防性患侧中央区淋巴结清扫;所选病例的术后标本均由两名高年资病理医生诊断,疑难病例由多名病理诊断医生共同讨论后诊断,最终收集符合标准病例共173例。患者的肿瘤分期采用美国癌症联合会(AJCC)2017年第8版本的TNM分期标准。
1.2 主要试剂和仪器
石蜡切片(FFPE)核酸提取试剂盒、人类BRAF基因V600E突变检测试剂盒(荧光PCR)均购于厦门艾德生物医药科技股份有限公司,主要仪器是美国ABI7500实时荧光定量PCR仪。
1.3 DNA提取与检测
取7-8 μm厚的石蜡切片1-5片至1.5 ml离心管中,组织样本的DNA提取按照石蜡切片核酸提取试剂盒提供的说明书进行操作,应用紫外分光光度计对提取DNA的样本的浓度与质量,浓度大于2 ng/μl,OD260/OD280比值范围在1.6-2.2之间,OD260/OD230比值大于1.6为合格DNA样本。
1.4 检测原理
本实验所用试剂盒是基于突变扩增阻滞系统(Amplification Refractory Mutation System, ARMS)和荧光PCR技术来实现样本DNA中BRAFV600E基因突变的检测。其原理是针对BRAFV600E基因突变位点设计特异的突变检测引物,在PCR扩增时,由于该引物3′末端的碱基与突变型模板完全配对,引物延伸并扩增出突变模板,而与野生型模板由于不能完全配对,引物的延伸被阻断,野生型模板扩增被抑制,扩增的同时利用FAM标记的双环探针荧光探针对扩增产物进行实时检测,从而实现BRAFV600E基因突变的检测。
1.5 检测主要步骤
取出检测试剂置于室温中平衡10 min,待其完全融化后短暂离心,并置于冰盒上,取35 μl反应混合液加入到PCR反应管中,依次加入0.4 μl Taq酶、5 μl稀释为2 ng/μl的待检DNA样品,用同样的方法建立阴性、阳性对照,离心PCR反应管,使所加的试剂聚集到反应管的底部,最后将PCR反应管置于ABI7500实时荧光定量PCR仪中反应;循环条件为95 ℃ 5 min,1个循环;95 ℃ 25 s,64 ℃ 20 s,72 ℃ 20 s,15个循环;93 ℃ 25 s,60 ℃ 35 s,72 ℃ 20 s,31个循环;收集信号,观察曲线,对检测结果进行判读。
1.6 统计学方法

2 结果
2.1 临床病理特征
本研究173例PTMC患者中,男性17例(9.8%),女性156例(90.2%),年龄在17-71岁之间,平均(44.5±10.1)岁,其中≥45岁的93例(53.8%),<45岁的80例(46.2%);肿瘤直径为0.15-1.0 cm,平均直径为(0.65±0.21)cm,其中肿瘤直径0.5-1.0 cm为119例(68.8%),肿瘤直径<0.5 cm的54例(31.2%);肿瘤出现腺外侵犯7例(4.0%),未出现肿瘤腺外侵犯166例(96.0%);发生淋巴结转移48例(27.7%),未出现淋巴结转移125例(72.3%);肿瘤分期为T1期166例(96.0%),T3期为7例(4.0%)。
2.2 BRAFV600E基因突变在PTMC中的突变情况
173例PTMC患者样本中发生BRAFV600E基因突变为104例,突变率为60.12%;野生型为69例(检测扩增曲线见图1)。

A.突变型样本扩增曲线 B.野生型样本扩增曲线图1 BRAFV600E基因突变检测扩增曲线Figure 1 Amplification curve of BRAFV600E gene mutation detection
2.3 BRAFV600E基因突变与PTMC临床病理特征的相关性
统计本组研究结果显示:BRAFV600E基因突变与PTMC患者的性别、年龄、多发病灶、甲状腺腺外侵及、是否伴随钙化、肿瘤分期等临床病理特征均无相关性(P>0.05);与患者的肿瘤直径大小、淋巴结转移呈正相关(均P<0.05,见表1)。
表1 BRAFV600E基因突变与PTMC患者临床病理特征的关系(例)
Table 1 Relationship between BRAFV600Egene mutation and clinicopathological characteristics of PTMC patients(cases)
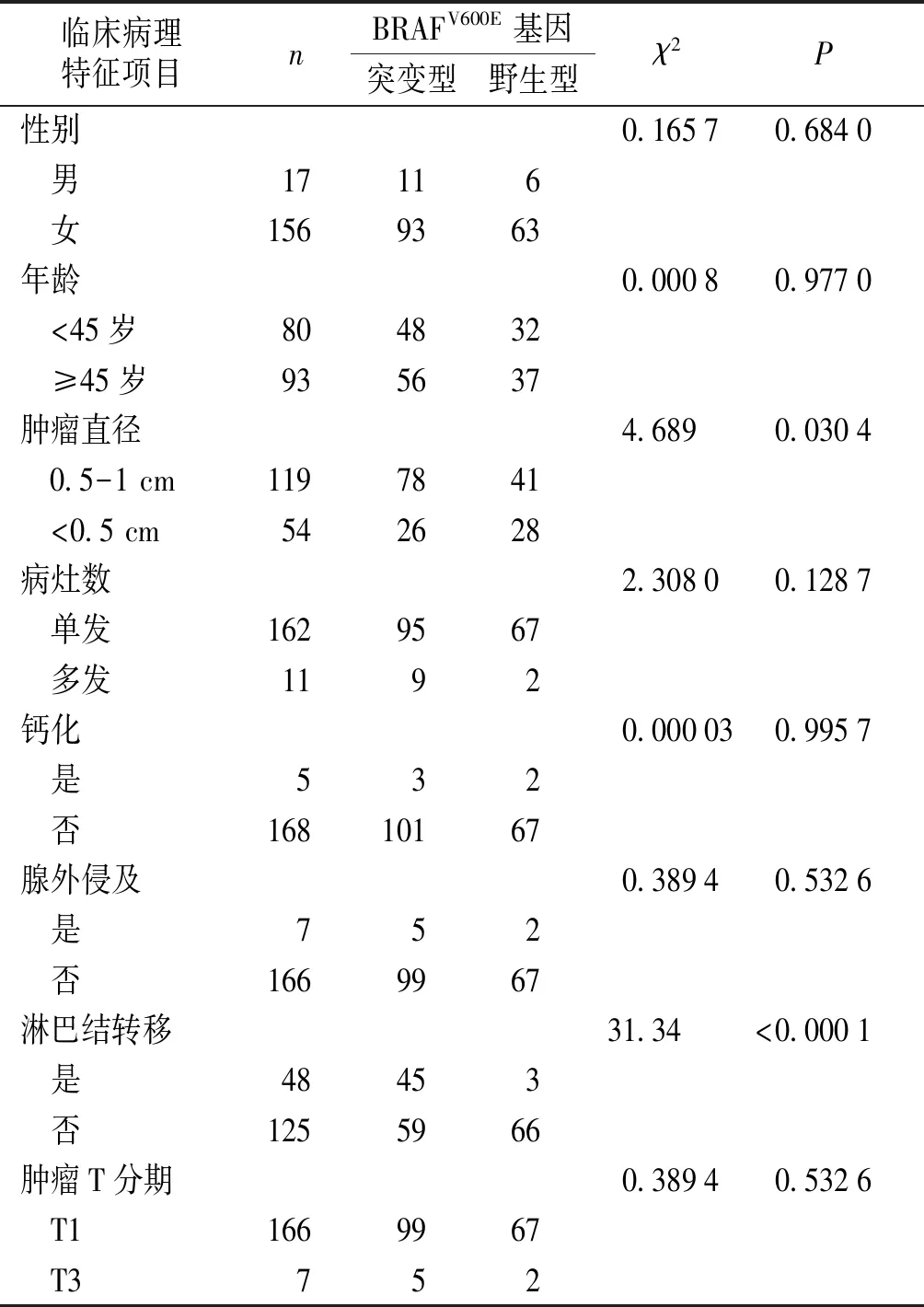
临床病理特征项目nBRAFV600E基因突变型野生型χ2P性别0.16570.6840 男17116 女1569363年龄0.00080.9770 <45岁804832 ≥45岁935637肿瘤直径4.6890.0304 0.5-1 cm1197841 <0.5 cm542628病灶数2.30800.1287 单发1629567 多发1192钙化0.000030.9957 是532 否16810167腺外侵及0.38940.5326 是752 否1669967淋巴结转移31.34<0.0001 是48453 否1255966肿瘤T分期0.38940.5326 T11669967 T3752
3 讨论
BRAF基因属于RAF家族成员,位于人染色体的7q34,含有18个外显子,编码蛋白质的相对分子质量约为94 kD,包含783个氨基酸残基,属于丝氨酸/苏氨酸特异性激酶,是一种高效的磷酸化剂,是RAS/RAF/MEK/ERK/MAPK信号传导通路最为关键的激活因子,参与调控细胞内多种生物学事件,如细胞生长、分化和凋亡等[4]。BRAF基因最常见的突变是发生在15外显子上第1 799位核苷酸胸腺嘧啶转化为腺嘌呤(T1799A),引起BRAF蛋白第600位密码子的缬氨酸被谷氨酸替代,从而导致BRAF激酶激活向MAPK信号通路下游持续传递有丝分裂信号,造成细胞过度增殖、分化及肿瘤的形成和持续生长[5]。近几年随着对PTC的分子发病机制研究发现,BRAFV600E基因突变是其最常见的基因变化,目前认为BRAFV600E基因突变与PTC的发生、发展密切相关,已成为了解PTC患者预后一种重要途径。
近年来随着高频彩超的广泛应用,PTMC的检出率呈明显的增长趋势,2014年WHO公布的全球癌症报告指出,甲状腺癌新发病例中PTMC已经超过50%,虽然大多数PTMC肿瘤的生物学行为倾向于良性,处于低危状态,预后良好,但是部分PTMC具有高侵袭性的临床病理特点,可出现原发灶很小就有淋巴结转移,甚至全身多发转移[6]。目前对于PTMC风险评估的关键指标包括高龄、男性、较大肿瘤直径、腺外侵及、局部淋巴结转移、远处转移和高级别的病理分期,但这些大多是以术后病理学检查结果和回顾性研究为主,对术前评估及术中指导价值有限。现阶段PTMC的治疗方式主要是手术,预防性中央区淋巴结清扫术(central lymph node dissection CLND)作为最常用的手术方式,预防性CLND虽然可清扫亚临床转移病灶,但同时也扩大了手术范围,增加了甲状旁腺喉返神经损伤和出血的风险,临床上对于淋巴结转移阴性的PTMC患者手术治疗时是否同期行预防性CLND仍存在较大争议,如何进行中央区淋巴结转移的术前风险评估成为临床急需解决的问题。
现有研究结果显示[7-10],在PTC患者中BRAFV600E突变型比野生型的复发率更高,BRAFV600E突变与肿瘤侵袭性特征呈正相关,BRAFV600E基因突变可以用于评估PCT的危险程度,在PTC患者中BRAFV600E基因突变率约为29%-88%,而在PTMC患者中BRAFV600E基因突变率则略低一些,约为15%-65.1%,本研究173例PTMC患者中发生BRAFV600E基因突变的为104例,突变率为61.12%,与现有报告数据较一致。多数研究表明BRAFV600E基因突变与PTC患者的肿瘤大小、腺外侵犯、淋巴结转移及肿瘤疾病分期等多项临床病理特征相关[11,12],而目前关于BRAFV600E基因突变与PTMC患者的临床病理学特征之间关系的相关报道还是相对较少,得出的结论也不尽相同,甚至有部分报道在某些结论上仍存在较大的争议,尚未达成统一。本研究结果显示BRAFV600E基因突变与PTMC患者的性别、年龄、多发病灶、甲状腺腺外侵及、是否伴随钙化、肿瘤分期等临床病理特征均无相关性(均P>0.05),这些差别可能与研究对象纳入标准、样本例数、统计标准等各种因素有关。
Liu等[13]认为肿瘤直径≥0.5 cm时,BRAFV600E基因突变率和淋巴结转移的发生率更高,对于发生淋巴结转移的PTMC患者BRAFV600E突变是独立的危险因素,但肿瘤直径≤5 mm者未见明确相关性。在本组研究中,肿瘤直径>0.5 cm组BRAFV600E突变率为65.5%,明显高于≤0.5 cm组的48.1%,差异有统计学意义(P<0.05),显示肿瘤直径越大其BRAFV600E基因突变率越高;在发生淋巴结转移的48例患者中出现BRAFV600E突变的为45例,突变率高达93.8%,而在无淋巴结转移的125例患者中,BRAFV600E基因发生突变的为59例,突变率为47.2%,发生淋巴结转移患者的BRAFV600E基因突变率明显高于未突变者,差异有统计学意义(P<0.05),表明发生BRAFV600E突变的肿瘤细胞可能更具有侵袭性,更容易从原发灶转移到淋巴结或其他地方,BRAFV600E突变可能是导致PTMC早期发生淋巴结转移一大重要因素。Zheng等[14]和Czarniecka等[15]的报道在得到了相似结论的同时,进一步提出了BRAFV600E突变可以当做PTMC患者淋巴结发生转移的独立危险因素的观点。Lang等[16]和Lee等[17]学者认为术前分析BRAFV600E基因突变情况可为不必要的预防性CLND提供依据,BRAFV600E基因存在突变的患者则建议执行预防性中央区淋巴结清扫术。
综上所述,本研究结果显示BRAFV600E基因突变与PTMC患者的性别、年龄、多发病灶、甲状腺腺外侵及、是否伴随钙化、肿瘤分期等临床病理特征均无相关性,与肿瘤大小和淋巴结转移呈正相关,BRAFV600E基因突变与PTMC侵袭性的生物学行为有一定的相关性,可为术前手术选择和预后提供一定的参考价值。但BRAFV600E基因突变能否作为PTMC淋巴结转移风险与复发的独立预测因子仍需进一步深入研究。

