转化生长因子β1对宫颈癌Siha细胞microRNA表达谱的影响
甘 露,刘晓英,王雯智,魏 荣
(1陕西省人民医院,西安交通大学第三附属医院妇科,西安 710068;2陕西省榆林市第二医院妇产科)
在我国,宫颈癌是妇科第二大肿瘤,浸润和转移是导致患者死亡的主要因素[1]。因此探讨宫颈癌浸润转移的机制具有十分重要的临床意义。TGF-β1是转化生长因子β(transforming growth factor β,TGFβ)超家族成员之一,既往研究表明TGF-β1能够促进宫颈癌的浸润和转移[2,3]。越来越多的研究表明TGF-β1与miRNAs相互影响、共同致病[4,5]。但是,TGF-β1对宫颈癌Siha细胞miRNA的调控作用国内外尚未见文献报道。本研究利用miRNA芯片技术,检测TGF-β1作用后宫颈癌Siha细胞miRNA的差异表达,从miRNAs水平探讨TGF-β1促进宫颈癌细胞浸润转移的分子机制,为宫颈癌的临床靶向治疗提供可靠的实验依据。
1 材料和方法
1.1 一般材料
宫颈癌Siha细胞由空军军医大学药物基因组学教研室馈赠。细胞置于含10%胎牛血清的RPMI1640培养基中,于37 ℃、5%CO2条件下培养。
1.2 方法
1.2.1 主要仪器和试剂 Trizol试剂(美国Invitrogen公司);TGF-β1,胎牛血清,RPMI1640培养基(美国Gibco公司);反转录试剂盒(美国Promega);miRNA芯片(美国Affymetrix公司);荧光定量PCR试剂盒(日本TOYOBO);ABI Prism 7500荧光定量PCR仪(美国ABI公司)。
1.2.2 实验方法 实验分为两组:TGF-β1干预组和对照组。待宫颈癌Siha细胞长至70%融合度时,干预组加入10 ng/ml的TGF-β1,继续培养48 h然后进行下一步基因芯片筛选。对照组不予以TGF-β1处理,继续常规培养48 h然后进行下一步基因芯片筛选。

1.2.4 qRT-PCR验证芯片结果 选择其中差异倍数大的miRNA进行qRT-PCR验证。Trizol抽提细胞总RNA,总RNA质检合格后,按试剂盒说明进行逆转录。PCR引物序列见表1。
表1 PCR引物序列
Table 1 Primer sequences of PCR

miRNA 序列 hsa-miR-494-3p-F5′-GCAGCCCAAAAGAACTTCAC-3′hsa-miR-378a-5p-F5′-CTCCTGACTCCAGGTCCTGTG-3′miRNA-R5′-CTCAACTGGTGTCGTGGA-3′U6-F5′-CTCGCTTCGGCAGCACA-3′U6-R5′-AACGCTTCACGAATTTGCGT-3′
PCR反应条件为95 ℃ 5 min,[95 ℃ 15 s,60 ℃ 15 s,72 ℃ 32 s]共40个循环。ΔCt干预组=Ct干预组-CtU6干预组,ΔCt对照组=Ct对照组-CtU6对照组,ΔΔCt=ΔCt干预组-ΔCt对照组,miRNA的相对表达水平用2-ΔΔCt形式表示,每个样本重复3次。
1.2.5 生物信息学分析 运用Target Scan软件预测差异表达miRNA的靶基因。
1.3 统计学分析
运用SPSS17.0统计软件进行数据统计。两组间比较采用配对t检验,P<0.05为差异有统计学意义。
2 结果
2.1 miRNA芯片结果初步筛选芯片结果
初步筛选TGF-β1处理48 h差异表达的miRNA,见图1。筛选原则为:FDR控制在5%内,差异倍数为2倍以上。miRNAs的表达谱存在39个相同的差异表达miRNA,其中27个表达上调,12个表达下调(见表2,3)。

图1 TGF-β1处理宫颈癌Siha细胞48 h miRNA芯片扫描图Figure 1 The miRNA chip scan of Siha cells after treatment of TGF-β1 for 48 h
表2 TGF-β1处理宫颈癌Siha细胞48 h表达上调的miRNAs
Table 2 Up-regulated miRNAs of Siha cells after treatment with TGF-β1 for 48 h

序号名称 倍数1hsa-let-7f-5p3.19712hsa-miR-21-5p3.26053hsa-miR-29b-1-5p2.7514hsa-miR-196a-5p2.58845hsa-miR-183-5p2.70686hsa-miR-203a2.51647hsa-let-7g-5p2.70488hsa-miR-128-3p2.43449hsa-miR-140-5p2.210610hsa-miR-125a-3p3.283911hsa-miR-365a-5p2.369712hsa-let-7d-3p2.568613hsa-miR-196b-5p2.105714hsa-miR-494-3p5.639215hsa-miR-181d-5p3.156516hsa-miR-519c-5p2.907117hsa-miR-519b-5p2.907118hsa-miR-523-5p2.907119hsa-miR-518e-5p2.907120hsa-miR-522-5p2.907121hsa-miR-519a-5p2.907122hsa-miR-1229-5p5.035823hsa-miR-12902.441824hsa-miR-12463.031425hsa-miR-42864.555726hsa-miR-3613-5p4.738327hsa-miR-23c2.2014
表3 TGF-β1处理宫颈癌Siha细胞48 h表达下调的miRNAs
Table 3 Down-regulated miRNAs of Siha cells after treatment with TGF-β1 for 48 h
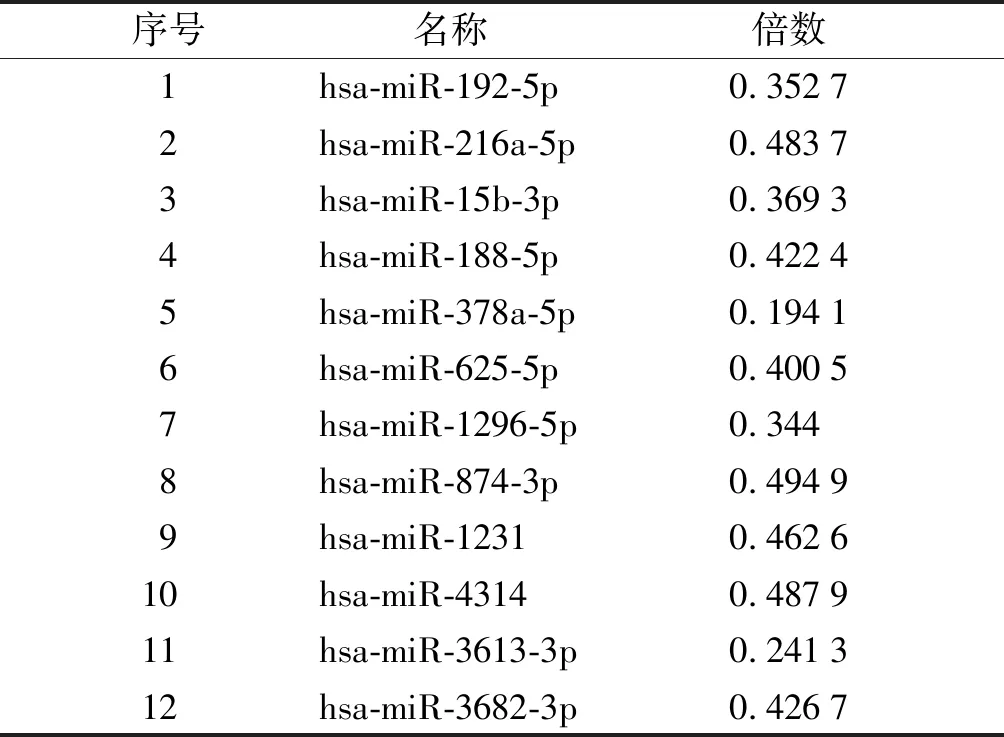
序号名称 倍数1hsa-miR-192-5p0.35272hsa-miR-216a-5p0.48373hsa-miR-15b-3p0.36934hsa-miR-188-5p0.42245hsa-miR-378a-5p0.19416hsa-miR-625-5p0.40057hsa-miR-1296-5p0.3448hsa-miR-874-3p0.49499hsa-miR-12310.462610hsa-miR-43140.487911hsa-miR-3613-3p0.241312hsa-miR-3682-3p0.4267
2.2 qRT-PCR验证TGF-β1处理宫颈癌Siha细胞miR-494-3p及miR-378a-5p的表达
TGF-β1作用48 h后宫颈癌Siha细胞miR-494-3p的表达显著增加(t=15.88,P=0.003 9);TGF-β1作用48 h后宫颈癌Siha细胞miR-378a-5p的表达显著降低(t=19.50,P=0.002 6,见图2)。
2.3 miR-494-3p及miR-378a-5p靶基因预测
通过Target Scan软件预测miR-494-3p及miR-378a-5p可以调控众多的靶基因,其中还含有共同的靶基因,如结肠腺瘤性息肉病基因(adenomatous polyposis coli, APC)、缺氧诱导因子-1A(hypoxia inducible factor-1A, HIF1A)等,见表4。

与对照组比较,**P<0.01图2 TGF-β1处理宫颈癌Siha细胞miR-494-3p/miR-378a-5p的差异表达Figure 2 Differential expression of miR-494-3p/miR-378a-5p in Siha cell treated by TGF-β1
表4 miR-494-3p及miR-378a-5p靶基因预测
Table 4 Target gene prediction of miR-494-3p and miR-378a-5p

名称靶基因 miR-494-3pPTEN,TNFRSF9,CADM1,IRS1,CDK4,IGF1R,IGF1,IRAK3,SAMD1,HIF1A,APC,FUT8,SIRT1,等miR-378a-5pFSHR,E2F3,EZH2,APC,MMP15,TLR5,HIF1A,IL6R,IRF1,BCL2,ESR1,GHR,SMAD3,EGFR,TEF等
下划线表示共同调控的基因
3 讨论
浸润和转移是导致宫颈癌患者死亡的主要因素,因此研究宫颈癌的转移机制、探索防治宫颈癌转移的方法,具有重大的临床意义。既往研究发现TGF-β1处理后宫颈癌Siha细胞具有强的浸润和转移能力[6,7]。
miRNA是一类非编码小RNA,大量研究发现其有望用作肿瘤和其他疾病的分子靶向治疗的新分子靶标。本文采用miRNA芯片技术检测TGF-β1处理前后宫颈癌Siha细胞miRNA表达谱的变化,共发现39个差异表达的miRNA,其中27个表达上调,12个表达下调。选择其中差异倍数大的2个miRNA(hsa-miR-494-3p,hsa-miR-378a-5p)进行实时荧光定量RT-PCR验证,结果与芯片结果一致。这些结果表明差异miRNA的改变由TGF-β1刺激所导致,而且可能经由TGF-β信号通路实现。
通过生物信息学预测miR-494-3p及miR-378a-5p可以调控众多的靶基因,其中还含有共同的靶基因,如结肠腺瘤性息肉病基因(adenomatous polyposis coli, APC)、缺氧诱导因子-1A(hypoxia inducible factor-1A, HIF1A)等。
miR-494在不同类型的肿瘤中的作用不同。miR-494在结直肠癌组织中明显上调,而这一增加与APC表达呈负相关。APC被证实是结直肠癌中miR-494的直接靶点。此外,过表达miR-494促进结直肠癌细胞生长[8]。在A549肺癌细胞中,miR-494-3p的过表达促进了肿瘤的形成,增强了肿瘤细胞的活力,增加了干细胞相关基因的表达[9]。miR-494可通过直接靶向TET1抑制基因组DNA的去甲基化,从而触发多种侵袭抑制基因沉默,最终导致肿瘤血管的侵袭[10]。但在软骨肉瘤中,miR-494的作用则相反,它通过直接靶向SOX9抑制体内和体外软骨肉瘤细胞的增殖和侵袭[11]。
在乳腺癌组织中miR-378a-3p的表达水平较低,并与患者预后不良有关。miR-378a-3p通过靶向高尔基体转运蛋白1A调节乳腺癌MCF-7细胞的三苯氧胺敏感性[12]。miR-378的降低促进非小细胞肺癌的进展和血管生成[13]。miR-378a-3p可能作为肿瘤抑制因子在横纹肌肉瘤中发挥作用,其表达的恢复在横纹肌肉瘤中具有治疗作用[14]。最新的研究发现,miR-378a-3p可能作为肿瘤抑制因子,与肾癌患者的预后相关,高表达miR-378a-3p的患者生存期会增加[15]。但在宫颈癌中miR-494-3p及miR-378a-5p未见相关报道。
我们推测这些差异表达的miRNAs参与宫颈癌细胞的侵袭和转移过程,具体机制尚需进一步研究。

