乳腺癌脊柱寡转移的体部立体定向放射治疗
石 薇 ,俞晓立
复旦大学附属肿瘤医院放疗科,复旦大学上海医学院肿瘤学系,上海 200032
骨转移是乳腺癌最常见的远处转移部位,在26%~50%的乳腺癌患者中骨及附件为首发转移发生部位,在晚期乳腺癌中骨转移发生率高达65%~75%[1-3]。脊柱是乳腺癌骨转移最常发生的部位,约占所有骨转移病例的60%[4]。乳腺癌伴发的脊柱转移多以溶骨性改变为主,常导致骨相关事件(skeletal-related events,SRE)的发生[5],严重影响患者的生存质量。其治疗以多学科参与的综合治疗为主,包括放疗、化疗、内分泌治疗及骨修复剂治疗等[3,6-7]。放疗是脊柱转移局部治疗的重要手段,在缓解疼痛、恢复功能及减少骨折等并发症的发生上发挥着重要作用[3,8-11]。本文将回顾体部立体定向放射治疗(stereotactic body radiation therapy,SBRT)乳腺癌及其他肿瘤脊柱转移的相关研究。
1 “寡转移”及其治疗
Hellman等[12]在1995年提出了肿瘤“寡转移”的概念,2011又进一步进行了阐述[13]。“寡转移”被认为是肿瘤介于局限于原发病灶和发生广泛的远处转移两种状态之间的一种中间状态,其特点是肿瘤具有较低的转移能力,转移灶的数量和部位有限。对于“寡转移”状态是否真正存在及其诊断标准,现在尚无定论。现阶段,“寡转移”一般定义为少于3~5个转移病灶,累及少于2个不同的器官系统[13-14]。
对“寡转移”病灶进行积极的局部治疗(根治性手术和SBRT),在部分患者中可很好地控制转移病灶,甚至治愈疾病。有研究报道,手术切除“寡转移”病灶,例如直肠癌的肝脏转移病灶[15-18],多种肿瘤的肺转移灶[19],肺癌的肾上腺转移[20],治愈了部分患者。现阶段,对于SBRT,尚缺乏高质量的证据支持其可以延长“寡转移”患者的总生存(overall survival,OS)及无进展生存期(progression-free survival,PFS),数项临床随机对照研究仍在进行中,结果报道有限[21]。已有的报道包括最近发表的SBRT-COMET这项临床Ⅱ期研究,该研究报道了在标准的姑息治疗基础上加入SBRT可以延长“寡转移”患者(5个转移灶)的OS[21]。此外,对于非小细胞肺癌,已有两项临床Ⅱ期研究报道提示,SBRT[22-23]或手术[23],与单用维持治疗相比,可以延长PFS。
对于乳腺癌“寡转移”,Yoo等[24]于2015年回顾性分析了50例乳腺癌复发“寡转移”患者(小于5个颅外转移灶)接受SBRT治疗,中位放疗剂量为30 Gy(20~60 Gy)。所有50例患者均有骨转移,7例患者有肺转移、肝转移或淋巴结转移。5年的肿瘤局部控制(local control,LC)和3年的无远处进展生存(distant progressionfree survival,DPFS)分别为66.1%和36.8%。放疗总剂量(≥50 Gy)增加可提高LC,5年的OS为49%。激素受体阳性,原发肿瘤的淋巴结转移少,单发骨转移,放疗范围充分包全病灶均与更好的生存相关。同时,有研究提示手术切除乳腺癌的“寡转移”病灶(如肺、肝、胸骨、胸壁)能够提高生存率甚至获得长期的治愈[25-27]。
基于局部根治性治疗(SBRT和根治性手术)对乳腺癌“寡转移”的潜在治疗作用,NRG发起了NRG-BR002(NCT02364557)这项临床Ⅱ/Ⅲ期研究,旨在探讨局部根治性治疗对PFS和OS的影响,预计2022年完成患者入组[28]。此外,探讨SBRT在乳腺癌“寡转移”中的价值的临床研究还包括巴黎古斯塔夫·鲁西癌症研究所发起的STEREO-SEIN(NCT02089100)这项多中心Ⅲ期临床研究[29]。
现有的研究提示在转移性乳腺癌中,与其他恶性肿瘤相比,乳腺癌(尤其是分子分型较好的类型)在骨转移发生后仍然可能有较长的生存 期[5,30],在原发病灶或全身疾病控制的前提下,或可考虑积极治疗脊柱寡转移灶。
2 脊柱“寡转移”的治疗
对于脊柱转移肿瘤,Barzilai等[31]报道的来自AOSpine多中心前瞻性列队研究EPOSO提示,“寡转移”患者(定义为≤5个转移灶)比“多发转移”(>5个转移灶)具有生存优势。对于预后较好的脊柱“寡转移”患者,局部治疗(放疗和手术)的策略应该更为积极。
随着放疗技术的进展,放疗的作用不仅局限于姑息止痛,还可以是根治的手段。SBRT被越来越多地应用于临床实践,其不仅是姑息止痛,更多时候是根治的手段。SBRT又称立体定向消融放疗(stereotactic ablative radiotherapy,SABR),美国放射治疗及肿瘤学会(American Society for Therapeutic Radiology Oncology,ASTRO)将其定义为精准地给予颅外病灶的高剂量的外照射。其特点包括:较少的放疗次数(一般不超过5次),高定位精度,快速剂量跌落梯度和最大正常组织保护[32]。SBRT的放射生物学优势在于单次放疗剂量提高带来的更大的细胞杀伤效应,使用有限的放疗次数可以减少在更长放疗疗程中肿瘤加速增殖所带来的负面影响。值得注意的是SBRT很适用于对传统分割放疗抵抗的肿瘤类型,对于这类肿瘤(如肾细胞癌、肉瘤等),SBRT仍然可以获得良好的LC,或与高剂量照射的细胞杀伤性提高有关[33-38]。
在手术方面,较有代表性的手术方式是全脊椎整块切除术(total en bloc spondylectomy,TES),由Tomita等[39-42]报道,TES通过将包括椎体和椎板在内的整个脊椎进行切除从而达到对脊柱转移癌的整块切除。尤其适用于原发病灶控制的预计生存期较长(>6个月)的“寡转移”患者。文献报道的TES的LC为80%~ 100%[39,43-53]。TES难度较大,具有较高的手术并发症发生率,对手术医师的要求很高。TES主要风险为:① 失血过多;② 脊柱切除过程中损害主要血管;③ 脊髓损伤;④ 潜在的肿瘤细胞污染,特别是在椎弓根处的病灶内切除;⑤ 截骨术后的脊柱的完全不稳定[42]。TES操作难度高,并发症发生率高,但可以同时取得病理学诊断结果。而SBRT具有无创性的优点,但需要注意的是,既往的放疗史或会使得再程SBRT的剂量受到限制而带来不理想的LC。需综合评估患者的情况来确定两种局部根治性治疗手段的可 行性。
3 脊柱转移肿瘤的治疗策略选择
对于脊柱转移肿瘤,目前尚缺乏高级别的证据来指导其局部治疗策略的选择。早在1986年Harrington[54]根据神经受损或骨破坏程度将脊柱转移瘤患者分为5级,并推荐相应的治疗,包括系统治疗、放疗或手术。后又有一系列的治疗决策系统用于指导脊柱转移瘤的局部管理[55-57]。美国纽约斯隆-凯特琳纪念癌症中心的NOMS系统对神经病变(neurologic,低级别或高级别硬膜外脊髓压迫[58]及有无脊髓病)、肿瘤(oncologic,放疗敏感或放疗抵抗及先前接受过放疗)、机械力学(mechanical,是否稳 定[59])以及系统情况(systemic,能否耐受手术)进行评估,制定脊柱转移瘤患者的最佳局部治疗策略(包括稳定手术、分离手术、传统分割外照射放疗及SBRT)[56]。最近,Spratt等[57]提出了一个多学科的综合算法来指导脊柱转移瘤的管理。与先前的决策系统相比,该算法加入了与患者整体状况和系统疾病控制有关的因素(如系统疾病的负荷、控制情况、系统治疗的选择)来对脊柱转移瘤患者进行分层。需要指出,这些系统都没有列出脊柱转移灶数量对治疗策略选择的影响。
脊柱转移肿瘤的局部治疗主要包括手术和放疗。现有一系列用于分层患者预后的模型,包括对于手术后患者预后分层的Tomita评分系 统[44]、Tokuhashi评分系统(最初版及修正 版)[60-61]以及对于SBRT后患者预后分层的脊柱转移预后指数(prognostic index for spine metastases,PRISM)[62]等。上述预后分层模型对患者的一般情况、原发肿瘤类型、脊柱转移的部位和数量,以及其他转移情况等进行评分,根据预测的预后情况指导治疗策略的选择,采取姑息减症治疗或积极的潜在根治性局部治疗。在患者预后分层的Tomita评分系统[44]、Tokuhashi评分系统(最初版及修正版)[60-61]中,乳腺癌与甲状腺癌,前列腺癌等的脊柱转移被认为是生长较为缓慢的,预后较好的病理学类型。另外,预后分层系统普遍都将孤立的或数目有限的脊柱转移及有限的或可切除的内脏转移列为良好预后 因素。
4 SBRT治疗脊柱转移
放疗在骨转移治疗中的作用不仅局限于姑息止痛,还是潜在的根治手段。在乳腺癌脊柱转移的治疗中的SBRT方案不尽相同,包括24~ 60 Gy/1~5次。脊柱SBRT靶区勾画可参考国际脊柱放射外科联盟的共识指南[63]。
SBRT治疗脊柱寡转移的临床试验的报道有下述几项:放疗方案、LC、毒性等信息见表1,纳入和排除标准见表2。
来自美国M D 安德森癌症中心的C h a n g 等[64-65]先后报道了SBRT治疗脊柱寡转移的临床Ⅰ期和临床Ⅰ/Ⅱ期研究的结果。早期入组的患者,照射剂量多为30 Gy/5次,后期为缩短治疗疗程,照射剂量改为27~30 Gy,通常为3次,隔天1次,2012年报道的研究结果[66],共纳入149例患者,其中15例(10%)为乳腺癌。中位随访15.9个月(1.0~91.6个月),平均20.9个月(疾病稳定为17.1个月),149例患者中的40例(27%)仍然存活,中位OS为SBRT治疗后23个月(95% CI:18.6~27.2),1年和2年的生存率分别为68.5%(95% CI:60.1~75.4)和46.4%(95% CI:37.8~54.7)。41例(28.0%)患者肿瘤出现进展,中位进展时间为13个月(范围<1~101个月)。SBRT治疗后6个月、1年和2年的PFS分别为86.1%(95% CI:79.4~90.7)、80.5%(95% CI:72.9~86.1)和72.4% (95% CI:63.1~79.7)。没有报道4级及以上的毒性以及放疗相关的脊髓病。
2012年美国MD安德森癌症中心的Garg 等[67]发表的一项接受单次分割SBRT的临床Ⅰ/Ⅱ期研究。非肾癌转移患者接受18 Gy/1次的放疗,肾癌转移患者接受24 Gy/1次的放疗,该研究纳入61例患者,其中5例(8%)患者为乳腺癌,所有患者拟治疗的脊柱都未接受过放疗,16例患者过去接受过脊柱手术。平均随访20个月,18个月的影像学LC为88%,OS为64%,所有患者的中位生存期为30.4个月。18个月无神经功能恶化率为82%。没有报道4级以上的毒性。
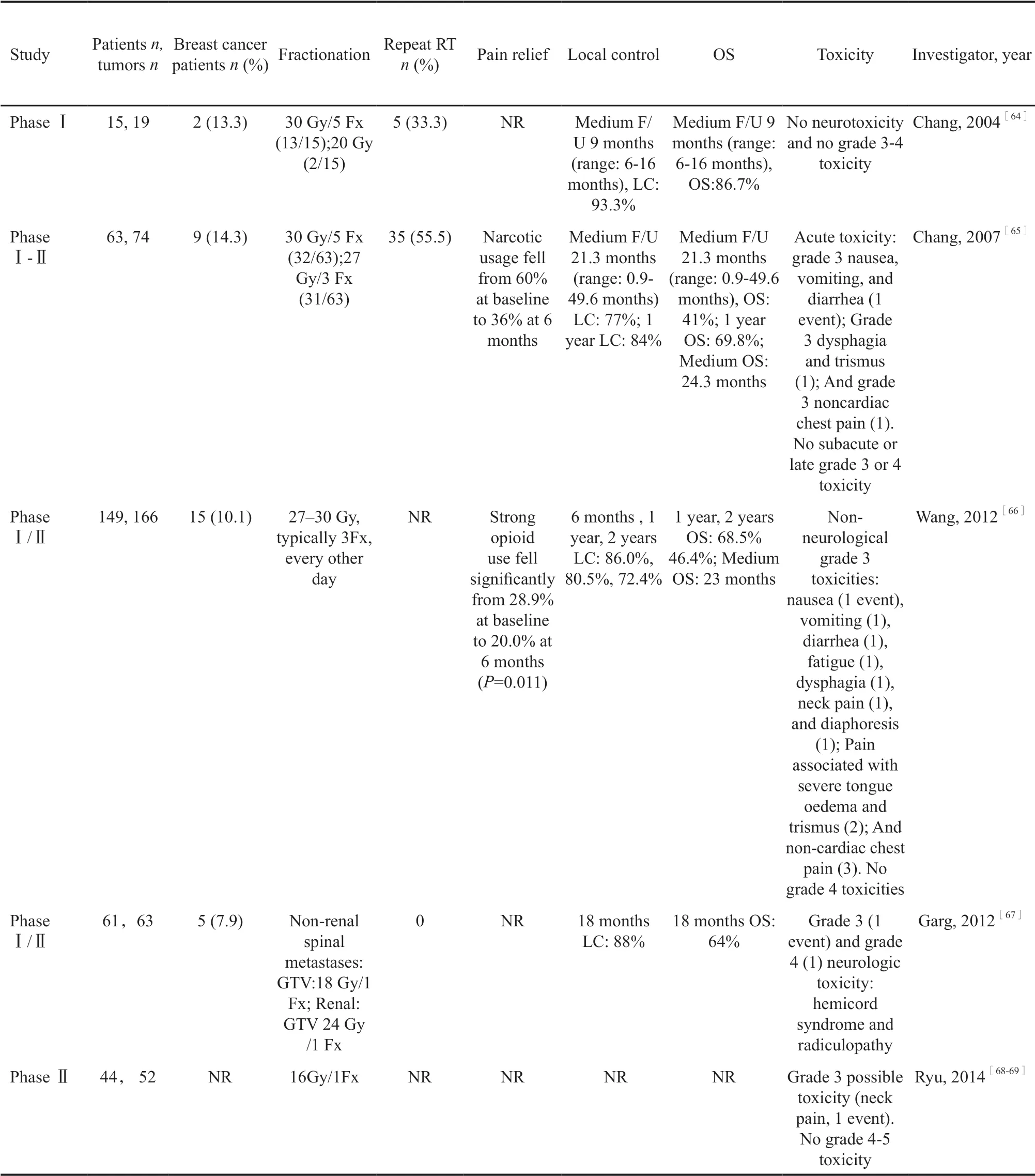
表 1 SBRT治疗脊柱转移肿瘤的Ⅰ/Ⅱ期临床试验Tab. 1 Phase Ⅰ/Ⅱ clinical studies investigating SBRT for spinal metastases

表 2 SBRT治疗脊柱转移肿瘤的Ⅰ/Ⅱ期临床试验的纳入和排除标准Tab. 2 The inclusion and exclusion criteria of phase Ⅰ/Ⅱ clinical studies investigating SBRT for spinal metastases
另一项是RTOG 0631多中心研究[68-69],该研究照射剂量为16 Gy/1次。允许纳入3个不连续脊柱转移病灶的患者,每个病灶可累及两个连续的脊椎。该临床Ⅱ期研究也证实了SBRT在治疗脊柱转移的可行性和精确性。RTOG 0631的Ⅲ期临床试验正在进行,对单次分割SBRT(16 Gy/1次或18 Gy/1次) 与8 Gy/1次的外照射在疼痛缓解、生活质量方面进行比较。
此外,SBRT治疗脊柱寡转移的证据更多来自于回顾性或前瞻性的病例观察,各研究报告的局控率为70%~100%[34-35,70-94],与文献报道的TES的局控率(80%~100%)[39,43-53]相似。Gerszten等[76]2005年报道的前瞻性队列研究,是专门针对乳腺癌脊柱转移的研究,该研究纳入50例乳腺癌脊柱转移患者接受射波刀单次放疗,总共68个病灶。肿瘤的最大放疗剂量为15.0~ 22.5 Gy(平均为19 Gy)。50例患者中的48例以前接受过放疗。在57例因疼痛接受放疗的病灶中的55例(96%)疼痛出现长期缓解。在放疗为主要治疗手段的患者(8例)、影像学进展的患者(1例)和术后辅助放疗的患者(1例)中,肿瘤获得长期的影像学控制。
SBRT优于常规放疗的剂量跌落使得再程放疗的可能性提高[89,92]。同时,多项研究也显示,对传统分割放疗抵抗的肿瘤类型(如肾细胞癌、肉瘤等),使用SBRT仍然可以获得良好的LC,考虑与高剂量照射的细胞杀伤性提高有关[33-38]。脊柱转移病灶的LC受到多种因素的影响,与放疗剂量[33,36,81],脊柱转移病灶的数 量[93],疼痛神经症状[75-76,78,93]及患者一般情况[93]等相关。此外,SBRT治疗脊柱转移的失败模式多为远处转移[33,79,87],提示良好的全身疾病控制对提高生存率至关重要。
现有的SBRT治疗脊柱寡转移的的循证医学证据多来自于Ⅰ/Ⅱ期临床试验及回顾性或前瞻性的病例观察。因此,现阶段SBRT治疗脊柱寡转移仍然处于临床试验探索阶段。仍然需要前瞻性的临床试验进一步探讨SBRT治疗脊柱寡转移的价值、适宜患者及最佳分割模式。
5 SBRT的不良反应
SBRT的急性反应包括皮肤红斑,腰背部放疗带来的胃肠道反应,颈胸部放疗带来的张口困难,吞咽痛,吞咽困难伴局部黏膜炎。上述不良反应多为自限性,通过对症支持治疗后能够恢复。也有接受单次分割SBRT同期化疗的患 者[34]及脊柱转移灶减压分离手术后接受单次分割SBRT的患者[33]出现食管气管瘘的个案报道。治疗靶区内的椎体会接受到照射,但通常不会影响脊柱椎体总体的造血功能。放疗后也有再次出现疼痛者[95],多为自限性的,有时与疾病的复发进展相关[83,93]。
SBRT的晚期反应更需要重视。脊髓是最重要的结构,需要通过精确摆位,图像引导来确保剂量限制。与常规分割相比,SBRT的脊髓周围剂量跌落更陡,并且较小体积的脊髓接受较高照射剂量。尽管相关脊髓毒性的报道较少[72,79,89,96-98],但是鉴于接受SBRT的患者的随访时间较短,患者数较少,还是应该谨慎限制正常组织及危及器官剂量。现有报道的脊髓毒性有相当一部分是发生在再程放疗的患者中,迄今尚无再程放疗脊髓限量的共识。Kirkpatrick等[99]报道,根据动物和人类的研究,每天接受2 Gy常规分割放疗后6个月,脊髓的损伤至少能够恢复25%。
骨放疗后可出现晚期损伤和骨折。骨放疗后发生的骨折很多是无症状的,只在影像学检查时才被发现,所以其真实的发病率未知。另外,SBRT的剂量不是绝对均一,脊柱中易于发生骨折的部位接受的具体剂量不明确。
6 脊柱转移的疗效评估
早期的肿瘤疗效评价标准来自于国际抗癌联盟(Union for International Cancer Control, U ICC)[100]及世界卫生组织(World Healt h Organization,WHO)[101-102],其骨转移的疗效评价标准存在局限性,如只依据X线平片及放射性核素骨显像而未综合CT、MRI来评估[103-104]。而现在较为普遍使用的评价疗效的实体瘤疗效评价标准(response evaluation criteria in solid tumors,RECIST),则认为骨转移病灶为不可测量的病灶,除了具有可辨识的具有软组织成分的溶骨性或溶骨-成骨混合病灶,如软组织成分符合可测量标准(大于1 cm),可用断面影像成像技术如CT或MRI进行评估[105]。鉴于RECIST标准在评估骨转移病灶上的缺失,来自美国MD安德森癌症中心的Hamaoka等[106]于2004年在分析现有评估骨转移治疗效果的影像学方法的基础上,针对仅有骨转移的乳腺癌,提出了美国MD安德森癌症中心标准,该标准采用CT、MRI、X线平片及放射性核素骨显像联合,对骨转移病灶的治疗反应进行评估。2010年,Hamaoka等[104]回顾性地在41例患者上证实了针对仅有骨转移的乳腺癌患者,美国MD安德森癌症中心标准在区分对治疗(化疗和内分泌治疗)有或无反应的患者方面优于WHO标准,这还有待前瞻性研究进一步检验。
对于SBRT治疗后的脊柱转移病灶的评估,由SPINO团队制定的一个疗效评估报告指出现在尚无基于影像学的疗效评价共识标准。该报告推荐采用MRI评估脊柱转移病灶,SBRT治疗后12~18个月内,每2~3个月行MRI评估疗效,以后每3~6个月行MRI评估疗效。疗效评价分为局部控制和局部进展,该报告提到需要考虑到骨转移病灶SBRT治疗后的假进展和坏死,推荐随访影像学以及必要时进行活检来证实。对于SBRT后的疼痛反应的评价,建议SBRT结束后3个月进行评估,推荐使用简明疼痛评估量表(brief pain inventory,BPI),采用国际共识疼痛反应终点(international consensus pain response endpoints,ICPRE)作为疼痛评估的 标准[107]。
7 乳腺癌脊柱寡转移SBRT的治疗总结
综上所述,现阶段尚无高级别的临床证据来指导乳腺癌脊柱转移的治疗策略。首先需要判断原发灶是否控制及每个转移灶是否都有潜在根治的可能性。现阶段,乳腺癌脊柱转移的积极的局部治疗(根治性手术或SBRT)的价值及适宜患者尚在探索中。若评估后, 乳腺癌脊柱转移拟接受根治性治疗,需要确定具体的局部治疗策略。SBRT[34-35,70-94]和TES[39,43-53]显示出相似的、均较良好的肿瘤LC。TES具有操作难度高、并发症发生率高的特点[42],但可以同时取得病理学诊断结果。而SBRT具有无创性的优点,但需要注意的是,既往的放疗史或会限制再程SBRT的剂量或带来不理想的LC。 需要综合评估患者的脊柱的稳定性[59]、肿瘤与脊髓的关系[58]、一般状况(能否耐受手术)、既往放疗史(正常组织限量)等来确定两种局部治疗手段的可行性。

