一株永生化的BRCA1突变型人卵巢表面上皮细胞系的建立及初步分析
任春霞,夏小艾,杨树东,吕 蓓,童国庆
1.上海中医药大学附属曙光医院生殖医学中心,上海 200120;
2.无锡市人民医院妇产科,江苏 无锡 214023;
3.无锡市人民医院病理科,江苏 无锡 214023
上皮性卵巢癌是常见的致命性妇科肿瘤,占恶性卵巢瘤的70%以上,根据其分子特征可分为不同的亚型。高级别浆液癌通常含有TP53突变和(或)BRCA1或BRCA2突变[1];低级别浆液癌常表现为KRAS和BRAF基因的激活和突变[2-3];低级别子宫内膜样癌与β-连环蛋白基因的突变有关[4];黏液癌经常携带KRAS突变[5]。上皮性卵巢癌的一个分子亚型涉及BRCA1的种系突变,包括插入和缺失、移码、碱基替换等突变,这些BRCA1突变在所有上皮性卵巢癌中占10%~15%[6-7];而到70岁时,卵巢癌的患病风险增加到36%~66%[8-9]。BRCA1属于肿瘤抑制基因,与许多其他肿瘤抑制因子一样,BRCA1编码一种控制基因转录、DNA损伤修复、同源重组、染色体稳定性、细胞周期检查点、泛素化和中心体复制的蛋白质[10]。具有BRCA1种系突变的遗传性乳腺癌具有不同于散发性乳腺癌的形态和基因特征[11-12];相反,具有BRCA1种系突变的卵巢癌与散发性乳腺癌难以区分[13-15]。 同样,具有功能性BRCA1或BRCA2的高级别浆液性卵巢癌在组织学上与这些蛋白功能失活的同级别肿瘤难以区分。然而,突变的BRCA1如何导致卵巢癌发生尚不明确。本研究从1例携带BRCA1等位基因185delAG突变的患者身上分离和建立了一株卵巢表面上皮细胞系OSE236,并联合使用p53 shRNA与人端粒酶反转录酶(human telomerase reverse transcriptase,hTERT)催化亚基使其永生化,永生化细胞进一步导入致癌基因HRAS但未获得体内和体外恶性转化。本研究对该系列细胞系进行了BRCA1突变、细胞衰老、细胞周期及其相关蛋白的检测分析,该细胞模型可能对研究遗传性BRCA1突变相关卵巢癌和乳腺癌的发生和诊治具有重要意义。
1 材料和方法
1.1 细胞系构建、培养和质粒
本课题组于2015年为无锡市人民医院收治的1例年龄为41岁的宫颈癌Ⅱb期汉族女性患者实施子宫全切手术,同时获得手术切除的卵巢组织,经过病理学检测为正常组织,组织的使用经过无锡市人民医院伦理委员会批准,并与患者签署组织使用知情同意书。患者经过基因筛查发现携带BRCA1单等位基因185delAG的遗传性突变。我们采用已报道的研究方法[16],从卵巢组织中分离和构建了正常卵巢表面上皮细胞系OSE236。然后使用已发表的技术方 法[17],将靶向p53的shRNA导入OSE236细胞,构建了OSE236/p53i细胞系,继之将hTERT催化亚基导入OSE236/p53i细胞,构建了OSE236/p53i/hTERT细胞系,随后将致癌基因HRAS导入OSE236/p53i/hTERT细胞中,构建了OSE236/p53i/hTERT/HRAS细胞系。p53 shRNA和hTERT cDNA的导入均使用反转录病毒感染的方法介 导[18]。所用质粒p53 shRNA、hTERT和HRAS以及卵巢癌细胞系HEY来自复旦大学附属肿瘤医院杨恭教授课题组,并在相关文献中有描述[17]。卵巢癌细胞系HEY作为以下相关实验的阳性对照。
1.2 细胞增殖测定
用细胞计数法测定每个细胞系中细胞的增殖。将1×104个细胞接种到12孔板中,每孔活细胞每隔1天计数1次,共6次。每株细胞培养3份,实验重复3次。统计3次结果取平均值。
1.3 衰老相关β-半乳糖苷酶(senescenceassociated β-galactosidase,SA-β-gal)染色
SA-β-gal活性染色根据已报道的方法进行[16]。将25%~85%密度培养的细胞用PBS洗涤,并在室温下用固定缓冲液(含2%甲醛和0.2%戊二醛的PBS)固定4 min。然后,在37 ℃的黑暗环境中,用柠檬酸/磷酸盐缓冲液 [0.15 mol/L NaCl、0.02 mol/L MgCl2、1 mg/mL X-gal、0.005 mol/L铁氰化钾和0.001 6 mol/L柠檬酸(pH=6.0)]洗涤细胞并温育2~5 h。细胞质蓝染显示细胞衰老状态。
1.4 细胞系基因组中BRCA1突变位点测序分析
根据已有报道[19]设计和合成PCR引物(购自苏州金唯智生物科技有限公司),利用细胞基因组DNA小提试剂盒[DP304-02,购自天根生化科技(北京)有限公司]提取,PCR反应条件为95 ℃ 4 min,然后94 ℃ 30 s,55 ℃ 45 s, 72 ℃ 1 min,共30个循环,最后72 ℃ 10 min延伸,样品直接送苏州金唯智生物科技有限公司 测序。
1.5 细胞周期测定
将细胞培养至75%的密度,胰酶消化收获、PBS洗涤离心后加入10倍体积的75%乙醇(每个细胞系105个细胞),4 ℃固定细胞48 h以上,然后离心洗涤,再用1%碘化丙啶染色,使用配备CellQuest软件的FACStation(购自美国BD公司)进行分析[18]。
1.6 蛋白质印迹法(Western blot)
利用RIPA缓冲液制备全细胞裂解物[18]。使用Bio-Rad蛋白质分析试剂盒(5000201)测量蛋白质浓度。HRAS(小鼠抗人单克隆抗体,sc-53959)、CDK4(小鼠抗人单克隆抗体,sc-23896)、cyclin B1(小鼠抗人单克隆抗体,sc-7393)、cyclin D1(小鼠抗人单克隆抗体,sc-8396)和cyclin E(小鼠抗人单克隆抗体,sc-248)购自美国Santa Cruz公司。β-肌动蛋白抗体(兔抗人单克隆抗体,#4970)购自美国Cell Signaling Technology公司。BRCA1抗体(鼠抗人单克隆抗体,MAB22101)购自美国R&D System公司。二抗为羊抗兔多克隆(7074S,购自美国Cell Signaling Technology公司)或羊抗鼠多克隆(AS003,购自武汉爱博泰克生物科技有限公司)抗体并偶联了辣根过氧化物酶(HRP)。蛋白条带用辣根过氧化物酶底物偶联的发光液(购自美国Millipore Corporation公司)显色,并用E-Gel成像仪(购自上海天能科技有限公司)曝光。
1.7 软琼脂克隆形成实验
软琼脂实验是测定细胞在体外是否具有转化癌细胞能力的研究技术,本研究参考已发表的方 法[17],在60 mm培养皿中接种5×104个细胞进行软琼脂实验分析。在显微镜下观察和统计含有100个细胞以上的克隆数。卵巢癌细胞系HEY作为阳性对照。实验重复3次,统计3次结果取平 均值。
1.8 BALB/c裸小鼠移植瘤实验
为了检测肿瘤的形成,我们将细胞单次皮下注射于4~6周大的BALB/c雌性裸鼠。动物实验只接种OSE236/p53i/hTERT/HRAS细胞,设计6只小鼠,每只小鼠背部皮下接种1个点,每个点接种5×106个细胞。将小鼠置于无特定病原体环境中,每3 d观察1次可见肿瘤生长情况。记录第1个肉眼可见肿瘤出现的日期,此后每3 d用电子游标卡尺测量1次最大和最小肿瘤直径。卵巢癌细胞系HEY作为阳性对照进行类似接种。肿瘤体积按a(最大直径)×b(最小直径)×0.52的公式计算。对照细胞肿瘤生长最大直径超过2 cm时全部处死本组动物,而OSE236/p53i/hTERT/HRAS细胞接种的动物观察3~5个月。动物实验根据上海中医药大学动物伦理委员会批准的方案进行。
1.9 统计学处理
2 结 果
2.1 p53 shRNA与hTERT联合诱导细胞永生化
卵巢表面上皮细胞OSE326的分离、培养和永生化参见高雯等[16]报道的技术方法。亲代细胞(OSE236)在第10代后显示出进入衰老的迹象,而表达p53 shRNA和hTERT(OSE236/p53i/hTERT)的细胞经过100次传代并没有衰老,细胞用p53 shRNA和hTERT永生化后,SA-β-gal的活性明显降低,因此认为该细胞系在形态学和生理学上已被永生化(图1A~B)。与OSE236和OSE236/p53i细胞相比,永生化OSE236/p53i/hTERT细胞的增殖显著增加(P<0.01),但在将HRAS导入OSE236/p53i/hTERT细胞后,细胞增殖没有明显增加(图1C)。通过细胞基因组DNA测序分析,在OSE236细胞及其衍生细胞系中,证实BRCA1 185delAG突变位于BRCA1外显子2中(图1D)。
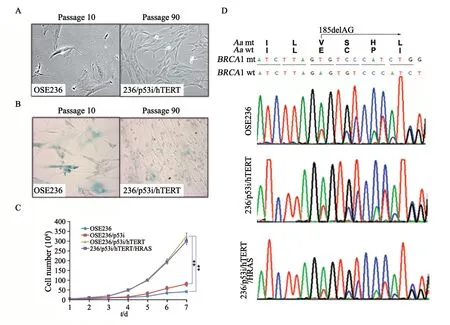
图 1 联合引入p53 shRNA与hTERT建立了永生化BRCA1 185delAG突变细胞系Fig. 1 Establishment of an immortalized cell line carrying BRCA1 185delAG mutation by the combined introduction of p53 shRNA and hTERT cDNA
2.2 永生化细胞中细胞周期及相关蛋白水平 检测
与亲代细胞相比,敲低p53的细胞(OSE236/p53i、OSE236/p53i/hTERT和OSE236/p53i/hTERT/HRAS)具有降低的G0/G1细胞群和升高的S期细胞群(图2A~B)。Western blot分析显示,细胞周期调节蛋白包括细胞周期蛋白B1、D1和E,以及细胞周期依赖性激酶CDK4,在p53 shRNA处理后显著改变(图2C)。与其亲代细胞相比,OSE236/p53i、OSE326/p53i/hTERT和OSE236/p53i/hTERT/HRAS细胞中的周期蛋白CDK4、cyclin B1、cyclin D1和cyclin E显著增加,而CDK4、cyclin D1和cyclin E在HRAS导入细胞中有所下降,表明HRAS表达有可能抑制了细胞周期进展。同时在亲代细胞中检测到p53的改变,表明BRCA1突变稳定了细胞核中的p53蛋白,但随着细胞被p53 shRNA处理,p53的表达水平降低,而HRAS表达只有在HRAS导入的细胞中检测到(图2C)。这些数据表明永生化细胞中细胞周期的改变可能是这些蛋白质介导的。
2.3 HRAS未能诱导永生化细胞转化
软琼脂实验显示,在OSE236、OSE236/p53i、OSE236/p53i/hTERT和OSE236/p53i/hTERT/HRAS细胞中未观察到细胞集落的形成(图2D)。随后,我们将OSE236/p53i/hTERT/HRAS细胞注射到裸鼠身上以测试体内肿瘤生长。皮下接种OSE236/p53i/hTERT/HRAS细胞的6只小鼠在平均3.5个月内均未观察到肿瘤生长,而对照细胞HEY在接种后3周内肿瘤体积生长可以达到1 000 mm3(图2E)。提示即使卵巢表面上皮细胞带有BRCA1 185delAG突变,HRAS也不足以诱导表达p53shRNA和hTERT永生化细胞的转化。因此,可能需要其他活化的癌基因或灭活的肿瘤抑制基因才能将其完全转化为肿瘤细胞。
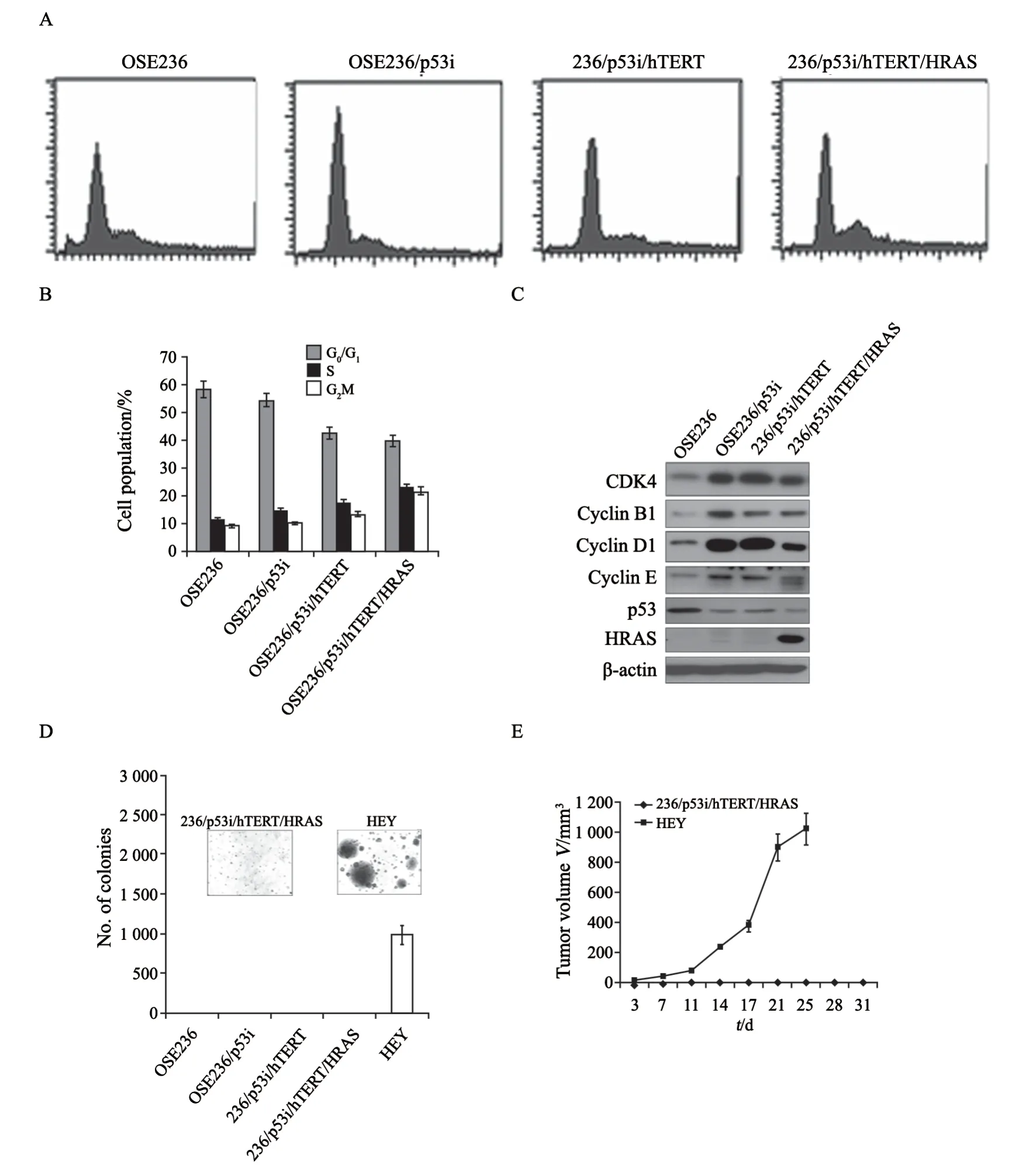
图 2 细胞周期与体内外肿瘤生长测定Fig. 2 Determination of cell cycles and in vitro and in vivo tumorigenicity
3 讨 论
1994年,根据其在乳腺癌和卵巢癌综合征中的遗传功能,位于染色体17q21上的BRCA1被首次鉴定[20]。对其肿瘤抑制功能的机制研究表明,BRCA1参与DNA损伤修复反应并维持基因组完整性[21]。然而,这些功能是通用的,并不能解释BRCA1突变携带者具有特定肿瘤发生的倾向。关于BRCA1 185delAG的突变很早就有报道[22-24],但未进行相关人体细胞系的永生化研究。本研究通过敲低p53与hTERT组合建立了携带BRCA1 185delAG突变的永生化细胞系。永生化的OSE236/p53i/hTERT和OSE236/p53i/hTERT/HRAS细胞是非致瘤性的,表明OSE236/p53i/hTERT细胞的转化可能还需要其他肿瘤抑制基因如pRb和PP2A等的失活[25-26]。
永生化细胞和转化细胞中细胞周期的改变表明,细胞周期检查点控制分子的异常是细胞永生化必不可少的环节。CDK4、细胞周期素B1、D1和E是主要参与OSE236细胞永生化的分子。p53的失活倾向于BRCA1偶联的卵巢癌[27-28]。有研究显示,即使没有报道的BRCA1突变,通过shRNA敲低p53并结合hTERT的异位表达也可使细胞永生化[17]。
人体组织中发现的BRCA1 185delAG一般被认为主要与乳腺癌的发生有关[22,29-30],但也有明确报道证明其与卵巢癌的发生密切相关[31-32]。 关于BRCA1 185delAG突变的功能,有研究发现在卵巢表面上皮细胞中,该BRCA1突变可以抑制AKT依赖、IAP介导的Caspase3失活[33]。还有研究发现,BRCA1 185delAG突变蛋白可以增强卵巢癌患者对化疗药物的敏感性,同时可能是由于其会促进细胞核内MASPIN高表达而改善患者的预后[34]。但另一项研究发现,BRCA1 185delAG突变蛋白可能诱导早期卵巢癌上皮细胞表达白细胞介素6[35]。但是目前关于BRCA1 185delAG突变诱导乳腺癌和卵巢癌的详细机制仍然不清。因此本研究中建立的永生化细胞系将为研究此类遗传性乳腺癌或卵巢癌的发生提供一个具有重要价值的细胞模型。据我们所知,这是卵巢组织中BRCA1基因携带185delAG突变上皮细胞永生化的首次报道。尽管用HRAS不能诱导该永生化细胞系的肿瘤生长,但它可能通过进一步引入其他癌基因和(或)失活其他肿瘤抑制基因来研究BRCA1突变家族性卵巢癌发生的机制。

