原发性胃弥漫大B细胞淋巴瘤临床病理学观察及预后因素分析
孙阳阳,耿 翔,周晓莉,王更方,顾文贤,张旭东
1.南京医科大学附属常州市第二人民医院病理科,江苏 常州 213000;
2.南京医科大学附属常州市第二人民医院普外科,江苏 常州 213000
原发性胃恶性淋巴瘤(primary gastric lymphoma,PGL)只占胃恶性肿瘤的一小部分,但有证据表明其发病率呈上升趋势。几乎所有的病例均为非霍奇金淋巴瘤,绝大部分为B细胞源性,最常见的组织学类型有两种,分别为弥漫大B细胞淋巴瘤(diffuse large B-cell lymphoma,D L B C L)和黏膜相关淋巴组织(m u c o s a associated lymphoid tissue,MALT)淋巴瘤。原发性胃弥漫大B细胞淋巴瘤(primary gastric diffuse large B-cell lymphoma,PG-DLBCL)缺乏特异性临床表现,内镜及大体检查易与胃癌、溃疡或其他炎症性病变混淆,且病理表现复杂,诊断困难,使治疗也变得复杂,准确的预后判断有助于初治方案的选择,多个治疗前临床因素与PG-DLBCL患者的生存预后有关[2]。另外,随着分子遗传学、细胞生物学的进展,淋巴瘤的研究和诊断也已深入到蛋白和基因层面,分子生物学特征与淋巴瘤患者预后密切相关[3]。本研究通过回顾性分析104例PG-DLBCL患者的病史资料,了解该病的临床特征及病理学特点,分析不同临床病理学因素及分子因素对其预后的影响,并以此为依据制定合理的治疗方案,以提高患者的生存率。
1 资料和方法
1.1 一般资料
采用回顾性队列研究方法。收集2008年1月—2018年7月南京医科大学附属常州市第二人民医院收治的104例PG-DLBCL患者的临床病理学资料及随访资料。
1.2 随访
以病理学确诊之日开始计算生存期,对所有患者采用电话、门诊、住院等方式随访至2019年3月30日。
1.3 统计学处理
应用SPSS 18.0软件进行统计学分析。计数资料比较采用χ2检验,应用Kaplan-Meier法绘制患者生存曲线,Log-rank检验和COX回归模型进行生存分析及预后因素分析。P<0.05为差异有统计学意义。
2 结 果
2.1 临床资料
104例PG-DLBCL患者占南京医科大学附属常州市第二人民医院同期DLBCL的23.5%(104/442例),占同期胃恶性肿瘤的1.5%(104/7 109例),男性45例,女性59例,年龄26~88岁,中位年龄68岁,63例患者以上腹部不适、胃胀、嗳气反酸、呕吐就诊,104例患者均行内镜检查并行活体组织病理学检查,幽门螺杆菌阳性率44.2%(46/104),内镜下病灶以溃疡+糜烂型为主(91/104例),21例为糜烂,45例溃疡灶≤2 cm,2 cm<21例溃疡灶≤5 cm,4例溃疡灶>5 cm。好发部位为胃窦、胃角(93/104例),病变位于贲门胃底部6例,胃体5例。初次胃镜活检准确率为83.5%,二次活检准确率为98.0%,14例患者因术前诊断不明确而行胃癌根治手术。临床分期ⅠE~ⅡE期75例,ⅢE~ⅣE期29例。有B症状(盗汗、不明原因发热>38 ℃持续时间超过3 d、半年内不明原因体质量减轻>10%)者37例。应用淋巴瘤国际预后指数(international prognostic index,IPI)评分进行评价,0~1分69例,≥2分35例。美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)评分0~1分64例,≥2分40例;发生骨髓浸润15例(图1)。
2.2 实验室检查结果
初诊时血清乳酸脱氢酶(lactate dehydrogenase,LDH)升高(>250 mg/mL)54例,贫血(血红蛋白<11.0 mg/mL)38例,低白蛋白血症(<3.0 g/mL)48例,血清CA125水平>35 U/mL 44例。
2.3 病理学检查结果
组织学形态:弥漫成片的淋巴母细胞样细胞浸润并破坏胃黏膜,胃黏膜固有腺体减少,部分病例肿瘤细胞侵犯破坏胃壁肌层,肿瘤细胞体积大,核分裂象多见,散在坏死(图2A~B)。
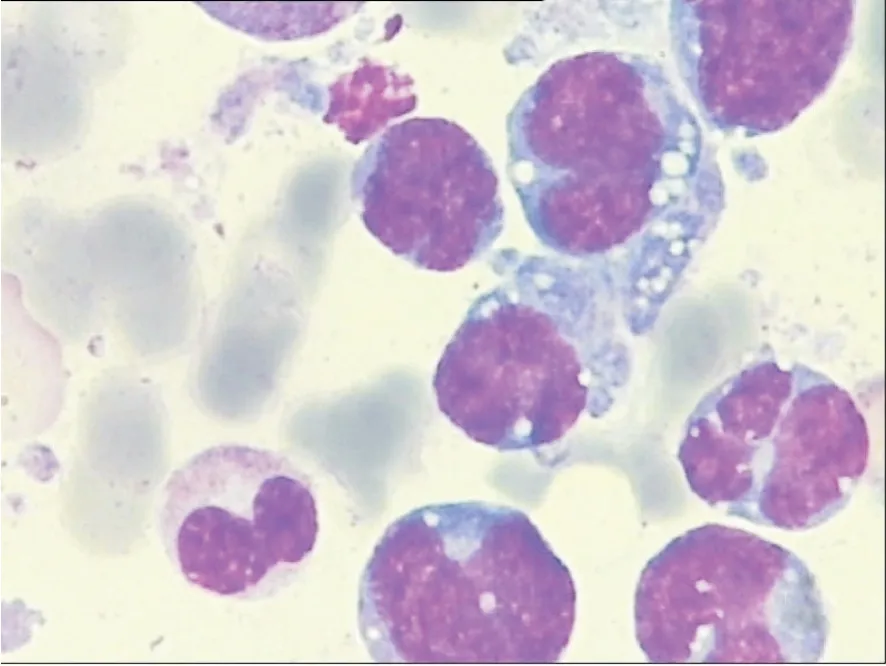
图 1 PG-DLBC淋巴瘤细胞浸润骨髓Fig. 1 PG-DLBCL lymphoma cells infiltrating the bone marrow
免疫组织化学分析结果:根据淋巴细胞表面膜抗原分子-10(cluster of differentiation 10,CD10)、B细胞白血病/淋巴瘤-6(B-cell leukemia/lymphoma 6,BCL-6)基因和多发性骨髓瘤原癌基因-1(multiple myeloma oncogene-1,MUM-1)免疫组织化学染色将细胞来源分为生发中心样B细胞(germinal center B cell-like,GCB)型或非生发中心样B细胞(non-germinal center B cell-like,non-GCB)型;CD10+,BCL-6-或CDl0-、B C L-6+、M U M-1-归于G C B 组,C D l 0-、 BCL-6-或CDI0-、BCL-6+、MUM-1+归于non-GCB组。本组104例PG-DLBCL患者,GCB型40例(38.8%),non-GCB型64例(61.2%)。CD20阳性104例(100.0%),CD79α阳性104例(100.0%),CD10阳性38例(36.9%),BCL-6阳性26例(25.0%),MUM-1阳性63例(61.0%),C-Myc阳性59例(56.7%),BCL-2阳性39例(37.5%),细胞分裂周期蛋白7(cell division cyclin 7,CDC7)阳性60例(57.7%),微小染色体维持蛋白2(m i n i c h r o m o s o m e maintenance protein 2,MCM2)阳性41例(39.4%)(图2C~F)。
荧光原位杂交技术(fluorescence in situ hybridization,FISH)检测结果显示:c-Myc基因异常27例(占26%,其中17例为多拷贝,10例为重排),BCL-2基因异常26例(占25.2%,其中17例为多拷贝,9例为重排),BCL-6基因异常32例(占31%,其中23例为多拷贝,9例为重排)(图3)。 BCL-2、BCL-6、c-Myc蛋白的高表达与基因的异常表达无显著相关性(P>0.05)。
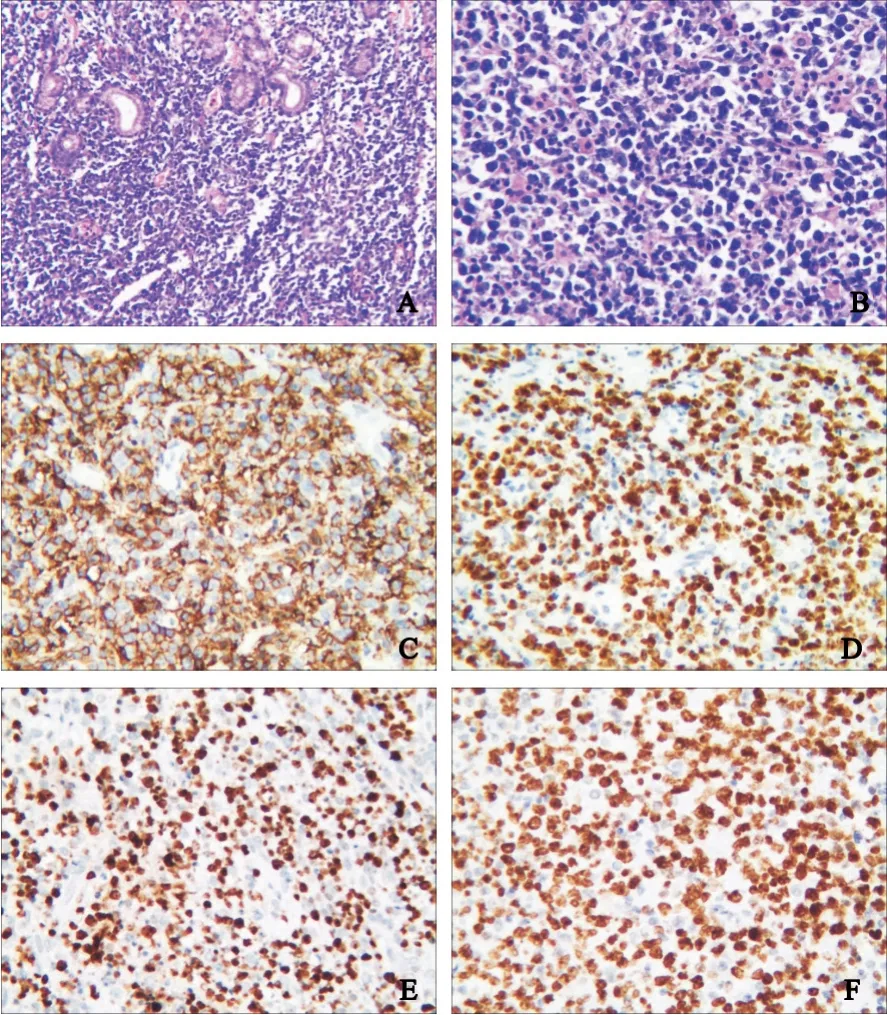
图 2 PG-DLBC组织学形态特点及免疫组织化学结果Fig. 2 Histological features and immunohistochemical results of PG-DLBCL
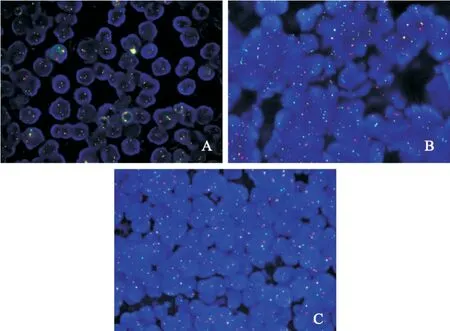
图 3 PG-DLBC FISH检测结果Fig. 3 PG-DLBCL FISH test results
2.4 治疗方法
本组104例PG-DLBCL患者中,仅14例患者因术前诊断不明确而行根治手术,术后均辅以化疗,采用CHOP方案(环磷酰胺+表多柔比星+长春新碱+泼尼松)或CHOP样方案10例,R(利妥昔单抗)-CHOP方案4例。90例未手术患者采用CHOP方案或CHOP样化疗方案74例,R-CHOP方案16例,11例术后给予联合放疗,放疗剂量为30~ 50 Gy。化疗l~8个周期,中位疗程为5个周期。
2.5 统计学分析结果
104例患者均获得随访,随访时间6.0~103.0个月,中位随访时间71.0个月,患者中位生存时间58.6个月,1、3和5年总体生存率分别为90.1%、76.8%和47.6%(图4)。

图 4 104例PG-DLBCL患者累计生存率Fig. 4 Cumulative survival rate of 104 PG-DLBCL patients
单因素分析结果显示,血清CA125水平、血清LDH水平、IPI评分、改良Ann Arbor分期、骨髓侵犯、治疗方法、病理学分子分型、BCL-2/BCL-6/MUM-1/CDC7/MCM2蛋白表达水平均是影响PG-DLBCL患者预后的相关因素(P<0.05,表1)。多因素分析结果显示,改良Ann Arbor临床分期ⅢE~ⅣE期、IPI评分≥2、病理学类型non-GCB型、CDC7蛋白高表达、MCM2蛋白高表达、FISH检测BCL-2基因重排是影响PGDLBCL患者预后的独立危险因素(P<0.05, 表2)。
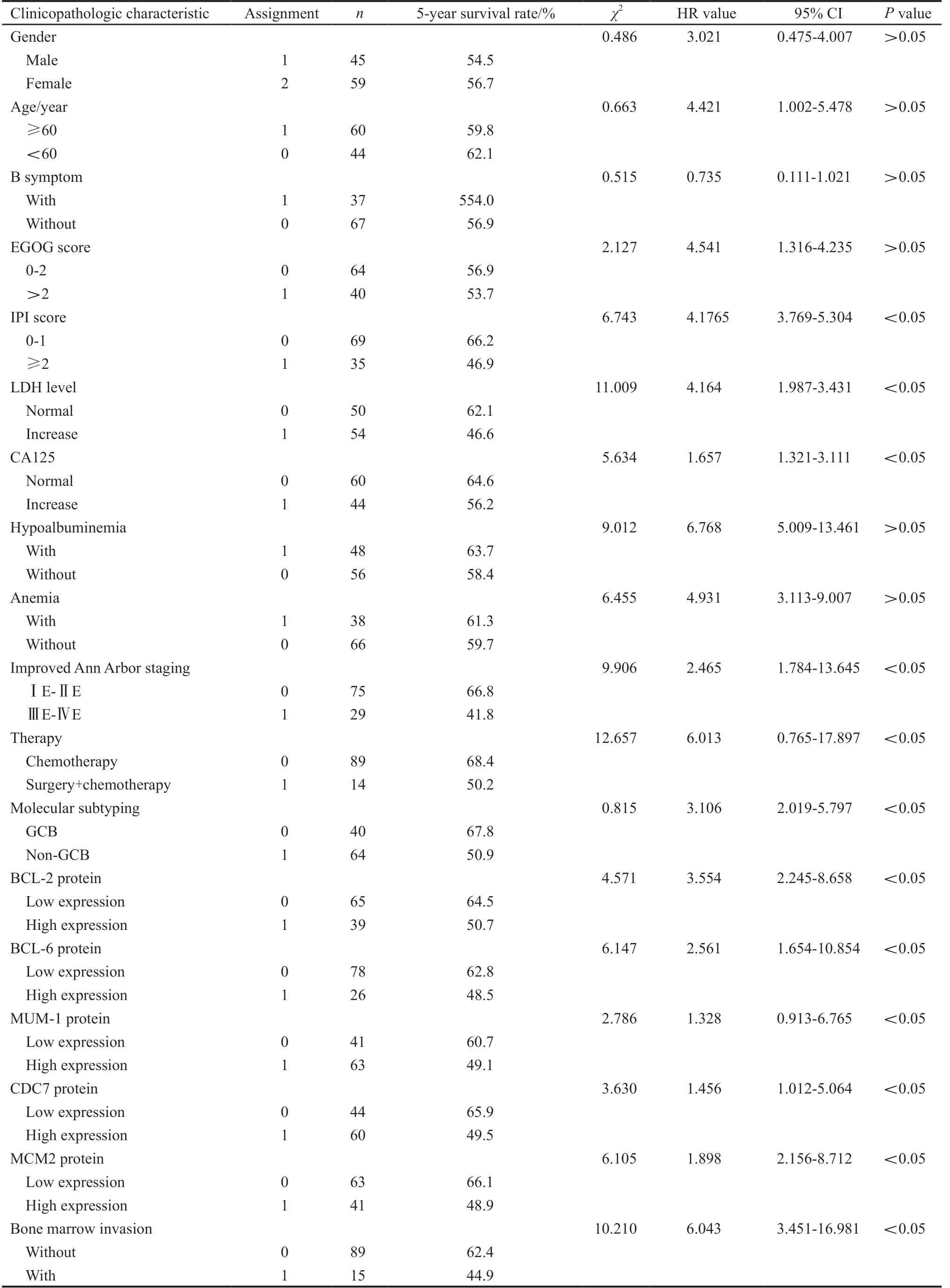
表 1 影响104例PG-DLBCL患者预后的单因素分析Tab. 1 Univariate analysis of clinicopatholigic characteristics affecting the prognosis of 104 patients with PG-DLBCL
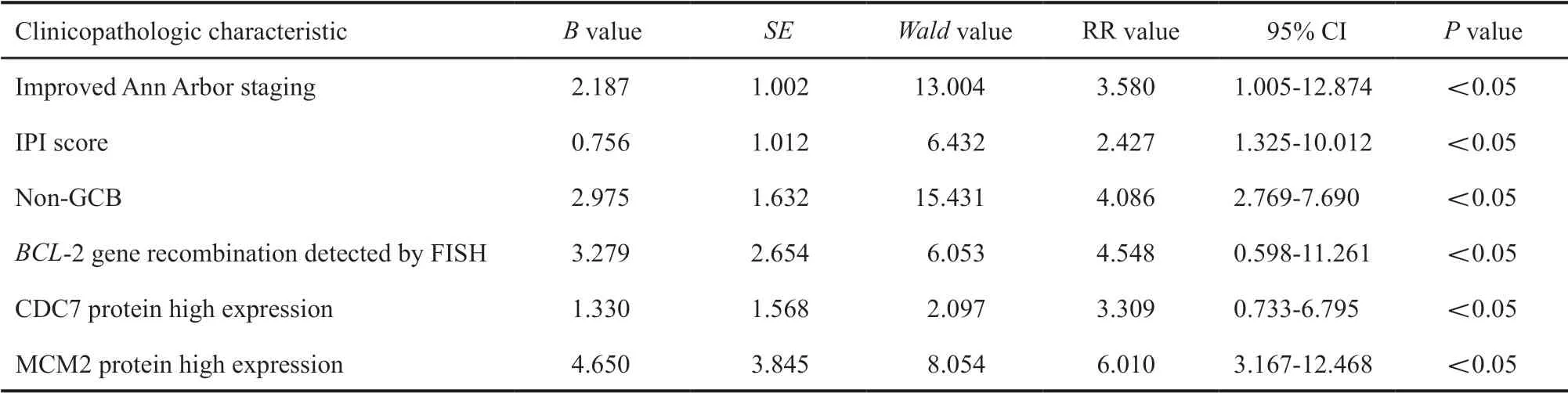
表 2 影响104例PG-DLBCL患者预后的多因素分析Tab. 2 Multivariate analysis of clinicopatholigic characteristics affecting the prognosis of 104 patients with PG-DLBCL
3 讨 论
据统计,25%~50%的非霍奇金淋巴瘤发生于结外,其中胃肠道最多见,占所有非霍奇金淋巴瘤的4%~20%,其中以MALT淋巴瘤和DLBCL最常见[4]。PG-DLBCL具有高度侵袭性,且部分DLBCL是由低度恶性的MALT淋巴瘤转化而来。该病好发于中老年人,早期诊断比较困难,易误诊、漏诊为胃溃疡或胃癌,内镜及组织病理学活检是早期重要的检查手段及确诊的唯一依据。本研究104例PG-DLBCL患者中,中位年龄68岁,91例内镜下病灶表现为糜烂+溃疡,初次胃镜活检准确率为83.5%,二次活检准确率为98.0%,与国内外相关研究相一致。
2004年Hans等[5]研究发现,应用免疫组织化学技术检测CDl0、BCL-6和MUM-l的表达模式能将DLBCL分为预后不同的两种亚型,即GCB型和non-GCB型。Zhang等[6]分析了151例原发性胃肠道DLBCL患者的预后,发现两组患者5年生存率分别为65.2%和36.4%。另有多项研究表明,GCB型DLBCL的预后明显好于non-GCB型DLBCL。本研究104例PG-DLBCL患者中GCB型40例,non-GCB型64例,单因素分析结果显示,GCB型和non-GCB型患者的5年生存率分别为67.8%和50.9%,差异有统计学意义(P<0.05),结果与国内外报道相符合。
PG-DLBCL是一组高度异质性的恶性肿瘤,遗传学异常的多样性是导致本病异质性的根本原因,与其发病密切相关的常见遗传学异常包括BCL-6、BCL-2和c-Myc基因的易位和扩增[7]。本研究104例PG-DLBCL患者中,BCL-6阳性26例,MUM-1阳性63例,c-Myc阳性59例,BCL-2阳性37例,c-Myc基因异常25例,BCL-2基因异常26例,BCL-6基因异常32例。单因素分析显示,BCL-2、BCL-6和c-Myc过表达组患者的5年生存率明显比低表达组短。此结果独立于GCB或non-GCB亚型对预后的影响,也独立于IPI。本组数据同时显示,BCL-2、BCL-6、c-Myc蛋白的高表达与基因的异常表达无显著相关性(P>0.05)。多因素分析结果显示,BCL-2基因的重排是影响患者预后的独立危险因素。
CDC7基因编码具有激酶活性的细胞分裂周期蛋白,这种蛋白质对于启动DNA复制至关重要,并且在调节细胞周期进程中起着重要作用。该基因产物的过表达可能与某些肿瘤的转化有关[8]。MCM2基因是影响染色体有丝分裂稳定性的主要基因,其编码的MCM2蛋白是一种启动DNA复制的蛋白家族中的一员,MCM2的激活导致了MCM复合物在复制起始处的解旋酶活性。CDC7可通过磷酸化MCM2调控DNA复制的顺利进行。侯芸等[9]的研究表明,CDC7低表达组患者的生存率明显高于高表达组(57% vs 37%,P<0.05)。Obermann等[10]应用组织芯片法检测112例初治DLBCL患者组织标本的MCM2蛋白表达,结果显示,MCM2蛋白阳性表达患者生存率显著低于阴性表达患者。单因素分析结果显示,MCM2蛋白表达水平是影响患者预后的不良因素之一。本研究应用免疫组织化学方法分析了104例PG-DLBCL患者的石蜡包埋组织块,结果显示,CDC7蛋白阳性60例(57.7%),MCM2蛋白阳性41例(39.4%),MCM2、CDC7阳性表达组患者的5年生存率显著低于阴性组(P<0.05),表明MCM2、CDC7可以成为PG-DLBCL患者特异性预后指标。
改良Ann Arbor临床分期、血清LDH水平和IPI评分是指导淋巴瘤临床治疗及影响预后的重要指标,但对PG-DLBCL是否也具有指导治疗和影响预后的作用存在较大争议。有研究表明,IPI评分可以预测预后[11],评分为≥2分患者的预后显著差于0~1分的患者,单因素分析显示,改良 Ann Arbor临床分期、血清LDH水平和IPI评分对患者的总生存率具有显著影响。多因素分析提示,初诊时血清LDH水平升高和晚期(Ⅲ~Ⅵ期)患者的死亡风险较高。血清LDH反映了肿瘤的增殖活性。Cheng等[12]对DLBCL患者进行CA125检测的结果显示,CA125与疾病的分期、LDH水平、肿瘤大小等相关,提示DLBCL的CA125可能是一个重要的预后指标。本研究结果显示,血清CA125升高组与正常组、血清LDH水平升高组与正常组、IPI评分≥2分与<2分、改良Ann Arbor分期ⅢE~ⅣE期与ⅠE~ⅡE期差异均有统计学意义(P均<0.05),以上结果与国内外多项关于PG-DLBCL的研究结果均相符合[13]。
关于PG-DLBCL的治疗,国内外仍存在较大争议。多数学者认为尽管手术对PG-DLBCL的诊断及临床分期有重大意义,但治疗效果仍存在争议[14-16]。在一项对589例PG-DLBCL患者大型的随机对照临床研究中发现,单纯手术和手术+放疗组患者的10年无事件生存率分别为28%和23%,而手术+化疗和单纯化疗组分别为82%和92%,可见单纯的手术治疗是不够的,联合化疗可显著提高患者的无病生存率,单纯化疗可获得与手术+化疗相当的无事件生存率。本研究结果显示,手术+化疗组和单纯化疗组的5年生存率分别为50.2%和68.4%,差异有统计学意义(P<0.05)。手术在PG-DLBCL患者治疗中的价值尚需大样本的前瞻性随机对照研究进一步 验证。
PG-DLBCL在临床上较少见,是具有高度异质性和侵袭性的恶性肿瘤,好发于中老年人,以早期病变常见,内镜及活组织病理学检查是主要的检查方法及确诊依据。改良Ann Arbor临床分期ⅢE~ⅣE期、IPI评分高危组、血清LDH及CA125高表达是预后不良因素。全身化疗可提高患者的生存率。non-GCB亚型、CDC7及MCM2高表达的PG-DLBCL患者预后差,这些分子预后标志在临床预后评估系统的基础上进一步将PG-DLBCL患者的预后分为不同亚层。随着精准医学时代的到来,应将临床与分子预后因素相结合,建立更加完善的DLBCL预后评估体系,同时充分应用靶向治疗的优势,从而实施更加精准的个体化治疗,提高患者的生存率。

