高效液相色谱法测定伏格列波糖口腔速溶膜中伏格列波糖的含量和有关物质
孙文霞, 陈 勇(成都大学 四川抗菌素工业研究所, 四川 成都 610052)
0 引 言
伏格列波糖,化学名为(+)-1L-[1(羟基),2,4,5/3]-5-[2-羟基-1-(羟甲基)乙基]氨基-1-碳-(羟甲基)-1,2,3,4-环已四醇,是一种从放线菌培养液中发现的天然糖类似物,能够抑制小肠壁细胞a-葡萄糖苷酶的活性,从而有效改善糖尿病餐后血糖,目前广泛用于I、II型糖尿病的防治[1-5].2006年,伏格列波糖口腔速溶膜剂面世,并得到广泛使用,但目前关于控制其质量的相关文献较少.对此,本研究通过建立柱后衍生HPLC荧光检测法,测定伏格列波糖口腔速溶膜中伏格列波糖的含量和有关物质,以有效控制伏格列波糖口腔速溶膜剂的质量.
1 材料与仪器
1.1 材 料
实验所用材料包括:伏格列波糖对照品(批号,100826-200801,纯度99.2%),由中国食品药品检定研究院提供;伏格列波糖口腔速溶膜(批号,140711、140712、140713,规格为0.2 mg),由四川抗菌素工业研究所提供;伏格列波糖口腔速溶膜(批号,4C11W,规格为0.2 mg),购自日本救急药品工业株式会社;乙腈为色谱纯,购自美国fisher公司;水为重蒸馏水,其余试剂均为分析纯.
1.2 仪 器
实验所用仪器包括:LC-20AB型高效液相色谱仪、RF-10AXL型荧光检测器、CRB-6A型化学反应箱、LC-Solution色谱工作站(日本岛津公司);FE-20型pH计(梅特勒—托利多公司);CPA-225D型十万分之一电子天平(赛多利斯科学仪器(北京)有限公司).
2 方法和结果
2.1 色谱条件
实验的色谱条件为:含量测定用色谱柱为COSMOSIL 5C18-PAQ柱(250 mm×4.6 mm,10 μm);有关物质测定用色谱柱为Shodex Asahipak NH2P-50 4E柱(250 mm×4.6 mm,5 μm);含量测定流动相为0.045%辛烷磺酸钠的磷酸盐缓冲液(取3.12 g磷酸二氢钠二水合物,加水1 000 mL使其溶解,用磷酸调pH值至3.5)—甲醇(94∶6);有关物质测定流动相为磷酸缓冲液(取1.56 g磷酸二氢钠二水合物溶解于500 mL水中,另取3.58 g十二水磷酸氢二钠溶解于500 mL水中,用磷酸调pH值至6.5, 将2种溶液混合均匀)—乙腈(37∶63);荧光检测器激发波长为350 nm,发射波长为430 nm;柱温为25 ℃;荧光衍生试剂的制备方法为,取牛磺酸6.25 g、高碘酸钠2.56 g溶解至1 000 mL水中,摇匀,即得;反应浴温度为100 ℃,聚四氟乙烯反应管长20 m(内径0.5 mm),冷却浴温度为15 ℃,聚四氟乙烯冷却管长2 m(内径0.3 mm);流动相与荧光试剂流速相同,含量测定为1.0 mL/min,有关物质测定为0.6 mL/min;进样量100 μL.
2.2 溶液配制
2.2.1 供试品溶液配制.
取本品10片,剪碎,置于50 mL量瓶中,加流动相40 mL,超声处理10 min,放冷,用流动相稀释至刻度,摇匀,过滤,精密量取续滤液1 mL,置10 mL量瓶中,用流动相稀释至刻度,摇匀,作为含量测定用供试品液.另取本品10片,剪碎,置5 mL量瓶中,加流动相4 mL,超声处理10 min,放冷,用流动相稀释至刻度,摇匀,过滤,取续滤液作为有关物质检查用供试品溶液.
2.2.2 对照品溶液配制.
精密称取伏格列波糖对照品10 mg,置25 mL量瓶中,用流动相溶解并稀释至刻度,摇匀,精密量取1 mL,置10 mL量瓶中,用流动相稀释至刻度,摇匀,作为对照品溶液.
2.2.3 对照溶液配制.
精密量取1.0 mL“2.2.1”项下有关物质检查用供试品溶液,置100 mL量瓶中,用流动相稀释至刻度,摇匀,作为有关物质检查用对照溶液.
2.3 含量测定
精密量取“2.2”项下含量测定用供试品溶液和对照品溶液各100 μL,注入液相色谱仪,记录色谱图.按外标法计算出供试品中伏格列波糖的含量.
2.4 有关物质测定
精密量取“2.2”项下对照溶液100 μL注入液相色谱仪,调节检测灵敏度,使主成分色谱峰的峰高为满量程的20%.再精密量取“2.2”项下有关物质检查用供试品溶液100 μL注入液相色谱仪,记录色谱图至主成分峰保留时间的2.5倍.供试品溶液的色谱图中如显杂质峰,扣除辅料峰后,单个杂质峰面积不得大于对照溶液峰面积的0.2倍(0.2%),各个杂质峰面积之和不得大于对照溶液峰面积的0.5倍(0.5%).
2.5 方法验证
2.5.1 专属性.
取本品适量(批号140711,约相当于伏格列波糖2.0 mg),置于5 mL的容量瓶中,平行制备6份,进行破坏性实验,具体包括:
1)高温破坏.样品经100 ℃高温加热约4 h;
2)光照破坏.样品在光照度为(4 500±500) lx下放置10 d.
3)氧化破坏.样品加30%双氧水0.5 mL,放置1 h.
4)酸破坏.样品中加1 mol/L的盐酸0.5 mL,放置4 h后,用1 mol/L的氢氧化钠至中性.
5)碱破坏.样品加1 mol/L的NaOH溶液0.5 mL,放置4 h,加1 mol/L 的HCl溶液至中性.
上述经破坏的样品均用流动相稀释至刻度,摇匀,过滤,取续滤液按照“2.1”项下色谱条件进行测定.结果显示:本品经光照和高温破坏,主峰面积有所下降,杂质个数和峰面积均有所增加;在经酸、碱和双氧水破坏后主峰面积明显降低,说明该药对酸、碱和双氧水不稳定.相邻杂质与主成分色谱峰分离较好,分离度大于1.5,说明所建方法的专属性强.破坏性实验色谱如图1所示.

图1 破坏性实验色谱图
2.5.2 线性关系.
精密称取伏格列波糖对照品适量,用流动相制成每1 mL中含伏格列波糖25.0、32.0、40.0、45.0、50.0 μg的溶液,分别精密吸取100 μL注入液相色谱仪,记录色谱图.以峰面积Y对伏格列波糖X(μg/mL)进行线性回归,得回归方程为,Y=243 345X-811 215.73(R=0.9999,n=5).结果表明,伏格列波糖浓度与色谱峰面积在25.0~50.0 μg/mL范围内线性关系良好.
2.5.3 进样精密度.
精密量取“2.2”项下对照品溶液和对照溶液各100 μL,分别注入液相色谱仪,记录色谱图,连续测定6次,峰面积的RSD分别为0.52%和0.76%.结果表明,仪器的进样精密度良好.
2.5.4 重复性.
取同一批样品(批号,140711),按“2.2.1”项下方法平行制备6份含量测定用供试品液,按“2.1”项下色谱条件分别进样分析,计算得到含量分别为100.23%、100.06%、100.35%、100.74%、101.45%和101.63%,RSD为0.65%(n=6).结果表明,方法的重复性良好.
2.5.5 中间精密度.
精密称取样品(批号,140711),按照“2.2”项下的方法配制成含量测定用供试品溶液和对照品溶液,于不同日期,不同操作人员在不同仪器上按“2.3”项下方法测定,并按外标法计算伏格列波糖口腔速溶膜的含量,其含量的RSD为0.77%(n=6).结果表明,中间精密度良好.
2.5.6 回收率.
取本品10片置100 mL容量瓶中,加流动相80 mL,照“2.2.1”项下方法制成浓度为0.02 mg/mL的供试品母液,精密量取该母液1 mL置10 mL容量瓶中,平行制备9份,分别加入“2.2.2”项下对照品溶液4 mL(80%)、5 mL(100%)、6 mL(120%),用流动相稀释至刻度,每个浓度平行制备3份.按“2.3”项下方法测定,计算回收率,结果如表1所示.

表1 回收率实验结果
2.5.7 检测限与定量限.
取“2.2.2”项下对照品溶液逐级稀释,按“2.1”项下色谱条件测定,以信噪比S/N=3和S/N=10计,测得伏格列波糖的检测限和定量限分别为2 ng和10 ng.
2.6 样品测定结果
取3批样品,照“2.3”和“2.4”项下方法进行含量和有关物质测定,结果见表2.
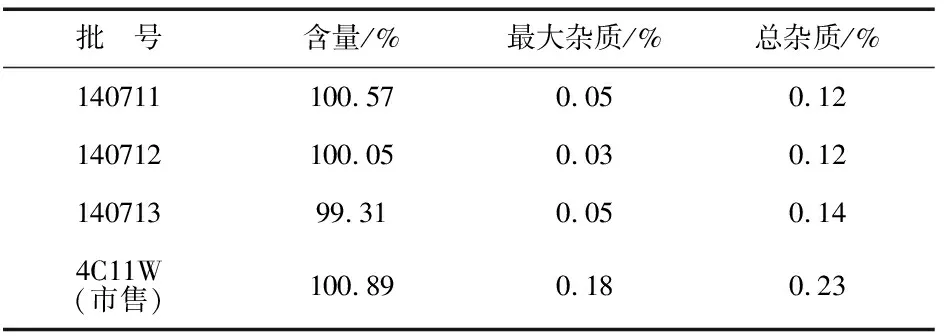
表2 样品含量和有关物质检测结果
3 讨 论
由于伏格列波糖分子结构中不含共轭基团,无紫外吸收,因而无法采用HPLC-UV法.目前相关文献中测定伏格列波糖的方法主要有HPLC-ELSD法[6]、HPLC-RID法[7]、离子色谱法[8]、柱前衍生化GC法[9]、柱后衍生HPLC荧光检测法[10-14]以及高效液相色谱—质谱法[15].伏格列波糖口腔速溶膜剂作为一种新的剂型,尚未有关于其有关物质和含量测定的相关文献报道.对此,本研究参考日本药典中伏格列波糖原料和伏格列波糖片剂的标准,采取柱后衍生HPLC荧光检测法进行相关物质与含量的测定.
在日本的药典中,采用氨基丙基硅烷填料色谱柱进行含量测定,考虑到该色谱柱用量较少,结合本实验室的条件,参考国家药品标准,采用C18色谱柱.由于长时间运行纯水相流动相时柱子使用寿命较短,故对流动相条件进行优化,当流动相为0.045%辛烷磺酸钠的磷酸盐缓冲液(取3.12 g磷酸二氢钠二水合物,加水1 000 mL使溶解,用磷酸调pH值至3.5)—甲醇(94∶6),伏格列波糖的保留时间以及对称性较好,但是考虑到水相比例仍较高,因而选择亲水性很好的COSMOSIL 5C18-PAQ柱.此外,在日本的药典中,伏格列波糖原料药对3个已知杂质即杂质1、杂质2及杂质3分别进行了限定.而文献[16]的研究表明,该3个杂质为原料药合成工艺过程所引入,并非伏格列波糖降解杂质.结合本研究的破坏实验结果,其均未在相应保留时间处产生杂质峰,故本研究认为可不对本品中3个已知杂质进行限制.
——一个解释欧姆表刻度不均匀的好方法

