糜烂型口腔扁平苔藓差异表达MicroRNAs的筛选
高胜男 李言君 李建卫 崔彩云 李焕焕 王雯虹
口腔扁平苔藓(oral lichen plauns,OLP)是一种常见的慢性炎症性自身免疫性黏膜疾病,发病率在一般人群中约为0.1%~4%,OLP的临床表现从无症状的白色网状病损到有症状的萎缩性糜烂型红色病损,呈多样化表现。糜烂型OLP是OLP中最严重的病损类型,患者具有明显的临床症状,且有癌变潜能。本研究采用miRNAs芯片筛选糜烂型OLP病损黏膜相比正常黏膜差异表达的miRNAs,有助于阐明糜烂型OLP发病分子机制及寻找特异性治疗靶点,对具有癌变倾向OLP的诊断及治疗具有重要的理论意义和应用价值。
1 材料与方法
1.1 材料
RNAlater®(赛默飞世尔科技,美国);Trizol®试剂(Invitrogen life technologies公司,美国);Biopulverizer冷冻组织粉碎钵、匀浆器(Mini-Bead-Beater-16)(Biospec公司,美国);-80℃超低温冰箱、HVE-50高压蒸汽消毒锅(Sanyo公司,日本);NanoDrop ND-1000超微量分光光度计、Baseline-ZERO DNase(EPICENTER公司,美国);RNasey Mini Kit、miRNA Complete Labeling and Hyb Kit、杂交室,杂交室密封垫片基、杂交烤箱、安捷伦微阵列杂交室用杂交烤箱旋转器、Gene Expression Wash Buffer Kit、安捷伦微阵列扫描仪(安捷伦科技公司,美国);磁力搅拌棒、磁力搅拌板(康宁公司,美国);带载玻片架的滑动染色皿(Thermo Shandon p/n 121,美国)。
1.2 实验对象和分组
收集滨州医学院附属医院口腔黏膜科糜烂型OLP病损部位黏膜组织患者3例,活检切取局部黏膜5 mm×5 mm,分为2份,一份送常规组织病理学诊断,一份留存于-80℃冰箱备用。待OLP病损组织经组织病理学诊断确诊后纳入实验。同时,采集口腔颌面外科正常口腔黏膜组织3例,阻生齿拔除术中切下的多余牙龈组织。组织经RANlater®浸泡并在4℃条件下孵育过夜后转入-80℃冰箱冰冻保存。实验方案经医院伦理委员会均签署知情同意书。
1.3 实验方法
1.3.1 总RNA提取和质量控制 使用Biopulverizer将冷冻组织粉碎,Mini-Bead-Beater-16匀浆后,加入TRIzol®试剂,按其说明书提取组织样本总RNA。RNasey Mini试剂盒纯化miRNA和总RNA,通过NanoDrop ND-1000测定RNA在230、260、280 nm的吸收值。以评估RNA是否降解并测定RNA浓度。RNA完整性需通过甲醛变性凝胶电泳进行评估。并取得RNAQC报告。纯RNA的A260/A280比率应该接近2.0(1.8和2.1之间的比率是可接受的),A260/A230的比例应该大于1.8。
1.3.2 RNA标记和杂交 来自每个组织样本的miRNA在T4 RNA ligase作用下用Cyanine 3-pCp标记,标记产物浓缩干燥后用水重溶,标准条件下标记好的探针在Agilent微阵列上杂交。将干燥的样品重悬于无核酸酶水中,配制杂交液加入,100℃温育5 min,然后立即转移到冰浴中5 min,将杂交体系置于55℃的杂交炉中,将杂交旋转器设置为以20 r/min的速度旋转,在55℃下杂交20 h。用基因表达洗涤缓冲液试剂盒(Agilent p/n 5188-5327)洗涤杂交芯片以备扫描。实验过程按照标记和杂交试剂盒的说明书完成。
1.3.3 芯片扫描 Agilent微阵列扫描仪(Agilent p/n G2505C)扫描杂交芯片后,使用Agilent Feature Extraction软件采集芯片探针信号值。使用GeneSpring GX v 12.1软件(Agilent Technologies)进行芯片标准化。
1.3.4 生物信息学分析 应用以下miRNA生物信息库对miRNA目标预测:TargetScan(http://www.targetscan.org),miRPathDBv1.1(https://mpd.bioinf.unisb.de/),DIANAMicroT(http://diana.imis.athena-innovation.gr/DianaTools/index.php),miRDB(http://mirdb.org/)。选取至少3个软件预测到的靶基因作为今后实验将验证的目标靶基因。
1.4 统计学分析
使用Agilent Feature Extraction软件(v 11.0.1.1)获得芯片图,并读值,得到原始数据。采用百分位平移法对所有数据进行归一化并对数转化,相比正常黏膜组织,糜烂型OLP黏膜组织中差异表达的miRNAs,根据Benjamini Hochberg FDR方法得到修正的P值(即FDR)进行筛选,默认Fold Change≥2.0,FDR≤0.05。与P值筛选相比,该方法能够降低假阳性率。使用R脚本进行层次聚类。
2 结 果
2.1 实验组织样本总RNA抽提结果
A260/A280比率均在1.8~2.0之间,A260/A230的比例均大于1.8(表1)。电泳实验结果:28S和18S核糖体RNA带明亮、清晰,条带锐利,上频条带强度约为下频条带的2倍,说明样本组织RNA没有降解,已提取高纯度RNA(图1)。证明可以进行下一步实验。
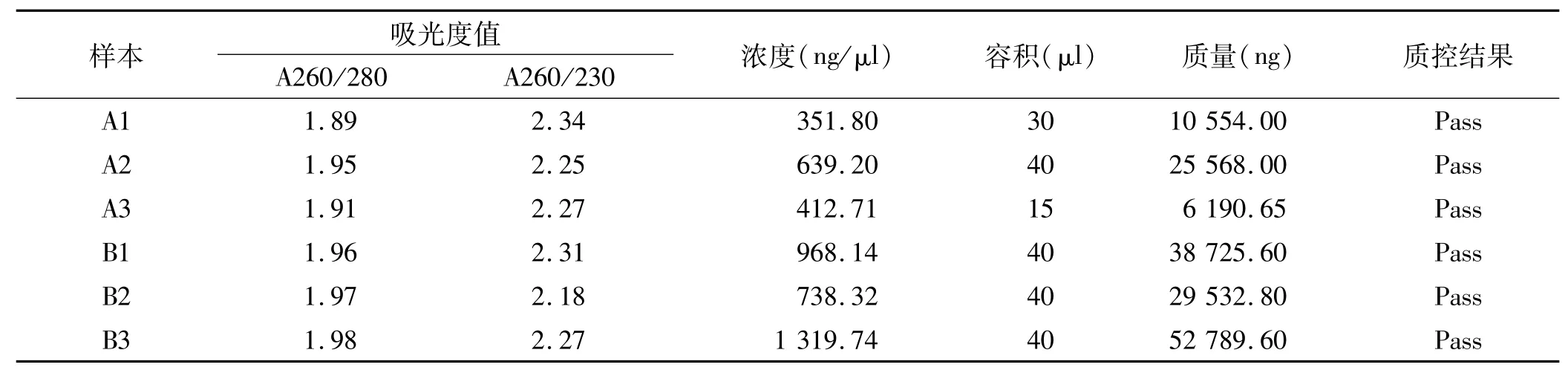
表1 实验组织样本总RNA的质检和定量Tab 1 Quality inspection and quantification of total RNA in experimental tissue samples
2.2 miRNA芯片结果
芯片原始数据经过标准化处理后,在一个二维直角坐标系平面中,绘制散点图,可清晰、明显的反应样本间的变化,所有数据采用同一标准。X轴:该点在对照样本芯片中标准化后的信号值。Y轴:该点在实验样品芯片中标准化后的信号值。从由荧光信号值构成的散点图来看,整个图呈现较为集中的趋势,绝大多数无差异表达信号值位于45°角平分线附近,差异表达信号值则发生偏离(图2)。证明原始数据的标准化是正常的。
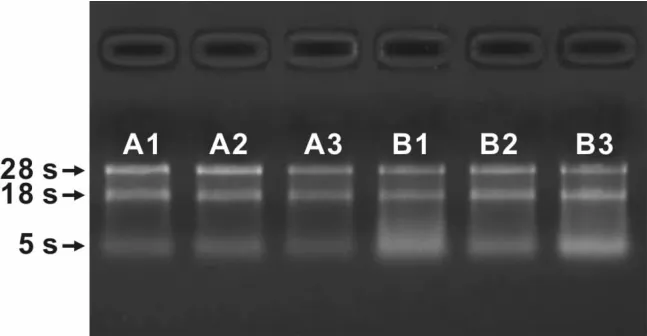
图1 6例实验组织样本提取的总RNA甲醛变性凝胶电泳图Fig 1 Standard denaturing gel electropherogram of the total RNA extracted from 6 experimental tissue samples
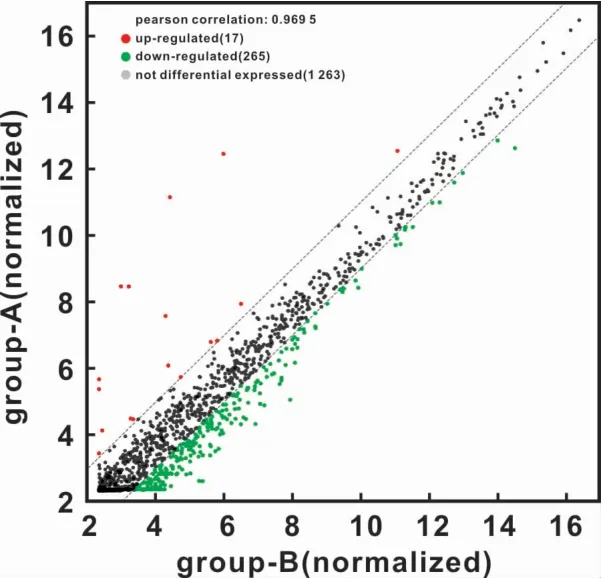
图2 实验样本荧光信号值散点分布图Fig 2 The scatter plot of the fluorescence signal values
根据Benjamini Hochberg FDR方法得到修正的P值(即FDR)进行差异miRNA筛选,默认Fold Change>2.0,FDR<0.05。筛选出159个差异表达的miRNAs(上调>2倍或下调<2倍),表达上调的有12个,表达下调的有147个(图3)。用差异表达的159个miRNAs对所有标本的系统聚类分析(图4),其中差异表达>4倍的有18个,其中表达上调的有6个,表达下调的有12个(表2)。
2.3 靶基因预测结果
筛选出miR-206、miR-133b为在糜烂型OLP的研究中作为感兴趣的miRNA,利用miRNA生物信息库TargetScan、miRPathDBv1.1、,DIANAMicroT、miRDB对其进行靶基因的预测。选择至少3个软件预测到的靶基因,以减小假阳性率。miR-206筛选出39个预测靶基因,通过查阅相关文献最终筛选出5个与糜烂型OLP相关的预测靶基因,miR-133b最终筛选出1个预测靶基因(表3)。
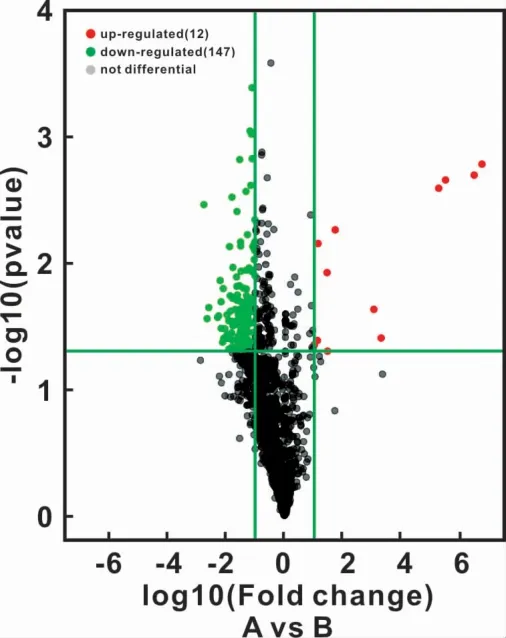
图3 糜烂型OLP黏膜组织和正常黏膜组织差异表达的miRNAsFig 3 Differentially expressed miRNAs in erosive OLPmucosa and normal mucosa
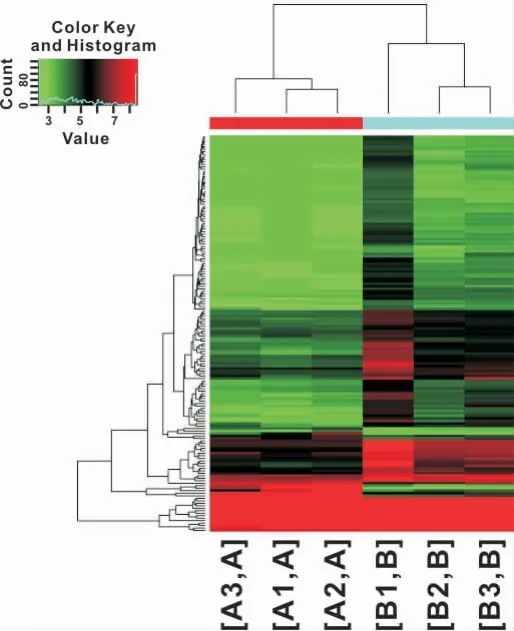
图4 糜烂型OLP和正常组织黏膜中差异表达的159种miRNAsFig 4 159 miRNAs differentially expressed in erosive OLP and normal tissue mucosa
3 讨 论
MicroRNAs(miRNAs)是一种内源性不编码蛋白质的小分子RNA,通过与靶信使RNA(mRNA)的3'非翻译区(UTR)进行不完全的碱基配对,减少目标mRNA的翻译和/或诱导其降解,从而在转录后抑制蛋白质的表达[1]。研究证明miRNAs是调控细胞周期、细胞死亡、分化和免疫的不可缺少的分子。近来有学者开始探讨研究miRNA与OLP相关关系[2],已有研究证明相关miRNA可以通过其靶基因参与OLP发病及进展甚至恶变的过程或相关miRNA调节通路中的某种物质可能通过与淋巴细胞的相互作用,共同介导OLP的免疫调节[3-4]。但是针对于miRNA与糜烂型OLP相关性的研究较少。探讨其相关miRNA有助于阐明糜烂型OLP的分子发病机制,对具有癌变倾向OLP的诊断及治疗具有重要的理论意义和应用价值。

表2 糜烂型OLP中18个差异表达4倍以上的miRNAsTab 2 18 miRNAs with more than 4 times differential expression in erosive OLP

表3 miR-206和miRv133b分别相关的靶基因Tab 3 miR-206 and miR-133b respectively related target genes
本研究中采用靶向人类2 549个miRNAs的基因芯片,筛选出159个差异表达2倍以上的miRNAs,其中12个表达上调,147个表达下调。本研究结果中出现了miR-206、miR-133b的高表达,已有研究发现miR-206、miR-133b通过其靶基因调控,参与乳腺癌、胃癌、胰腺癌、肝癌等多种癌性疾病的发生及进展[5-8],且其中STC2[9]、ANXA2[10]、TAGLN2[11]等多个靶基因与口腔鳞状细胞癌(OSCC)的发生相关。本研究提示miR-206和miR-133b可能在糜烂型OLP的发生及恶性转化中起重要作用,其具体调控机制仍需进一步研究。
本研究发现在糜烂型OLP和正常黏膜组织中差异表达>4倍的miRNAs共18个,其中miR-1-3p、miR-133a-3p、miR-133b、miR-206的差异>30倍,这些明显差异表达的miRNAs的在糜烂型OLP发生中的作用机制尚不清楚,本实验采用4个miRNA生物信息库对miR-206和miR-133b进行靶基因预测,其中有很多涉及细胞周期调控、增殖、信号转导和细胞凋亡的靶基因,有研究发现靶基因KIF2A在口腔鳞状舌癌中过表达[12];FNDC3B基因可在缺氧微环境中促进舌鳞状细胞癌细胞的上皮-间质转化[13];BACH2介导TNF-α诱导的牙龈上皮细胞凋亡[14]。但具体调控机制尚未见报道。对这些差异表达的miRNA及其靶基因的深入研究,有助于进一步了解糜烂型OLP发病的分子生物学机制,并从中寻找可能的早期诊断分子生物学标志和基因治疗的新靶点。
目前对于糜烂型OLP中特异miRNA表达谱的研究尚没有一致的结论,今后的研究应扩大样本量,验证基因芯片筛选出的有明显差异表达的miRNAs在糜烂型OLP中的表达,其靶基因和信号通路在糜烂型OLP中的具体调控途径将是本研究下一步重点。

