快速降解的弹性体(PGS/PCL)人工血管重建肌性功能性颈动脉的实验研究
杨欣 杨帆 郭晓宝 吴炜 高瞻
由于颈动脉功能和位置的特殊性,颈动脉被肿瘤侵犯后,给手术治疗术式的选择带来很大的挑战[1-3]。连同被侵犯的颈动脉与肿瘤整体切除的术式是业界比较认可的可以减少复发率提高生存率的方式,但是颈动脉切除后,如果不重建颈动脉血流,会有不小的造成的神经系统并发症的机率。而颈动脉结扎切除后重建颈动脉可以有效减少神经系统并发症的发生[4-6]。
目前,颈动脉重建常用到的方法有自体静脉移植(大隐静脉、股浅静脉等)以及不可降解的惰性材料构建的成品人工血管等。但均存在不同的缺陷[7-8]。
应用聚癸二酸丙三醇酯[poly(glycerol sebacate),PGS]为主体构建了双层人工血管,PGS属于一种弹性体,其弹性模量与动脉接近。本实验研究旨在评估这种双层人工血管重建颈动脉的效果,为颈动脉的重建提供一种更优的选择。
1 材料与方法
1.1 PGS/PCL双层人工血管的构建
PGS/PCL双层人工血管的构建与之前实验描述过的一样,利用模具构建盐(NaCl)模,淋滤PGS溶液,真空干燥箱中加热使PGS交联。利用静电纺丝技术将聚乙酸内酯(PCL,polycaprolactone)纳米纤维丝缠绕在盐模上,将盐模复合体浸入去离子水,去净其中的盐。构建好PGS/PCL双层人工血管,储存在常温干燥箱中,使用前环氧乙烷消毒消毒。
1.2 PGS/PCL双层人工血管物理特性的分析
扫描电镜(SME)检测,修剪标本,喷金处理,扫描电镜(日立,S-4800,日本)观察并且拍照片,管壁的厚度以及鞘层的厚度用扫描电镜自带的测量软件进行测量和记录。弹性模量、拉伸强度和缝合强度的测量使用微小力拉扭试验机(BOSE,Electroforce 3200 seriesⅡ,美国)来测试。PGS/PCL人工血管截成大约2 mm小段,安装到机器上,给予单向径向的拉力,速度为2 mm/min,最大加力为10 N。缝合强度的测量,将9-0的显微外科缝线从距PGS/PCL人工血管管口大约1 mm处穿出后打结,安装到机器上,加力方式、强度和速率同前。
1.3 PGS/PCL人工血管手术植入大鼠颈动脉
雄性SD大鼠10只,体重大约250~300 g,使用小动物麻醉机,对大鼠行异氟醚吸入麻醉(5%诱导麻醉,2%维持麻醉),麻醉满意后,在颈部正中切口暴露颈总动脉,分离,血管夹两头夹住颈动脉,切除大约5 mm颈动脉,显微外科方法吻合人工血管与颈动脉两端。术后未给予抗凝和抗血小板治疗。12个月后,麻醉下(方法同前),分离并切取新生血管后,进一步完成组织学,生物化学、扫描电镜、机械力学等的分析。
1.4 血管造影(CTA)
按照45 mg/kg的剂量,腹腔注射3%戊巴比妥钠麻醉大鼠后,尾静脉注射碘比醇(三代显,法国加柏公司,50 ml)3 ml,GE Brightspeed 8排CT扫描大鼠全身,用其自带软件行三维成像重建。
1.5 新生血管的组织学分析
标本用PBS漂洗后,OCT包埋剂包埋,冰冻切片机(莱卡生物,德国)切片厚度为5μm。4%的多聚甲醛中固定5 min后,分别行HE,马松三色和伟郝夫范吉森染色,在正置显微镜(尼康551,日本)下观察并拍照片。扫描电镜分析的标本,PBS漂洗后,2.5%的戊二醛溶液过夜固定,乙醇浓度梯度脱水的方法脱水,碳纤维胶带黏贴到到扫描电镜专用的铝托上,喷金处理后,用扫描电镜观察并且拍照片。
1.6 免疫荧光染色
α-平滑肌肌动蛋白(α-SMA)的表达,选择小鼠抗大鼠SMA单克隆抗体作为一抗;平滑肌肌球蛋白重链(MHC)的表达,选择小鼠抗大鼠MHC单克隆抗体作为一抗;弹性蛋白和胶原蛋白的表达,选择兔抗大鼠弹性蛋白多克隆抗体,和兔抗大鼠胶原I和胶原III多克隆抗体作为一抗。荧光二抗分别选择山羊抗兔Alexa Fluor 488抗体(Jackson,USA)和山羊抗小鼠Alexa Fluor 488抗体,以及山羊抗兔Alexa Fluor594山羊抗小鼠Alexa Fluor 594抗体。未使用一抗的切片作为阴性对照,大鼠自体颈动脉作为正常对照组。
1.7 生物化学定量分析(弹性蛋白、胶原蛋白、DNA)
弹性蛋白的定量分析使用了Biocolor弹性蛋白检测试剂盒(Biocolor,F2000,UK)。依照产品说明操作步骤,提取出可溶性的弹性蛋白,将管内液体转移到96孔板上,放入酶标仪,绘制出标准曲线,比对后得出样本中弹性蛋白的含量。胶原蛋白的定量分析使用了Biocolor胶原蛋白检测试剂盒(biocolor,S1000,UK)。依照产品说明操作步骤,逐步将标本中的胶原蛋白提取出后,与染料结合,后根据染料的量比对出标本中所含有的胶原蛋白的量。DNA的提取使用德国QIAGEN的DNA提取试剂盒,依照试剂盒详述的操作步骤提取出标本中的DNA后,比对出DNA的含量。
1.8 统计学分析
所有数据均使用±s来表示,采用双尾t检验来比较差异。P<0.05有统计学意义。
2 结 果
2.1 PGS/PCL人工血管的微观结构和机械力学性能
PGS/PCL人工血管具有双层结构(图1A),内层为相互连通的多孔状的PGS管芯(图1B),外层为菲薄的PCL纳米纤维鞘层结构(图1C)。PGS/PCL人工血管在对折180°后不会出现扭结的现象(图1D)。菲薄的(12.27±0.79)μm PCL纳米纤维鞘层将弹性模量从(153.47±71.80)kPa提高到(415.31 ±37.41)kPa(图1G),抗拉强度从(110.67±14.35)kPa提高到(1 162.42±34.13)kPa(图1F)。很大地提高了临床使用的安全性。PGS/PCL人工血管的缝合强度(0.43±0.065)N显著大于PGS管芯(0.12±0.017)N、静脉血管(0.25±0.041)N以及9-0的显微外科缝线(0.26±0.014)N的缝合抵抗力(图1E)。
2.2 PGS/PCL人工血管在体内的改建
人工血管在动脉血流的高压下,迅速变红,PCL纳米纤维鞘层迅速有效地阻止了血液的持续渗出,管壁未见明显膨胀(图2A)。12个月后,CTA和尸检分析其通畅率为90%,未发现管腔狭窄以及动脉瘤(图2B)。
新生血管的弹性模量和断裂强度分别是(122.92±47.12)kPa和(50.86±7.14)kPa,显著大于静脉的弹性模量和断裂强度。而更加接近自体颈动脉的弹性模量(361.09±93.02)kPa和断裂强度(79.71±6.12)kPa(图2C~D)。
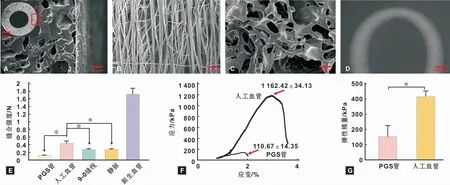
图1 PGS/PCL人工血管的微观结构和机械力学性能Fig 1 The microstructure and machinery mechanics of the PGS/PCL artificial vessel
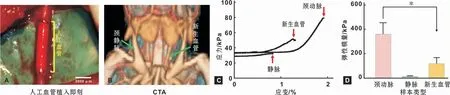
图2 PGS/PCL人工血管植入大鼠颈动脉后观察Fig 2 Observation of the PGS/PCL artificial vessel after transplantation in carotid artery of rats
2.3 PGS/PCL人工血管在体内改建成了几乎完全细胞化的肌性血管
HE染色可以发现,12个月后,PGS/PCL人工血管已经几乎完全发生了细胞化的改建,可见及细胞外基质整齐地沿圆周方向排列,形成了与自体血管类似的三层管壁结构,即内皮细胞层,平滑肌层以及疏松的外膜层(图3 A、D)。新生血管DNA含量(2.36±0.35)μg/mg与自体血管的DNA含量(2.57±0.26)μg/mg没有统计学差异(n=5,P>0.05)(图4I)。
α-SMA和MHC是平滑肌细胞的标记性蛋白,免疫荧光染色发现新生血管中膜层分布着大量的SMA和MHC阳性表现的平滑肌细胞整齐地沿着圆周方向排列着(图3B~C、E~F)。
新生血管的SEM影像证实管腔内层覆盖有一层平滑完整的内皮细胞层,其上未发现明显的血小板聚集和血栓形成(图3H~I)。在新生血管与自体血管的连接处覆盖有一层平滑连续的内皮细胞,连接处有缝线作为标记(图3G)。
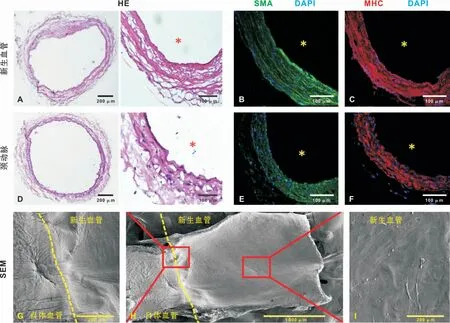
图3 移植后12个月PGS/PCL人工血管的大鼠体内改建Fig 3 Remodeling of the PGS/PCL artificial vessel 12 months after transplantation
2.4 新生血管沉积了适量的功能性细胞外基质
免疫荧光染色提示新生血管里弹性蛋白的高表达,且按照圆周方向排列(图4C、F)。定量分析说明新生血管中弹性蛋白含量(10.06±1.92)μg/mg高于自体静脉血管中弹性蛋白的含量(5.72±0.76)μg/mg,新生血管弹性蛋白的含量接近自体动脉弹性蛋白的含量(13.51±1.18)μg/mg,但仍有统计学差异(图4H)。免疫荧光染色提示了新生血管中Ⅰ型胶原和Ⅲ型胶原的表达强度和排列方式均类似于自体动脉(图4A~B、D~E)。胶原蛋白定量分析示新生血管中胶原蛋白的含量(51.76±7.21)μg/mg与自体动脉血管中胶原蛋白的含量(58.73±3.24)μg/mg以及自体静脉血管中胶原蛋白的含量(55.34±5.42)μg/mg无统计学差异(图4G)。
3 讨 论
目前临床上常用于血管置换的自体血管和成品人工血管的所存在的局限性,影响并限制着颈动脉等一些血管移植手术的开展[12]。而无细胞植入的组织工程多数集中在慢降解的高分子聚合物材料的研究上[13-16]。而材料的长期残留会因为反生纤维包裹而是组织变硬钙化,另外也会激活炎性细胞而引起内膜的增生[17]。而本研究使用了快速降解的PGS弹性体作为主体材料构建成人工血管,另外外层辅以一层菲薄的PCL纳米纤维材料来增强机械力学强度,植入体内后随着PGS的快速降解为募集细胞的分化和生长增殖提供了相应的空间,而细胞的增殖和细胞外基质的分泌又可以弥补PGS降解所损伤的机械力学强度。
PCL属于慢降解材料,纳米纤维材料在体内至少保留1年以上[10],这为募集细胞的分化生长提供了稳定的力学环境。因为颈动脉位于颈部,其活动方式及活动度的特殊性,以及颈动脉血流速度相对于腹主动脉慢,因此替换颈动脉的血管移植体在血流速度相对较慢的情况下,需要承受更多的拉升扭曲等特殊情况下对于其通畅率的及细胞化的考验。如前述的结果表明PGS/PCL人工血管可以实现颈动脉的肌性功能性的重建,在体内可以改建成为大体结构和组织学方面均与自体颈动脉相似的动脉血管,具有临床应用前景。
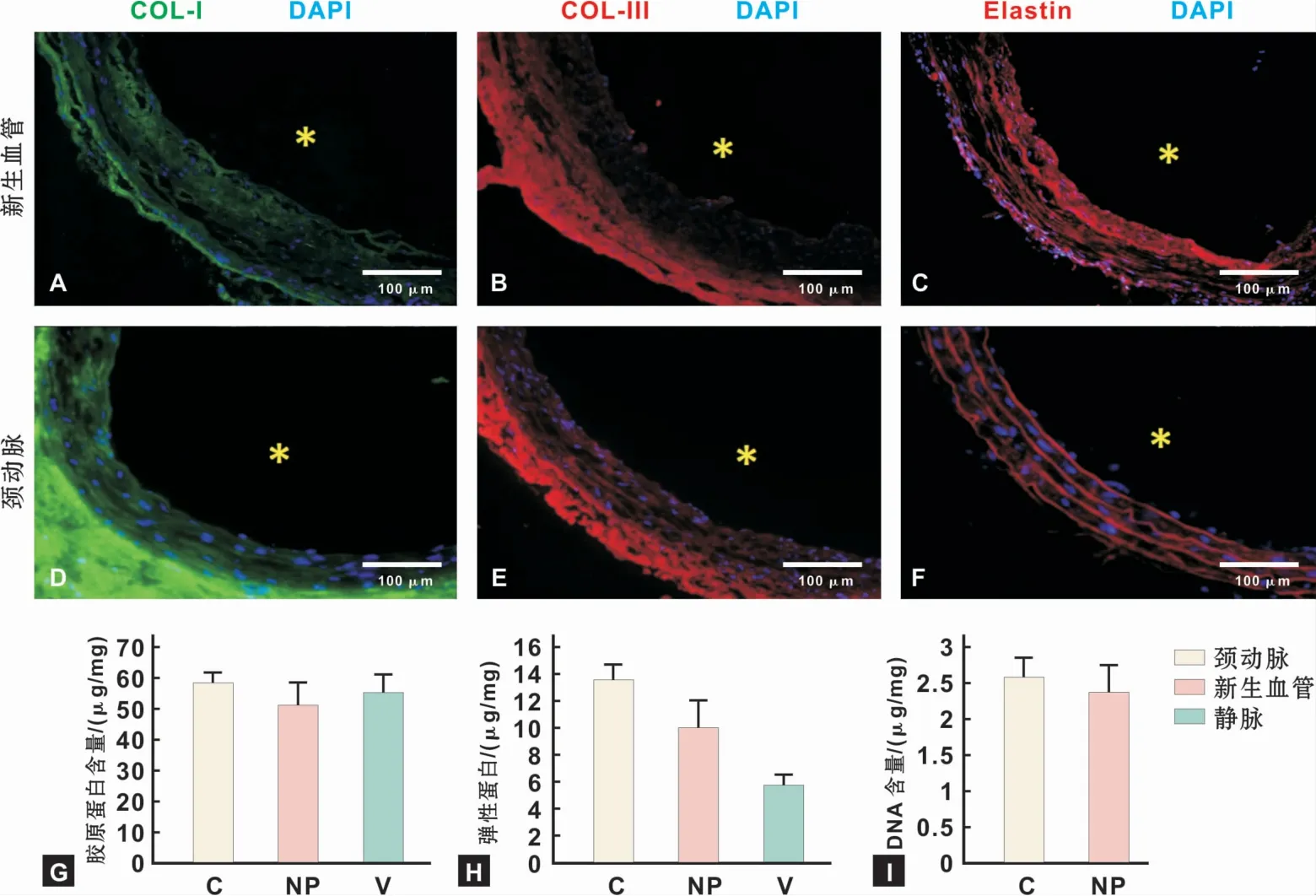
图4 新生血管的生物学功能Fig 4 Biofunction of the newly reformed vessel
由于大鼠具有更强的重建潜能以及大鼠的内皮细胞具有更强的覆盖高分子材料等表面的能力,特别是相较老年人来说[18-19]。因此,进一步研究大动物体内的内皮化程度和外科手术安全性的问题是非常重要的。同时,细胞来源以及细胞分化机理的研究也是下一步研究的重点。

