预冷温度对冰温罗非鱼片品质的影响
金 枝 关志强 - 李 敏
(1. 广东海洋大学食品科技学院,广东 湛江 524088;2. 广东省水产品加工与安全重点实验室, 广东 湛江 524088;3. 水产品深加工广东普通高等学校重点实验室,广东 湛江 524088;4. 广东海洋大学机械与动力工程学院,广东 湛江 524088)
罗非鱼亦称非洲鲫鱼,主要在中国广东、广西、福建等省被大规模养殖,其肉质鲜美,口感颇佳,富含优质蛋白与多不饱和脂肪酸及钙、磷、锌、铁等矿物质,被消费者广泛认可与接受[1]。现中国市场上罗非鱼多以活鱼或鲜鱼片的形式销售,宰杀后的罗非鱼因其营养物质丰富且水分含量高而易受微生物侵袭,加上自身内源酶的作用,鱼肉品质会发生劣变,导致营养价值降低[2]。传统冷藏或冷冻等贮藏方法下的食品已不能满足人们对食物新鲜、营养的需求,冰温保鲜技术由此运用而生。冰温保鲜技术也被称为冰温贮藏技术,是将食品在其冰温带的范围内贮藏,融合了冷冻、冷藏技术的优点,可以有效抑菌和维持食品鲜度,又克服了冷冻导致的食品蛋白质变性、汁液流失及冷藏货架期短的不足[3-4]。刚宰杀的鱼类体温处于常温状态,运输和贮藏过程中鱼肉的糖原分解放热,使鱼体温度升高2~10 ℃,若不能及时冷却排除这部分热量,酶和微生物的活动就会大大增强,故需要合适的方式加快鱼肉到达冰点温度的进程,使其快速进入冰温环境以保持品质。
预冷处理多应用于果蔬保鲜贮藏的前处理。果蔬经预冷处理除去了田间热,使得水分含量和机体代谢水平降低,减小自身能量消耗,从而延长保质期[5]。预冷处理在水产品保鲜方面已有报道,蓝蔚青等[6]使用流化冰预冷处理鲈鱼,发现流化冰预冷处理可以有效减缓鲈鱼的腐败进程。郭学骞等[7]用冰水浸渍预冷与冻藏结合处理罗非鱼片,发现经预冷处理后的鱼片贮藏品质得到了明显改善。黄卉等[8]研究鲜活鲈鱼在不同水温中预冷后进行冰藏的品质变化,结果显示预冷处理能延缓鲈鱼冰藏时色泽变化,可以较好地保持鱼肉的亮度和红度值。而将预冷处理与冰温技术结合应用于罗非鱼的保鲜贮藏研究甚少,姚志勇等[9]利用自行研制的装置研究了真空冷诱导对罗非鱼片冰温贮藏时鲜度和滋味的影响,真空预冷处理可使鱼片保持较好的品质,但需要相应的真空设备,而且耗能较大,约比冷风冷却高1%~2%[10]。
根据当前工业生产冷冻肉常用的冻结温度(-18~ -38 ℃)并参考相关文献[11-12],本试验拟设置-18,-30,-60 ℃ 3个不同预冷处理温度,以新鲜罗非鱼片为原料,采用冰温贮藏的方式,考察经不同预冷处理温度(-18,-30,-60 ℃)后的罗非鱼片在冰温贮藏过程中pH、色泽、质构特性、挥发性盐基氮(TVB-N)、菌落总数、硫代巴比妥酸值(TBA)、钙离子酶活(Ca2+-ATPase)等品质指标的变化,为罗非鱼片冰温保鲜工艺的改善提供理论依据。
1 材料与方法
1.1 材料与试剂
罗非鱼:购于湛江市湖光市场;
Ca2+-ATPase活性测试盒、考马斯亮蓝蛋白测定试剂盒:南京建成生物工程研究所;
2-硫代巴比妥酸:化学纯,国药集团化学试剂有限公司;
平板计数琼脂培养基:北京陆桥技术有限责任公司。
1.2 仪器与设备
多路温度巡检仪:JK-24U型,常州市金艾联电子科技有限公司;
电子天平:JJ600型,常熟市双杰测试仪器厂;
分析天平:AUY220型,日本岛津仪器有限公司;
真空包装机:DZ400/2D型,瑞利包装机械有限公司;
pH计:PHS-3C型,上海仪电科学仪器有限公司;
色差计:CR-10型,日本柯尼卡美能达公司;
质构仪:TMS-Pro型,美国FTC公司;
凯氏定氮仪:Vap450型,德国Gerhardt公司;
电热恒温培养箱:HPX-9082MBE型,上海博迅实业有限公司;
超净台:SW-CJ-2D型,苏州净化设备有限公司;
立式压力蒸汽灭菌器:LDZX-50KBS型,上海申安医疗器械厂。
1.3 试验方法
1.3.1 样品处理 敲击头部使罗非鱼致死,除去头、尾、鱼皮及内脏,用无菌水冲洗洁净,切分为12 cm×5 cm×1 cm 的鱼片,重量(80±2) g。随后将鱼片分别放入-60,-30,-18 ℃冰箱中进行预冷处理,使用温度巡检仪探测鱼片温度,当罗非鱼片中心温度达到-1 ℃时停止预冷,不同预冷温度条件下鱼片中心温度降至-1 ℃所需时间如表1所示。预冷结束后对鱼片进行真空包装,置于-2 ℃条件下贮藏。未经预冷处理的鱼片作为对照组,真空包装后直接进行-2 ℃贮藏,每隔5 d测定相关品质指标。
1.3.2 冰点的测定 采用冻结法[13]。
1.3.3 pH的测定 根据段伟文等[14]方法进行测定。
1.3.4 色泽的测定 使用手持色差仪测定鱼片的亮度(L*)、红绿度(a*)、黄蓝度(b*),每片鱼片重复测定10次,结果取平均值。

表1 罗非鱼片预冷处理温度及时间
1.3.5 质构测定 参照刘铁玲等[15]方法并进行修改。使用直径平底柱探头P/5,采用质地剖面分析(TPA)模式对试样进行测定。参数条件设置为感应力1 000 N,测试速度60 mm/min,起始力0.5 N,形变量50%,两次下压间隔1 s。每块鱼片测定5次,结果取平均值。
1.3.6 菌落总数的测定 参考GB/T 4789.2—2016并适当修改。准确称取10 g绞碎鱼肉于90 mL无菌生理盐水中,均质充分后10倍系列稀释,选择数个适宜稀释度的样品均液1 mL倾注营养琼脂平板,待平板凝固后于(30±1) ℃条件下培养72 h后,统计各平板菌落数。
1.3.7 挥发性盐基氮(TVB-N)的测定 按照GB 5009.228—2016采用自动凯氏定氮仪法。
1.3.8 硫代巴比妥酸(TBAS)值的测定 参照Lan等[16]方法并稍作修改。称取10 g绞碎鱼肉与40 mL预冷的5%三氯乙酸混合,10 000 r/min均质1 min,然后5 000 r/min 冷冻离心5 min,过滤上清液,吸取 5 mL滤液于比色管中,随即加入0.02 mol/L硫代巴比妥酸试剂5 mL,并充分混匀,于沸水中反应30 min取出,流动水冷却到室温(约15 min)。以蒸馏水为参照,532 nm处测定溶液的吸光值。按式(1)计算TBA值。
TBA=7.8×A,
(1)
式中:
TBA——硫代巴比妥酸值,mg MDA/kg;
A——溶液在532 nm处的吸光值;
7.8——常数。
1.3.9 Ca2+-ATPase酶活测定 根据南京建成公司的ATP酶测试盒说明书进行测定。
1.4 数据处理
采用Excel 2007进行数据记录和整理,使用SPASS 18.0软件进行统计分析,显著水平设置为P<0.05,Origin 9.0软件绘图。试验结果为3次平行试验平均值。
2 结果与分析
2.1 罗非鱼片冰点测定结果分析
由图1可知,冻结曲线主要分为降温、结晶、冻结3个阶段。降温阶段鱼片温度由室温快速下降至自由水冻结温度0 ℃附近,并有大量热量放出;50~120 min为第二区间结晶阶段,温度不断下降至冻结点,鱼肉中的水分开始冻结,温度下降速度变慢,曲线呈现较为平缓状态,此温度范围即罗非鱼片冰点温度范围。冻结阶段鱼片温度从冻结点附近继续下降至外界介质温度,根据冰点测定原理,确定本试验罗非鱼的冰点温度范围为-1.3~-1.8 ℃。根据罗非鱼片冻结曲线选择-2 ℃进行冰温贮藏研究。
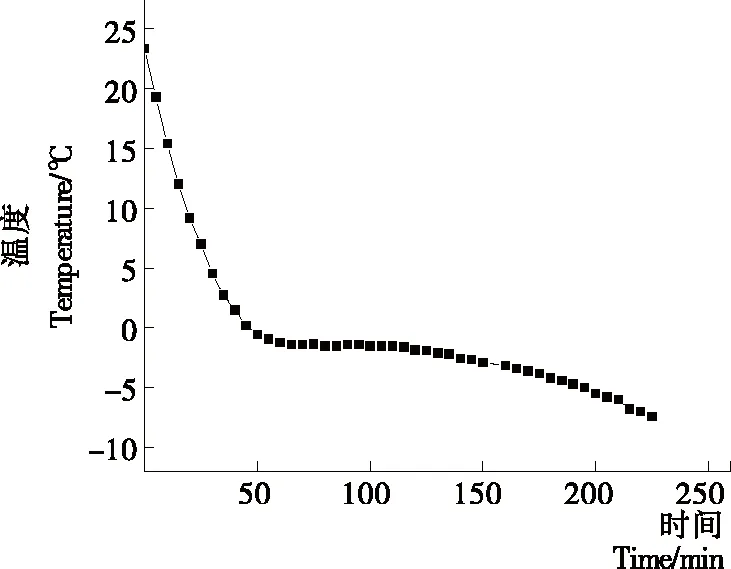
图1 罗非鱼片的冻结曲线
2.2 对罗非鱼片pH的影响
由图2可知,罗非鱼片的pH值总体呈现贮藏前期下降后期回升的趋势。贮藏前10 d,由于鱼片自身的生化反应,作为能量源储存的糖原被快速分解成乳酸及ATP分解磷酸根离子导致pH值下降。随后pH值出现回升,可能是微生物大量繁殖产生代谢物质,同时微生物将鱼肉中的蛋白质分解,产生了碱性物质[17]。刚宰杀的新鲜罗非鱼pH值接近中性为6.92,贮藏末期各预冷处理组鱼片pH值分别为6.64(-18 ℃),6.70(-30 ℃),6.67(-60 ℃),对照组鱼片的pH值上升至6.76,较预冷处理组回升显著(P<0.05),表明预冷处理可以减缓鱼片pH值的回升。
2.3 对罗非鱼片色泽的影响
试验表明,不同预冷处理组和对照组的鱼片在贮藏过程中L*值整体呈上升趋势。贮藏前10 d,预冷处理组鱼片L*值分别上升至44.18,44.12,43.73,处理组间L*值相差不大。贮藏第20天,对照组鱼片的L*值与预冷处理组相比明显偏大,经过-30,-60 ℃预冷处理鱼片的L*显著低于对照组,表明较低温度预冷处理可以延缓鱼片亮度的增加。
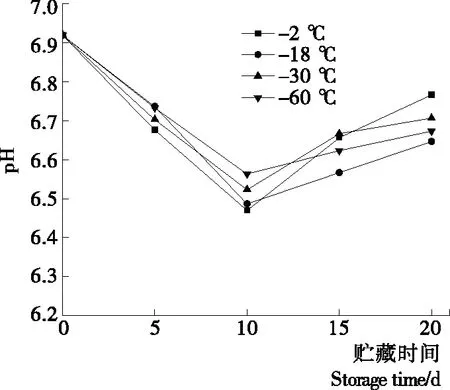
图2 预冷条件对罗非鱼片pH的影响
Figure 2 Effects of different pre-cooling temperature on pH value oftilapiafillets during storage
由表2可知,不同预冷处理组和对照组鱼片在贮藏过程中a*值整体呈下降趋势。贮藏前5 d,预冷处理组鱼片a*值下降幅度显著高于对照组鱼片,可能是对照组鱼片的脂肪氧化程度大于预冷处理组,产生了更多的脂质过氧化物,使得更多高铁肌红蛋白的产生和积累,从而对照组鱼片a*值下降更明显。在贮藏第20天时,预冷处理组鱼片与对照组鱼片相比,彼此间红度值并无显著差异(P>0.05),可能是末期各组鱼片微生物大量繁殖,蛋白质变性程度增大,各鱼片的高铁肌红蛋白积累量相近,因此差异不显著。对照组鱼片a*值与鲜鱼片相比下降了54%,表明肉色已发暗褐变。
2.4 对罗非鱼片质构的影响
由图3可知,各项指标的数值均随贮藏时间的延长不断下降。各鱼片硬度在贮藏前期下降幅度较大,后期趋于平缓,贮藏末期,对照组鱼片硬度由起始的6.50 N下降至2.06 N,硬度呈显著性下降。不同温度预冷处理的鱼片硬度未体现出显著差异(P>0.05)。胶黏性和咀嚼性的变化趋势与硬度基本相同。对照组与各预冷处理组鱼片胶黏性在贮藏末期无显著差异(P>0.05),但各预冷处理组鱼片咀嚼性显著高于对照组(P<0.05),且-30,-60 ℃预冷处理鱼片的咀嚼性高于-18 ℃预冷处理的。弹性随贮藏时间的增加持续下降。贮藏前10 d,预冷处理组鱼片弹性略优于对照组,但之后对照组鱼片弹性下降速率有所减缓。贮藏第20天,对照组鱼片弹性大于预冷处理组(P<0.05),说明预冷处理会对弹性造成一定影响。有文献[18]指出,水产品在贮藏过程中肌原纤维间的空隙增大,蛋白质降解变性,肌肉细胞间结合力减弱,是导致肌肉质构不断劣化的根本原因。
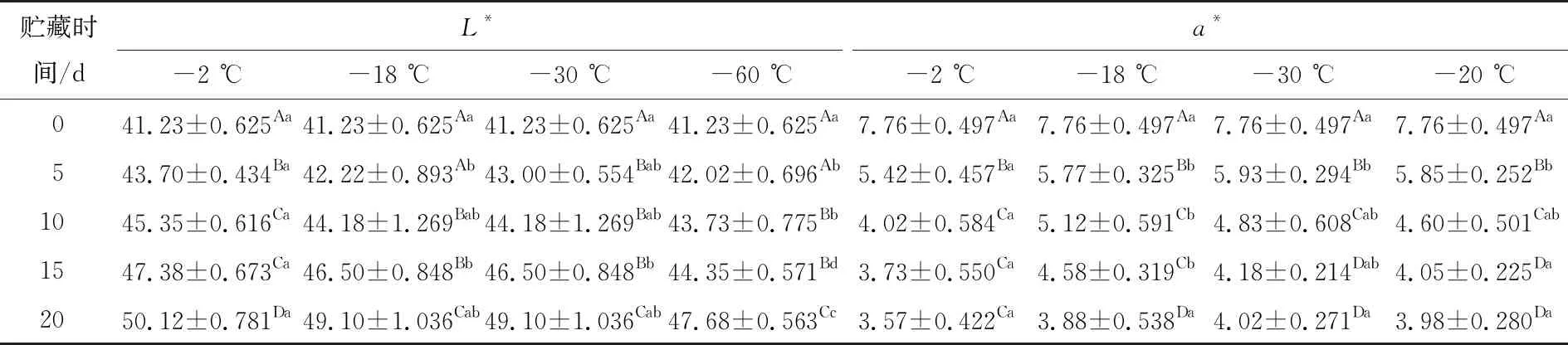
表2 不同预冷条件对罗非鱼片色泽的影响†
† 同列大写字母不同表示差异显著(P<0.05);同行小写字母不同表示差异显著(P<0.05)。
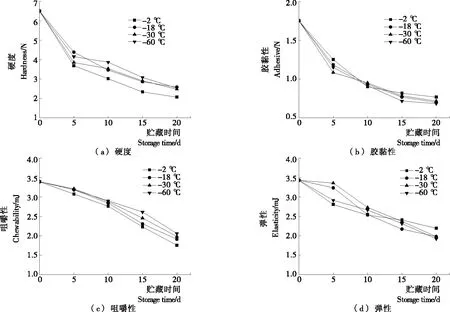
图3 预冷条件对罗非鱼片质构的影响
2.5 对罗非鱼片菌落总数的影响
由图4可知,预冷处理组和对照组鱼片细菌总数始终呈现出持续上升的变化,但预冷处理组鱼片微生物的增长速率较慢。贮藏第10天,对照组细菌增长到5.89 lg(CFU/g),接近生鲜水产品菌落总数限量规定(限值106CFU/g)[19]。对照组鱼肉已接近次鲜肉,而预冷处理组鱼肉细菌总数<<106CFU/g。贮藏第20天,对照组和各预冷处理组鱼肉均已腐败变质不具可食性。通过菌落总数限量标准判定对照组鱼片货架期为11 d,预冷处理组鱼片货架期分别为15 (-18 ℃),17 (-30,-60 ℃) d,低温预处理后可大大提高冰温罗非鱼片货架期。低温可以降低微生物体内代谢酶活力和各种生化反应速率,并导致微生物细胞内原生质体浓度和黏度增加,从而影响其新陈代谢[20-21],但低温贮藏过程中仍会有许多嗜冷性细菌繁殖,同样会影响鱼肉品质[22],因此-2 ℃温度贮藏条件下微生物仍会大量繁殖。而极低温度预冷处理组鱼片,表面微生物生长代谢遭破坏,生长速率有所减慢,因此,-30,-60 ℃预冷处理组与对照组相比,细菌总数增长趋势稍显缓和。不同的预冷速率导致鱼片的水分含量及水分活度不同,预冷温度越低鱼片的水分活度越小[23],因此,-30,-60 ℃预冷处理组抑制微生物生长的效果优于-18 ℃预冷处理组。
2.6 对罗非鱼片TVB-N值的影响
由图5可知,TVB-N值整体呈连续增长趋势,但不同温度预冷处理组鱼片TVB-N值上升幅度较对照组小。贮藏第15天,对照组罗非鱼片TVB-N值由初始值的9.88 mg/100 g 升至19.97 mg/100 g(GB 2733—2015规定限值为20 mg/100 g),即将进入腐败状态,而于-18,-30,-60 ℃预冷处理组分别为18.44,17.82,16.79 mg/100 g,对照组鱼肉腐败程度明显高于预冷处理组(P<0.05)。贮藏第20天,对照组鱼片已完全腐败变质,TVB-N值达23.55 mg/100 g,而-30 ℃ 预冷处理组为19.84 mg/100 g,-60 ℃预冷处理组为18.82 mg/100 g,仍在安全标准范围内。可能是不同的预冷速率导致鱼片水分含量及水分活度不同,预冷温度越低鱼片的水分活度越小[23],因而-60 ℃预冷处理组抑制微生物的生长效果优于其余两个预冷处理组,由此减慢了鱼片的腐败速度,抑制了TVB-N的增长,与菌落总数的增长趋势一致。
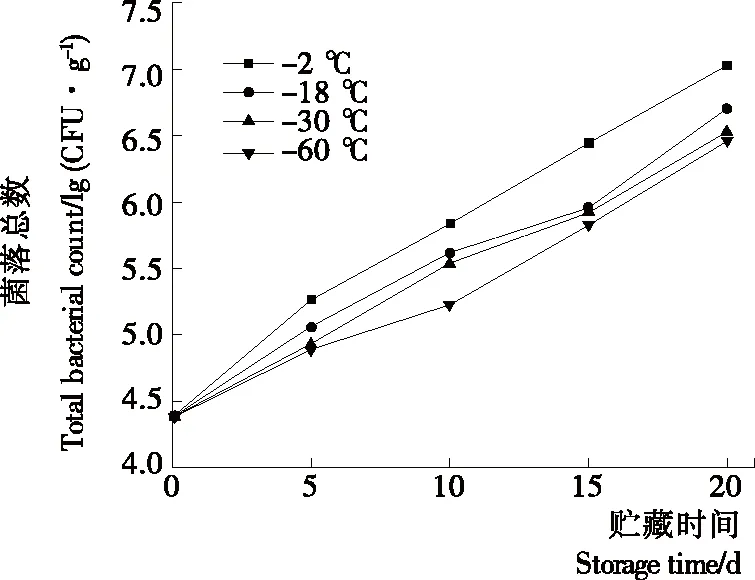
图4 不同预冷条件下罗非鱼片菌落总数的变化
Figure 4 Effects of different pre-cooling temperature on total bacterial count oftilapiafillets during storage
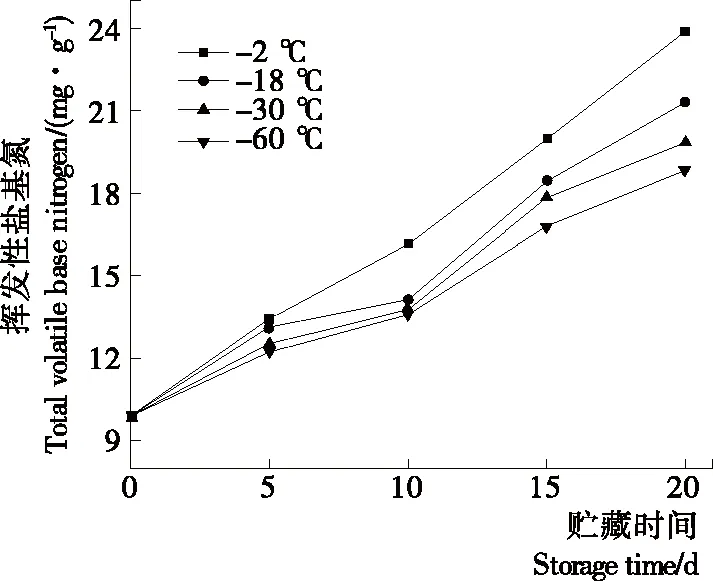
图5 不同预冷条件下罗非鱼片TVB-N值的变化
Figure 5 Effects of different pre-cooling temperature on TVB-N oftilapiafillets during storage
2.7 对罗非鱼片TBA值的影响
由图6可知,新鲜罗非鱼片脂肪氧化程度极低,TBA值仅为0.229 mg MDA/kg。随着贮藏的进行,鱼片的TBA值逐渐上升,贮藏末期稍微有所下降。贮藏15 d时,鱼片的TBA值上升至0.684(-2 ℃),0.556(-18 ℃),0.504(-30 ℃),0.494(-60 ℃) mg MDA/kg,其中对照组鱼肉的TBA值增加了0.455 mg MDA/kg,而-60 ℃预冷组鱼片的TBA值增加了0.265 mg MDA/kg,预冷处理组鱼片氧化程度远小于对照组。贮藏末期鱼片TBA值出现下降,可能是脂肪氧化产物丙二醛(MDA)与鱼肉中的蛋白质发生了作用[24],丙二醛与蛋白质的结合速率大于其产生速率,因此出现了下降趋势。但预冷处理组鱼片脂肪氧化的程度始终低于对照组且差异明显,表明预冷处理可以减缓鱼肉脂肪氧化的速率。
2.8 对罗非鱼片Ca2+-ATPase的影响
由图7可知,冰温贮藏过程中预冷处理组与对照组鱼片Ca2+-ATPase均呈下降趋势。在低温贮藏过程中,鱼肉pH下降、微生物繁殖、脂肪氧化等因素变化打破了蛋白质相对的稳定体系,引起肌球蛋白头部区域的构象发生改变,从而使肌原纤维蛋白Ca2+-ATPase活性下降[25]。贮藏第20天,对照组鱼片Ca2+-ATPase为0.252,与初始值相比下降了80.4%,而预冷处理组鱼片降幅分别为77.9%,74.36%,71.32%,说明鱼肉在贮藏过程中蛋白质发生了明显的变性。试验中预冷处理能对鱼肉Ca2+-ATPase活性的下降起一定延缓作用,可能是较低预冷温度减缓了蛋白质分子的二级结构由紧密向松散发展的进程,降低了蛋白变性速率[26]。其中-60 ℃预冷处理显著优于-18 ℃,而-30,-60 ℃两组间无显著差异。
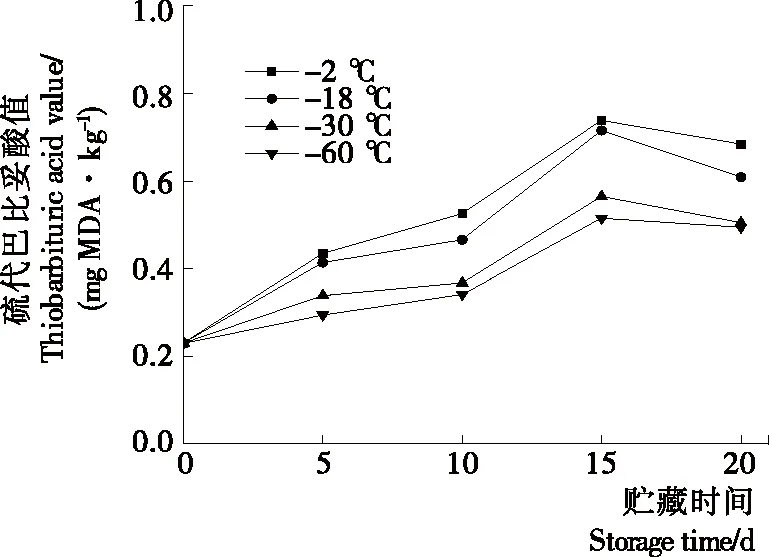
图6 不同预冷条件下罗非鱼片TBA值的变化
Figure 6 Effects of different pre-cooling temperature on TBA oftilapiafillets during storage
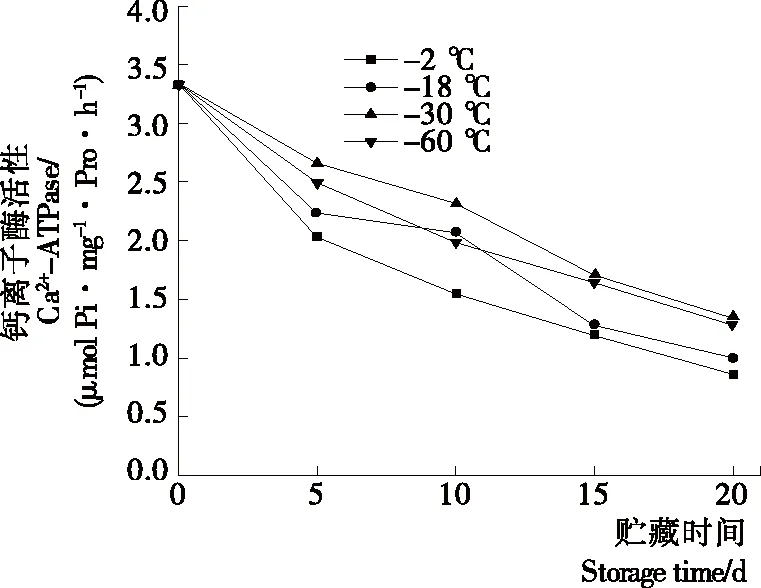
图7 不同预冷条件下罗非鱼片Ca2+-ATPase的变化
Figure 7 Effects of different pre-cooling temperature on Ca2+-ATPase oftilapiafillets during storage
3 结论
试验探究了不同温度预冷处理的罗非鱼片在冰温贮藏过程中的品质变化。通过分析发现,相比单纯冰温贮藏,预冷处理可以保护鱼片色泽,延缓鱼片亮度的增加,抑制pH值的回升。预冷温度越低,抑制微生物繁殖作用越明显,挥发性盐基氮及脂肪氧化上升趋势越缓慢,钙离子酶活的下降速率也相对较缓和。-18 ℃与-60 ℃ 预冷处理相比,菌落总数、TVB-N、TBA值、Ca2+-ATPase差异显著,后者处理的鱼片有更好的贮藏品质,-30 ℃预冷处理的鱼片品质介于两者之间,但温度过低会造成鱼片弹性变差,在考虑成本的情况下,建议将预冷处理温度设在-30 ℃左右,可使鱼片保持较好的质地。综上,在冰温罗非鱼生产前进行预冷处理,可为罗非鱼片冰温保鲜工艺的改善提供技术支持。基于当前的研究,后续还可探讨预冷处理的罗非鱼片在冰温贮藏过程中各种营养成分、微观结构的变化以及优势腐败菌的情况。

