转录因子FOXO1和干细胞标志物CD133与神经母细胞瘤临床病理因素相关性
王芳
(渮泽医学专科学校内科学教研室,山东 菏泽 274000)
肿瘤干细胞是存在于肿瘤中的具有干细胞特性的细胞,文献报道发现在神经母细胞瘤(NB)组织和细胞中存在肿瘤干细胞〔1,2〕,而且NB恶化程度与肿瘤干细胞的比例密切相关〔3〕。CD133作为肿瘤干细胞标志物,广泛应用于神经干细胞及肿瘤干细胞的分选及鉴定。叉头框转录因子O亚族(FOXO)1作为肿瘤抑制转录因子,广泛存在于人体组织器官,如心、脑、胎盘、肺、肝、骨骼肌、前列腺、卵巢、小肠、结肠、外周血白细胞等〔4〕。在肿瘤组织如NB、前列腺癌〔5〕、乳腺癌〔6〕、肝癌〔7〕等中表达下调,参与肿瘤组织发生发展。既往研究发现FOXO1参与神经干细胞〔8〕和精原干细胞〔9〕干性维持,但有关FOXO1调控NB细胞分化的研究目前尚无报道。本研究通过免疫组化及Western印迹法检测不同临床分期、病理类型NB组织中FOXO1和CD133表达情况,并分析两者的相关性。
1 材料和方法
1.1临床材料及标本采集 选取菏泽医学专科学校附属医院病理科2012年5月至2017年8月入院经术后切除NB石蜡组织块标本53例为病例组,均通过组织病理学检查确诊。另选取癌旁正常组织27例为对照组。病例组临床分期:其中1期12例、2期10例、3期13例、4期10例,4S期8例。
1.2试剂及耗材 FOXO1兔抗人单克隆抗体购自美国Santa Cruz公司,兔抗人CD133单克隆抗体购自Abcam公司,免疫组织化学SP染色试剂盒二氨基联苯胺(DAB)显色剂购于北京中杉金桥生物有限公司。
1.3免疫组化染色 每个石蜡包块连续切片5张,每张切片放置两片组织、厚度4~5 μm,1张行苏木素-伊红(HE)染色复查诊断。采用SP法进行组织染色,实验操作按照试剂盒使用说明书进行:组织切片使用二甲苯脱蜡8 min×3次,应用不同浓度梯度乙醇溶液水化组织切片后在蒸馏水中洗涤3 min×3次,加入高压锅于121℃×5 min高压抗原修复并自然降温至室温,磷酸盐缓冲液(PBS)洗涤后加入0.3%过氧化氢阻断组织内源性过氧化物酶活性处理30 min,PBS洗涤后滴加一抗4℃孵育过夜,PBS清洗10 min×3次,滴加二抗常温孵育1 h,PBS清洗10 min×3次,滴加DAB显色液显色,苏木素复染后脱水、封片。阴性对照为使用PBS代替一抗处理组织切片。
1.4免疫组化结果判定 免疫组化染色处理组织切片,置于显微镜下观察拍照。FOXO1以胞核染色棕色者表示阳性,CD133以胞膜染色棕色者表示阳性。随机选取高倍镜(400倍)3~4个视野拍照,统计不同视野下100个肿瘤细胞中FOXO1或CD133表达阳性细胞数,依据FOXO1或CD133表达阳性细胞所占比例判断NB的FOXO1或CD133表达水平:其中阴性(-)<5%、弱阳性(+)6%~25% 、 中度阳性()26%~50% 、 强 阳 性()>50%。
1.5Western印迹检测组织中FOXO1和CD133蛋白表达 两组组织切小块置入研磨器中,加入RIPA蛋白裂解液研磨,转移至1.5 ml离心管,震荡混匀30 s,冰上静置10 min,4℃、15 000 r/min离心15 min,提取上清总蛋白后重复上述离心,提取上清总蛋白。留取5 μl定量,其余加入6×上样缓冲液(1∶5体积比)后在沸水中煮沸5 min变性。取30 μg蛋白上样,10%十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)进行电泳分离,用110 V电压2 h将凝胶上的蛋白转至硝酸纤维素(NC)膜上。50 g/L脱脂奶粉将膜封闭1 h后,将膜置于特定一抗,4℃摇床上孵育过夜。次日使用TBST洗膜液10 min/次洗3次并置于相应的二抗,常温摇床慢速孵育1 h,10 min/次洗3次后使用电化学发光(ECL)显影液进行显影,目的蛋白表达量通过与内参蛋白β-actin标准化后得到相对比值。
1.6统计学分析 使用SPSS19.0软件进行多因素方差分析、χ2检验、Pearson相关性分析。
2 结 果
2.1两组FOXO1和CD133蛋白表达 免疫组化结果显示,FOXO1蛋白染色阳性呈棕黄色颗粒,主要定位于细胞核,少数胞质中亦可见表达。在病例组中有21例表达阳性者,阳性率为39.6%(21/53),其中弱阳性(+)8例,中度阳性()8例,强阳性()5例。FOXO1蛋白在对照组中有19例表达阳性者,阳性率为70.4%(19/27),其中弱阳性(+)5例,中度阳性()7例,强阳性()7例。见图1。对照组FOXO1蛋白表达阳性率显著高于病例组(P<0.05)。经免疫组化染色发现,CD133蛋白阳性棕黄色颗粒主要定位于胞膜及胞质中,在病例组中阳性表达率为64.2%(34/53),弱阳性(+)14例,中 度 阳 性()8例,强阳性()12例。同时,CD133蛋白在对照组中阳性率为37.0%(10/27),其中弱阳性(+)4例,中度阳性()3例,强阳性()3例,见图1。病例组中CD133阳性率显著高于对照组(P<0.05)。
2.2病例组FOXO1和CD133表达阳性率与病理指标的关系 病例组不同临床分期、病理分型及组织类型FOXO1、CD133表达阳性率差异有统计学意义(P<0.05)。见表1。

图1 两组FOXO1和CD133阳性表达(×400)
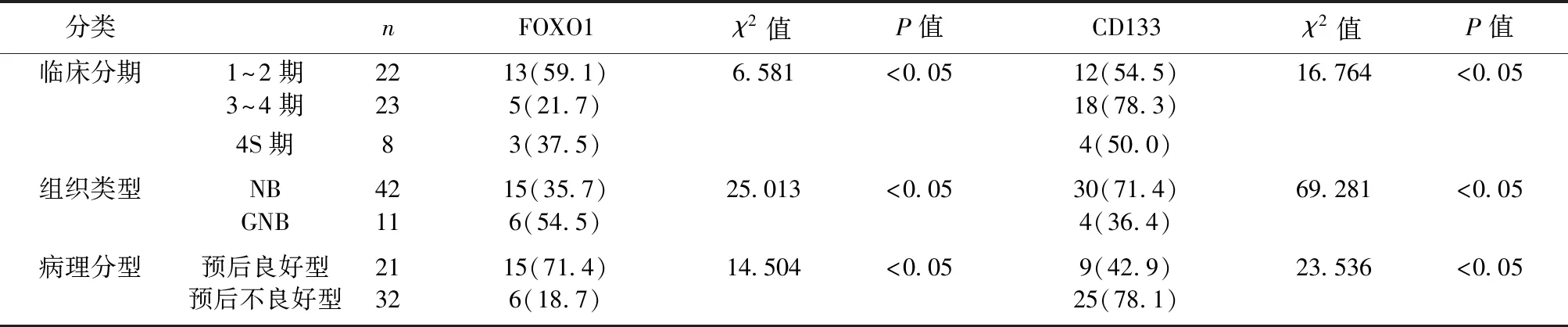
分类nFOXO1χ2值P值CD133χ2值P值临床分期1~2期2213(59.1)6.581<0.0512(54.5)16.764<0.053~4期235(21.7)18(78.3)4S期83(37.5)4(50.0)组织类型NB4215(35.7)25.013<0.0530(71.4)69.281<0.05GNB116(54.5)4(36.4)病理分型预后良好型2115(71.4)14.504<0.059(42.9)23.536<0.05预后不良好型326(18.7)25(78.1)
2.3Western印迹检测FOXO1和CD133蛋白表达 NB组织未检测到FOXO1蛋白表达或表达极弱,而癌旁组织中FOXO1不同程度表达;NB组织CD133不同程度表达,而癌旁组织中CD133表达明显减弱,见图2。进一步经Image-J软件灰度值分析提示,NB组织和癌旁组织中FOXO1、CD133表达差异具有统计学意义(P<0.05)。见表2。
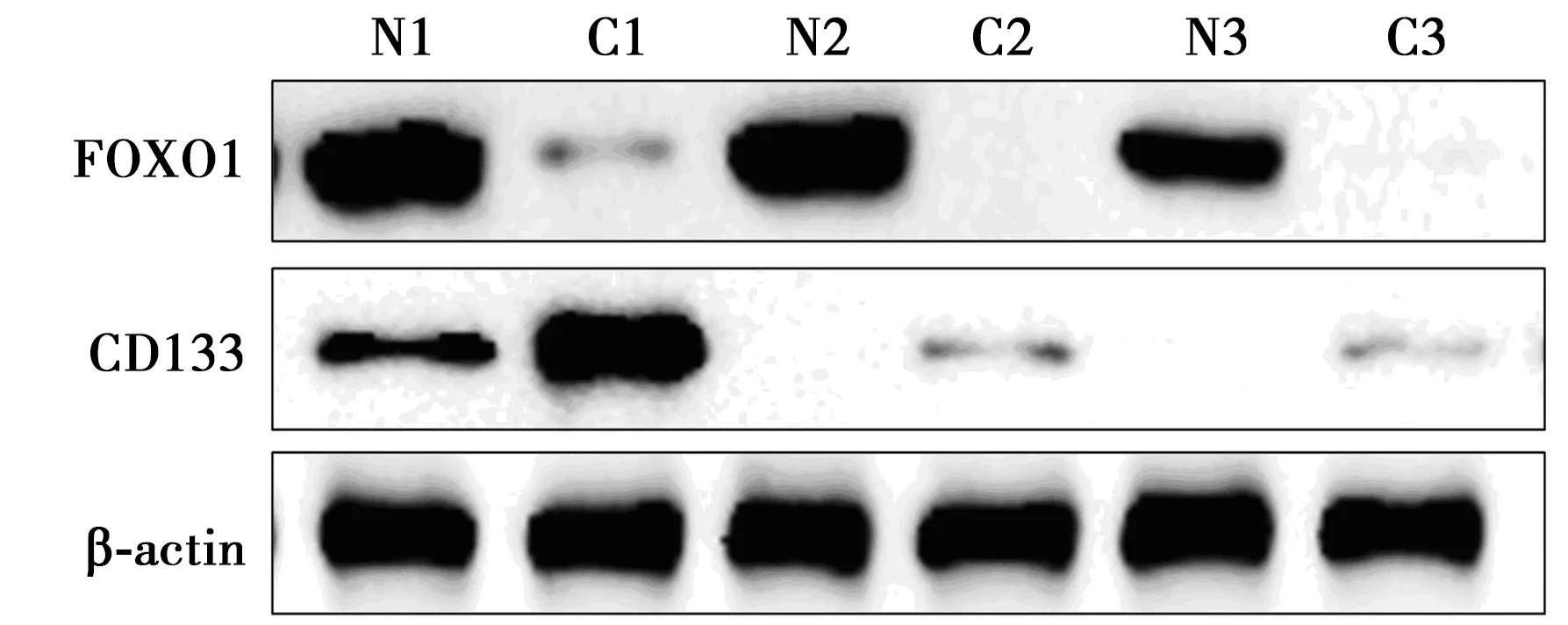
N1、N2、N3:癌旁组织;C1、C2、C3:NB组织;表2同图2 Western印迹检测FOXO1、CD133表达

组别FOXO1CD133N10.98±0.031.05±0.03C10.21±0.021)2.04±0.031)N20.97±0.021.07±0.04C20.05±0.012)7.75±0.142)N30.98±0.031.00±0.01C30.04±0.013)6.68±0.173)
与N1组比较:1)P<0.05;与N2组比较:2)P<0.05;与N3组比较:3)P<0.05
2.4FOXO1和CD133表达的相关性分析 53例NB患者中FOXO1和CD133表达均阳性者为7例,均阴性者5例;FOXO1表达阳性,CD133表达阴性者18例;FOXO1表达阴性,CD133表达阳性者23例。经过Pearson等级相关分析:FOXO1和CD133的表达呈显著负相关(r=-0.68,P<0.05)。
3 讨 论
肿瘤干细胞具有无限增殖、多向分化潜能和高度自我更新能力,常是引起肿瘤异质性的重要因素〔10〕。肿瘤干细胞数量较少,然而可在肿瘤的发生、转移、复发及后期肿瘤耐药中起到重要作用。研究发现肿瘤干细胞存在于NB中,Meany等〔11〕对41例NB细胞使用Hoechst染料进行染色处理,通过流式细胞仪方法对NB肿瘤细胞进行干细胞分选处理,在18例NB肿瘤细胞成功筛选出干细胞群。因此,深入研究NB干细胞发生及发展机制,对于NB治疗和预防将具有重要意义。
FOXO1蛋白在多种肿瘤中异常表达,是胰岛素/胰岛素样生长因子信号通路的关键分子,上游受磷脂酰肌醇-3-激酶(PI3K)/蛋白激酶B(AKT)磷酸化级联通路的调节,下游调节的靶基因与细胞周期、细胞凋亡、侵袭转移及干细胞等有关。其表达及活性在多种水平受到调节,如转录水平、翻译水平、翻译后修饰及蛋白酶体降解等。FOXO1作为转录因子存在于细胞核内,当被上游调控分子磷酸化后转移至胞质中,无法激活下游靶基因,从而不能发挥转录因子功能〔12〕。本研究通过免疫组化发现,FOXO1蛋白在NB中明显低表达,同时Western印迹结果进一步证明了FOXO1在NB中处于低表达水平,提示抑癌蛋白FOXO1在NB发生、发展过程中起到重要作用。进一步分析FOXO1蛋白与NB的临床分期、组织类型和病理分型之间存在明显相关性,提示FOXO1蛋白表达可能影响NB生物学特性。
CD133是细胞膜蛋白,作为造血和某些正常组织干细胞标志物特异性标志物存在。研究发现,全身多种脏器组织如心、脑、肾脏等存在CD133的mRNA转录本,此外神经嵴干细胞中也发现CD133的存在,Chen等〔1〕使用流式细胞分离技术从脑细胞中提取到CD133+表型、具有干细胞特性的细胞。近些年来,CD133已经被广泛应用于肿瘤干细胞的特异性标记,并且在NB中证实存在CD133阳性表达的肿瘤干细胞。将CD133+表达神经肿瘤干细胞通过注射方法种植于免疫缺陷小鼠皮下,结果全部免疫缺陷小鼠存在脑肿瘤成瘤〔13〕,同样将CD133-表达神经肿瘤细胞种植于免疫缺陷小鼠皮下,却难以引起小鼠脑肿瘤成瘤〔14〕。本研究结果发现,CD133在NB组织中阳性表达,且随临床分期增加,CD133阳性率呈现递增趋势。此外Western印迹结果进一步证明了CD133在NB中处于高表达水平。
关于FOXO1与CD133之间是否存在关联性,Song等〔15〕在胰腺导管腺癌中发现FOXO1低表达的肿瘤细胞具有明显干细胞特性且CD133处于高表达状态,而FOXO1高表达的肿瘤细胞细胞干性明显减弱且CD133表达明显下调,推测CD133可能是FOXO1下游靶基因,FOXO1很可能通过调节CD133表达来调控肿瘤细胞干细胞特性。本研究中,通过免疫组织化学染色方法检测两者,使用蛋白水平作为综合尺度来推测两者表达之间的相关性,通过结果分析得知FOXO1和CD133在蛋白水平存在明显负相关性,与既往胰腺癌中的研究呈现相似结果,推测NB干细胞特性可能通过FOXO1表达下调引起CD133蛋白水平升高来控制。
近年来分子靶向治疗在很多肿瘤疾病中取得突破性进展,本研究证实在NB组织中FOXO1和CD133异常表达且与临床分期及肿瘤发生发展存在密切联系,并存在明显负相关性,认为以两者为靶点进行综合性治疗对于NB治疗将会取得更佳疗效。

