外源抗坏血酸对盐胁迫下商麦1619生长生理的影响
华智锐,李小玲
(商洛学院 生物医药与食品工程学院,陕西 商洛 726000)
盐碱地在我国分布广泛,并且随着人口增长,化肥的大量使用等人为因素的影响,土壤盐渍化面积有扩大趋势,阻碍了我国农业的生产,生态环境也越来越脆弱[1]。土壤盐害是制约增产的主要逆境之一。盐胁迫不仅直接影响植物的正常生长,使植物细胞氧自由基积累,而且可以通过破坏植物光合作用,并影响植物体内蛋白质的合成从而影响能量代谢,抑制其正常成长,并且盐浓度越大,作用时间越长,影响越明显[2-5]。盐胁迫下植物会提高过氧化物酶(POD)、超氧化物歧化酶(SOD)等活性来清除活性氧,使蛋白质正常代谢,提高色素含量,还会积累游离脯氨酸和可溶性糖等渗透调节物质,从而将逆境对植物细胞的伤害降到最低。植物抵御盐胁迫的能力不仅与基因型密切相关,还有环境的作用[6]。
抗坏血酸(AsA)又称维生素C,它具有抗氧化作用,可以清除细胞内链反应中产生的自由基,还可以通过延长或中断链反应发挥作用以使植物正常生长。在植物体内产生的抗坏血酸可以清除体内的活性氧,另一方面它是多个酶的辅因子,在多种生理过程中起着非常重要的生理功能[7]。作为植物体内的小分子生理活性物质,维生素C参与植物体内的能量代谢和氧化还原反应,在种子抵抗逆境、促进细胞生长过程中起着重要的作用[8-10]。近年来许多研究人员就抗坏血酸(AsA)能否作为植物生长调节剂刺激植物的生长做了大量研究。郭天荣等[11]研究结果表明适宜浓度的外源维生素C能在一定程度上缓解铝毒害而导致的大麦生长抑制和氧化胁迫,但若浓度过高就会产生氧化作用,铝敏感基因型反应也会更活跃。李婷、郑启伟等发现外源维生素C能改善O3胁迫下水稻叶片的抗氧化系统功能,并能减少水稻叶片中活性氧的积累,从而使O3对水稻叶片的老化作用变慢,提高了水稻叶片对O3危害的抗性[12-13]。江绪文等[14]研究表明适宜浓度的外源维生素C能提高黄芩种子的萌发能力,增强黄芩幼苗对盐胁迫的适应能力,从而起到缓解盐胁迫对黄芩种子萌发及幼苗生长的抑制作用。研究工作者就其他外源物质对小麦逆境的缓解作用已有了大量研究,但关于外源维生素C与小麦幼苗生长的关系研究鲜有报道[10]。
小麦是全球范围内广泛种植的禾本科植物,也是我国重要的粮食作物,它的产量位居世界第二,仅次于玉米。商洛市位于陕南山区,土地资源稀少,地形复杂,素有“八山一水一分田”之称,气候多样。据统计资料,近几年以来陕南地区可利用耕地的面积越来越少,可利用耕地面积的减少量与其它土地类型的增加量失衡已导致总生态承载力显著降低[15-18]。商洛地区粮食作物以小麦为主,但由于地理位置所限,小麦的产量并不高。商麦1619是商麦5226基础上选育的不耐盐型高产小麦新品种[19]。本试验用商麦1619作为试验材料,旨在探究外源抗坏血酸对盐胁迫下地方小麦种子萌发及幼苗生长的影响,以期为外源抗坏血酸缓解盐害对商麦1619的影响提供理论依据,对商麦1619的耐盐研究及大面积推广利用外源抗坏血酸缓解盐害起到一定的借鉴作用。
1 材料与方法
1.1 试验材料
本试验所用商麦1619种子由商洛学院秦岭植物良种繁育中心提供。
1.2 试验材料的培养与处理
1.2.1 试验材料的培养 精选大小均一、籽粒饱满的商麦1619小麦种子,先采用10% NaClO消毒5 min,再用蒸馏水反复冲洗干净,晾干后将商麦1619种子均匀摆放在培养皿中,于25 ℃的恒温培养箱培养,直至胚芽长到2 cm左右,置于室温自然光照下培养成小麦幼苗。
1.2.2 耐盐阈值的筛选 先把浸种处理的商麦1619种子转入垫有两层滤纸的培养皿,然后在不同培养皿中分别添加15 mL质量浓度为6、8、10、12、14、16 g/L氯化钠溶液进行预实验,于25 ℃的恒温培养箱中培养3 d,根据小麦种子的萌发情况,通过计算小麦种子3 d后不同处理的发芽率筛选出8 g/L氯化钠溶液为商麦1619的耐盐阈值。
1.2.3 复合处理 当小麦幼苗长至两叶一心时,以8 g/L质量浓度氯化钠溶液复合添加不同质量浓度(0、0.05、0.10、0.15、0.20 g/L)的抗坏血酸处理小麦幼苗,试验处理设计6组,依次标记为CK、AsA0、AsA1、AsA2、AsA3、AsA4(CK为蒸馏水对照),3次重复,每处理用苗60株,5 d后测定相关生理指标。从相同处理的3个重复中随机抽取小麦幼苗,取相同节位的成熟叶片,用蒸馏水反复冲洗干净后剪碎,用于测定脯氨酸和可溶性糖含量、超氧化物歧化酶(SOD)和过氧化物酶(POD)活性及丙二醛(MDA)含量等生理指标。
1.3 测定项目与方法
1.3.1 小麦种子的萌发 设置8 g/L的氯化钠涪液+不同质量浓度的外源抗坏血酸处理,每个处理用100粒种子,设置3组重复,每天18:00更换8 g/L的氯化钠溶液,以使盐胁迫的程度不变,统计当天的发芽数并连续记录5 d,观察种子萌发情况,并用公式(1)和(2)分别计算不同处理的发芽势和发芽率。发芽势、发芽率统计参照《国际种子检验规程》[18]。
发芽势=发芽的种子总数/种子总数×100%
(1)
发芽率=发芽高峰期发芽的种子数/供试种子粒数×100%
(2)
1.3.2 脯氨酸含量的测定 参照李合生的茚三酮比色法[20]测定脯氨酸含量。先称取25 mg脯氨酸,用蒸馏水溶解并倒入容量瓶中,用蒸馏水定容至250 mL刻度,此标准液中每毫升含100 μg脯氨酸。取6个50 mL容量瓶,分别加脯氨酸原液0.5、1.0、1.5、2.0、2.5、3.0 mL,用蒸馏水定容至刻度并摇匀,即各瓶的脯氨酸浓度分别为1、2、3、4、5、6 μg/mL。取试管6支,并分别吸取系列标准浓度的脯氨酸溶液2 mL、酸性茚三酮溶液2 mL、冰醋酸2 mL,每管在沸水浴中加热30 min。待冷却后于各试管中加入甲苯4 mL,振荡30 s,静置片刻。用注射器轻轻吸取各管上层脯氨酸甲苯溶液至比色杯中,空白对照为甲苯溶液,于520 nm波长处测定吸光值。绘制标准曲线:求出吸光度值(y)随脯氨酸浓度(x)变化的回归方程式,然后用回归方程式绘制标准曲线。
脯氨酸提取:分别称取0.5 g不同处理下小麦叶片于试管中,然后向各管分别加入3%的磺基水杨酸溶液5 mL,沸水浴10 min,冷却后过滤到干净试管,滤液即为脯氨酸提取液。吸取提取液2 mL至另一带玻塞试管中,并加入冰醋酸2 mL和酸性茚三酮试剂2 mL,沸水浴30 min。冷却后加入甲苯4 mL,摇荡30 s,静置片刻,取上层液加入到10 mL离心管中,于3000 r/min下离心5 min。取上层脯氨酸红色甲苯溶液于比色杯,以甲苯为空白对照,测定520 nm波长处吸光值。根据回归方程计算2 mL测定液中脯氨酸的含量(x,μg/2 mL),再计算样品中脯氨酸含量的百分数。计算公式(3)如下:
脯氨酸含量(μg/g)=x×(5/2)/样重
(3)
1.3.3 可溶性糖含量的测定 参照李合生等的苯酚法[21]测定可溶性糖含量。取6支20 mL试管并编号,按照表1配制标准葡萄糖溶液,并在每个试管中加入蒽酮0.5 mL,再缓慢加入浓H2SO45 mL,摇匀后取试管塞,于沸水浴10 min,随后取出并冷却至室温,测定620 nm波长下吸光值,用标准葡萄糖含量为横坐标,吸光值为纵坐标,绘制标准曲线。
称取1 g小麦叶片,剪碎后置于研钵中,加入少量蒸馏水并研磨成匀浆,然后将其转入到20 mL刻度试管,分2~3次用10 mL蒸馏水清洗研钵,将残液都转入到试管中。盖上试管塞,将6支试管在沸水浴中煮沸,10 min后冷却,将残渣过滤只收集滤液,然后转入100 mL容量瓶,再加蒸馏水定容,加盖摇匀。
取移液管吸收提取液1 mL于20 mL刻度试管,再加水1 mL和蒽酮试剂0.5 mL。缓慢加入浓H2SO45 mL,盖塞后轻轻摇匀,沸水浴中10 min(空白对照用蒸馏水2 mL与蒽酮试剂0.5 mL混合,一并沸水浴10 min)。待冷却至室温后,测定620 nm波长下吸光值。通过查标准曲线得知对应的葡萄糖含量(μg)。按公式(4)计算样品含糖量。
样品含糖量(g/100 g鲜重)=(查曲线所得糖含量×稀释倍数)/(样品重×106)
(4)
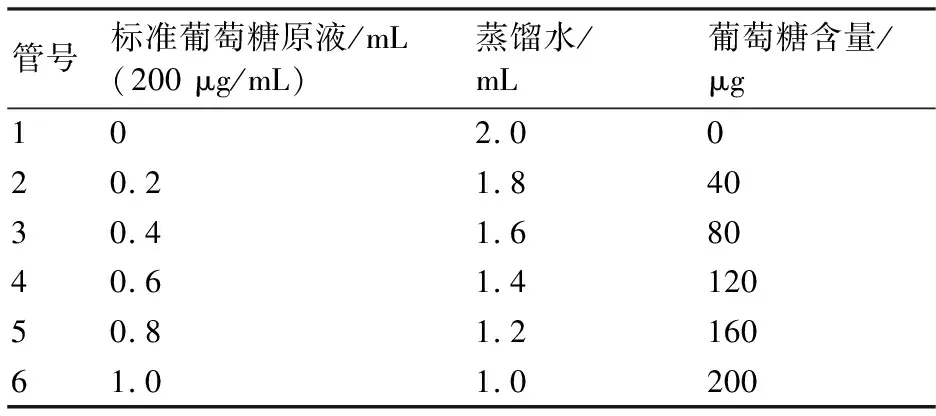
表1 配制一系列不同浓度的标准葡萄糖溶液
1.3.4 丙二醛(MDA)含量的测定 丙二醛含量的测定参照张志良等的硫代巴比妥酸(TBA)显色法[22]。取小麦叶片0.5 g,加入5 mL 5%三氯乙酸研磨,取匀浆于3000 r/min条件下离心10 min。取上清液2 mL ,并加2 mL 0.67%硫代巴比妥酸,混合后于沸水浴30 min,立即冰浴冷却后在1500 r/min条件下再离心10 min,最后取上清液分别测定450、530、600 nm波长处吸光度。MDA含量按以下公式(5)计算。
MDA含量(μmol/L)=6.45×(A532-A600)-0.56A450
(5)
1.3.5 过氧化物酶(POD)活性的测定 过氧化物酶活性的测定参照李合生等的愈创木酚法[20]。取1 g小麦叶片,加入0.2 g聚乙烯吡咯烷酮(PVP)和0.15 mol/L磷酸缓冲液(pH 7.0),用液氮磨碎,提取液于4 ℃下以15000 r/min离心20 min,上清液用于酶活性的测定。3 mL反应体系中含有0.2%愈创木酚0.9 mL、0.1%的过氧化氢(H2O2)2.0 mL和0.1 mL酶液。加入酶液后,测定470 nm波长下吸光值的变化,用每分钟△OD470(即470 nm波长下吸光值变化0.01)表示一个酶活性单位。POD总活性按以下公式(6)计算。
POD总活性[U/(g·min)]=△A×V1/(V2×W×T×0.001)
(6)
△A:每分钟吸光度值的变化;V1:提取酶液总体积(mL);V2:测定用酶液体积(mL);W:样品鲜重;T:反应时间(min)。
1.3.6 超氧化物歧化酶(SOD)活性的测定 参照李合生等的氮蓝四唑(NBT)光还原法[20]测定SOD活性。称取0.5 g小麦叶片于预冷的研钵,并加预冷的磷酸缓冲液1 mL研磨(可加2~3 mL磷酸缓冲液冲洗研钵)成浆,用缓冲液定容至5 mL。取2 mL转入离心管,在4000 r/min条件下离心20 min,上清液即为SOD粗酶液。
每个样品取8个洁净干懆的试管编号,按抗坏血酸质量浓度的大小标号:5~9号分别指AsA0、AsA1、AsA2、AsA3和AsA4;1、2、3号为空白对照;4即为CK组。反应体系总体积为3 mL。
1号比色杯调零,测定其它各个试管560 nm波长下的吸光度值。采用2、3号管吸光度的平均值作为还原率的100%,分别计算不同酶液量抑制NBT光还原的相对百分率。以酶液用量(pL)为横坐标,以NBT光化还原的抑制率(%)为纵坐标,绘制NBT光化还原的抑制率和酶液用量的相关曲线。SOD活性单位:以抑制NBT光化还原的50%作为一个酶活性单位,按下式(7)计算SOD活性。
SOD总活性=(ACK-AE)×V/(ACK×0.5×W×Vt)
(7)
公式(7)中,ACK为对照管的吸光度;AE为样品管的吸光度;V为样品液总体积(mL);W为样品鲜重(g);Vt为测定时样品用量(mL)。
1.3.7 数据处理 测定指标取得数据均为3次重复,处理数据采用Microsoft Excel 2003 软件,采用SPSS 22.0软件Duncan进行差异显著性分析。
2 结果与分析
2.1 AsA处理对盐胁迫下小麦种子萌发的影响
2.1.1 AsA浸种处理对盐胁迫下小麦种子发芽势的影响 由图1可看出,第3天后小麦的整体发芽数趋于稳定。未经处理的正常生长的小麦种子第1天的发芽数为80粒,次日发芽数为93粒,第3天为96粒。与此形成鲜明对比的是盐胁迫下未经外源抗坏血酸浸种处理的小麦种子,其发芽数最低,第1天为70粒,第3天为74粒,第3天为80粒。用外源抗坏血酸处理的种子发芽数均多于盐胁迫对照组,在0.15 g/L抗坏血酸处理下,第1天的发芽数为75粒,次日92粒,第3天为94粒,发芽效果仅次于CK组。而当抗坏血酸质量浓度为0.20 g/L时,该组小麦的种子每天的发芽势仅仅只高于盐胁迫组,说明不同浓度外源抗坏血酸均能不同程度提高盐胁迫下小麦种子的发芽势,对盐害有一定的缓解效应,其中以0.15 g/L外源抗坏血酸处理对小麦种子盐胁迫缓解作用最好。
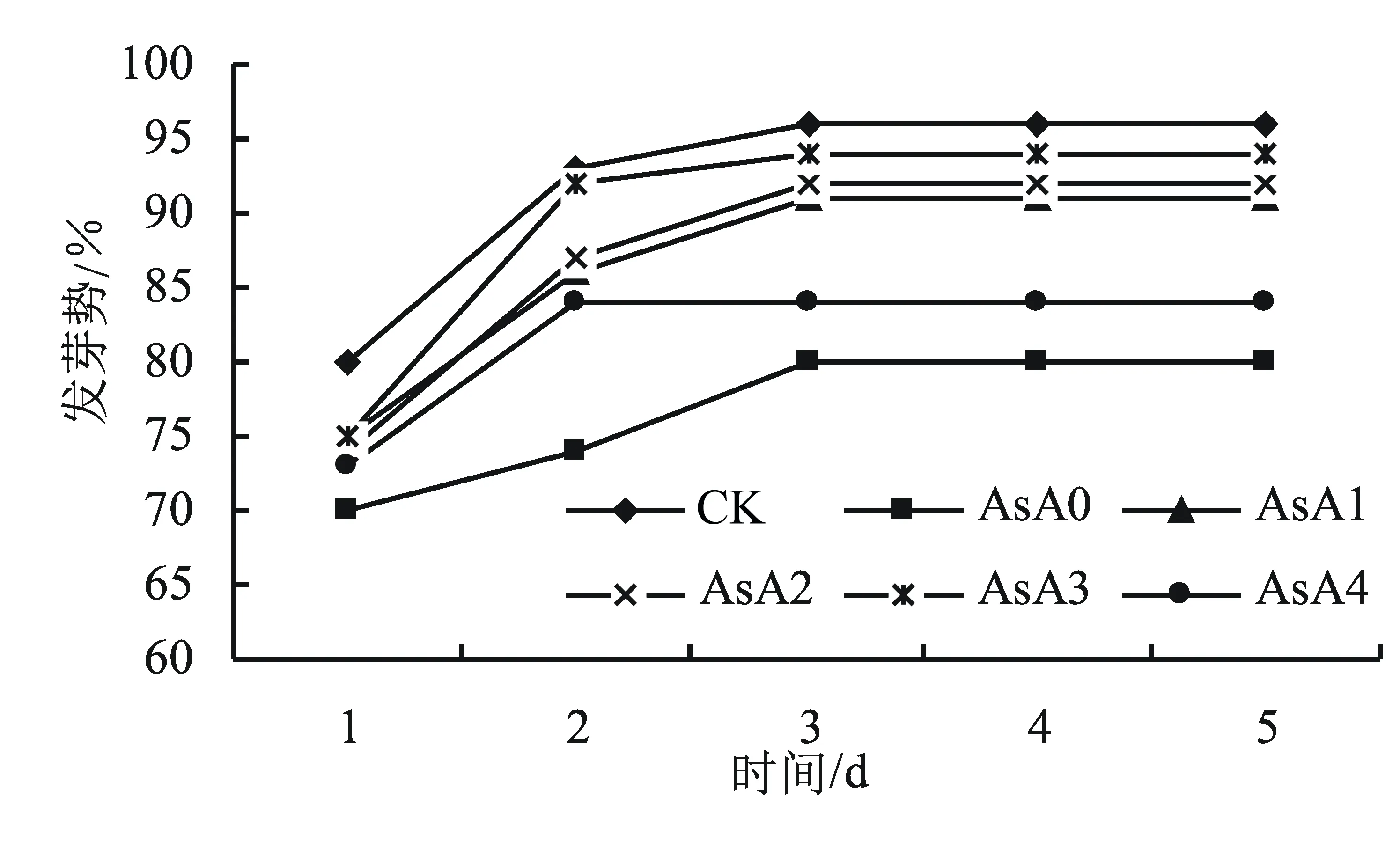
图1 AsA浸种处理对盐胁迫下小麦种子发芽势的影响
2.1.2 AsA浸种处理对盐胁迫下小麦种子发芽率的影响 由图2可以看出,不同浓度AsA浸种处理小麦后,种子发芽率都出现不同程度的上升,与AsA0有显著性的差异(P<0.05),且在一定范围内随着AsA浓度的增加,发芽率也逐渐增加,总体上,经外源抗坏血酸处理的小麦种子都明显高于盐胁迫的对照组,外源抗坏血酸处理组小麦的发芽率随质量浓度的增加呈先升后降的趋势。盐胁迫下小麦的发芽率为80%,而正常生长的小麦发芽率为96%,当AsA质量浓度为0.15 g/L时,小麦的发芽率为94%,最接近蒸馏水培养的对照组,且增幅最大为17.5%。说明采用适宜浓度的外源AsA浸种能提高盐胁迫下小麦种子的发芽率,缓解盐害对小麦发芽的影响,且用0.15 g/L AsA浸种缓解盐害效果最佳。
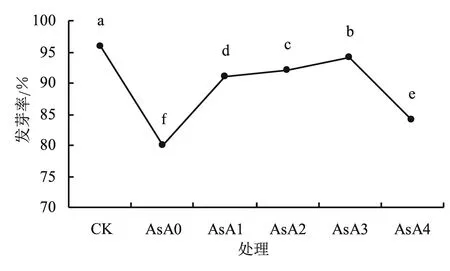
图中不同小写字母表示不同处理间差异显著。下同。
2.2 AsA处理对盐胁迫下小麦幼苗体内各项生理指标的影响
2.2.1 AsA处理对盐胁迫下小麦幼苗游离脯氨酸含量的影响 由图3可知,AsA4小麦幼苗体内游离脯氨酸含量最低,与CK对照组差异不显著(P>0.05);单独盐胁迫下小麦幼苗体内游离脯氨酸含量略大于蒸馏水CK对照组;当加入不同质量浓度的外源抗坏血酸,在0.05~0.15 g/L内,小麦幼苗体内游离脯氨酸含量呈现上升趋势。当抗坏血酸质量浓度为0.15 g/L时,小麦幼苗体内游离脯氨酸含量与AsA0相比增幅最大,达到67.5%。而当AsA的质量浓度为0.20 g/L时小麦幼苗体内游离脯氨酸含量骤降,到达最低点。以上结果表明一定浓度范围内的外源AsA处理可以适当提高盐胁迫条件下小麦幼苗体内游离脯氨酸含量,缓解盐害对小麦幼苗的影响,且当外源AsA浓度为0.15 g/L时最有效。
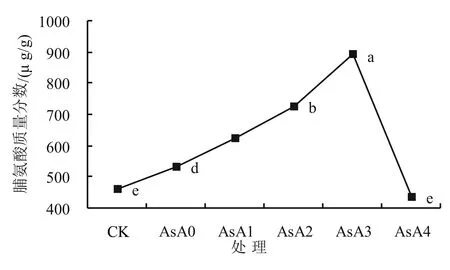
图3 AsA处理对盐胁迫下小麦幼苗体内游离脯氨酸含量的影响
2.2.2 AsA处理对盐胁迫下小麦幼苗可溶性糖含量的影响 由图4可以看出,单独盐胁迫下小麦幼苗体内可溶性糖含量显著(P<0.05)增加,而当配合加入不同浓度外源抗坏血酸后,小麦幼苗体内可溶性糖含量随着抗坏血酸质量浓度的增加呈先增后降趋势。与AsA0相比,抗坏血酸质量浓度达到0.15 g/L时可溶性糖含量增幅最大,为70.6%,AsA1和AsA4之间差异不显著(P>0.05),说明用0.10 g/L AsA处理小麦幼苗与用0.20 g/L AsA处理小麦幼苗对可溶性糖含量影响效果并无差别。以上结果说明适宜浓度的AsA处理可有效提高小麦幼苗体内可溶性糖含量,从而缓解盐害,增强抗性。当抗坏血酸质量浓度为0.15 g/L时缓解效果最佳。
2.2.3 AsA处理对盐胁迫下小麦幼苗SOD和POD活性的影响 由图5可以看出,与CK对照组相比,盐胁迫下SOD的活性显著(P<0.05)升高,添加外源抗坏血酸后,SOD的活性均有不同程度的上升。小麦幼苗体内的SOD活性随着外源抗坏血酸质量浓度的增加呈先增后降趋势,其中以0.15 g/L质量浓度的AsA处理后的效果最好,与AsA0相比增幅为0.3%。以上结果表明适宜浓度的外源AsA处理可提高盐胁迫下小麦幼苗体内SOD的活性。
由图6可以看出,与CK对照组相比,盐胁迫下POD的活性显著(P<0.05)升高,添加外源抗坏血酸后,POD的活性都有不同程度的上升,与SOD活性的变化基本相同,且变化幅度比SOD大。在AsA1、AsA2和AsA4处理下POD活性均显著高于AsA0,分别比单独NaCl处理显著升高51.5%、76.8%和67.7%。其中AsA3处理下小麦幼苗体内POD的活性最高,是AsA0组的1.18倍。但当外源抗坏血酸质量浓度为0.20 g/L时,POD活性开始呈下降趋势。以上结果表明适宜浓度的外源AsA处理可提高盐胁迫下小麦幼苗体内POD活性,且以0.15 g/L质量浓度的外源抗坏血酸处理缓解盐害效果最佳。
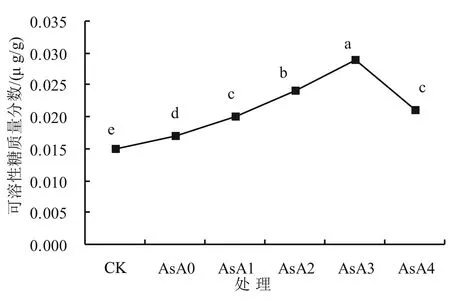
图4 AsA处理对盐胁迫下小麦幼苗体内可溶性糖含量的影响
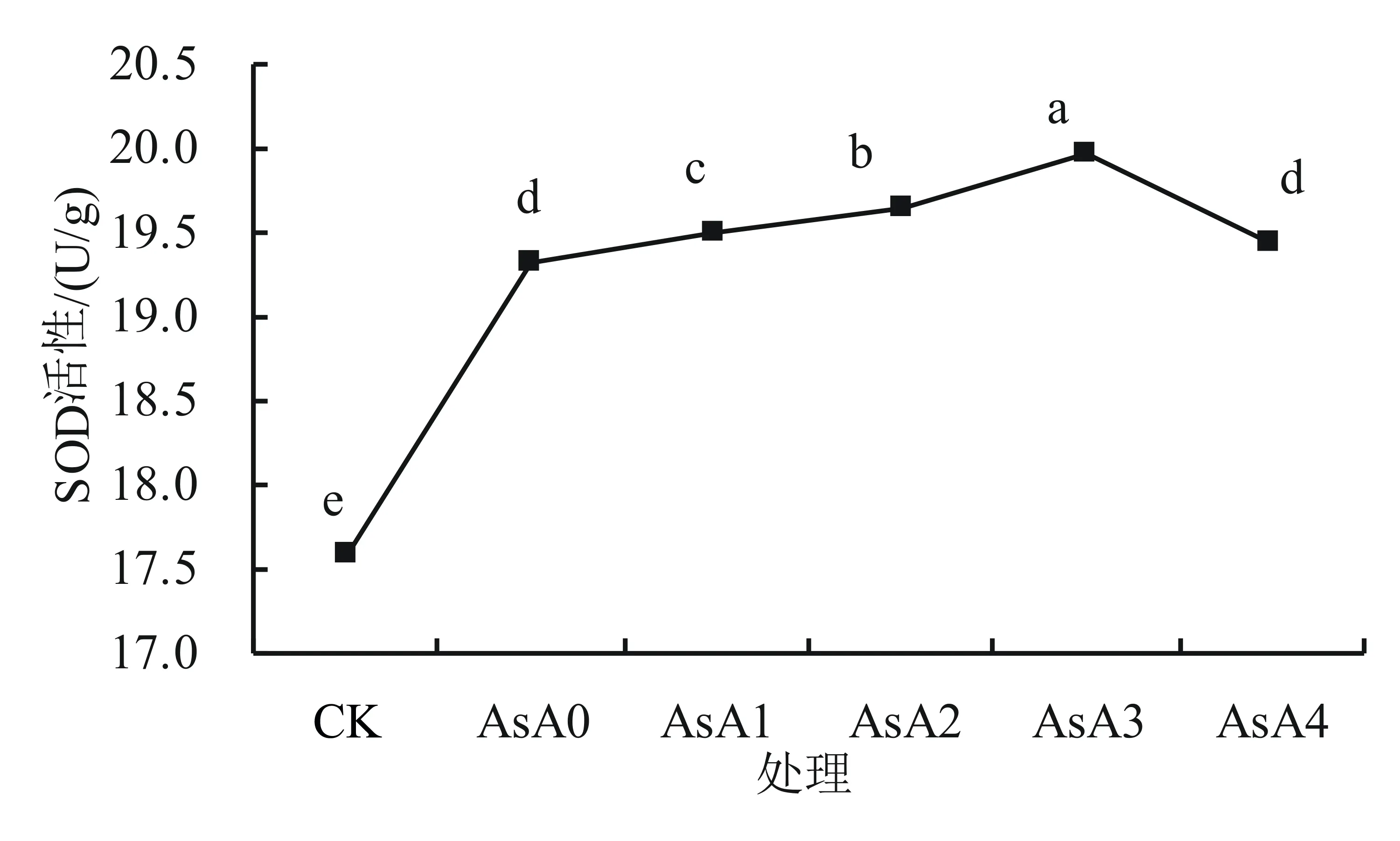
图5 AsA处理对盐胁迫下小麦幼苗体内SOD活性的影响
2.2.4 AsA处理对盐胁迫下小麦幼苗MDA含量的影响 由图7可以看出,相比于蒸馏水培养的对照组,单独NaCl处理下小麦幼苗体内的丙二醛含量骤升。当加入不同质量浓度的外源抗坏血酸后小麦幼苗体内的丙二醛含量显著(P<0.05)下降,且随外源抗坏血酸质量浓度的增加,小麦幼苗体内丙二醛含量呈先降后增趋势,在AsA1~ AsA4处理下均显著低于AsA0,分别比单独NaCl处理显著降低20.1%、38.5%、61.5%和7.7%。AsA3处理下小麦幼苗体内丙二醛含量仅略高于蒸馏水培养的对照组,比单独盐胁迫下降低61.5%。以上数据表明添加适宜浓度的外源AsA能降低盐胁迫下小麦幼苗体内丙二醛含量,有利于小麦幼苗抵抗逆境,减轻盐胁迫环境中产生的氧自由基对质膜的破坏作用,达到缓解盐害的目的,且当外源AsA质量浓度为0.15 g/L时效果最佳。
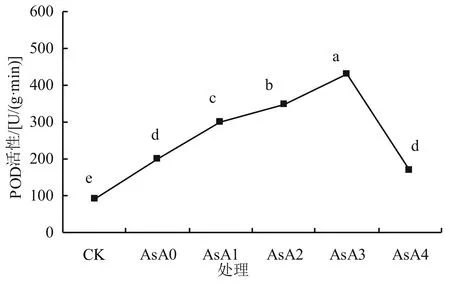
图6 AsA处理对盐胁迫下小麦幼苗体内POD活性的影响
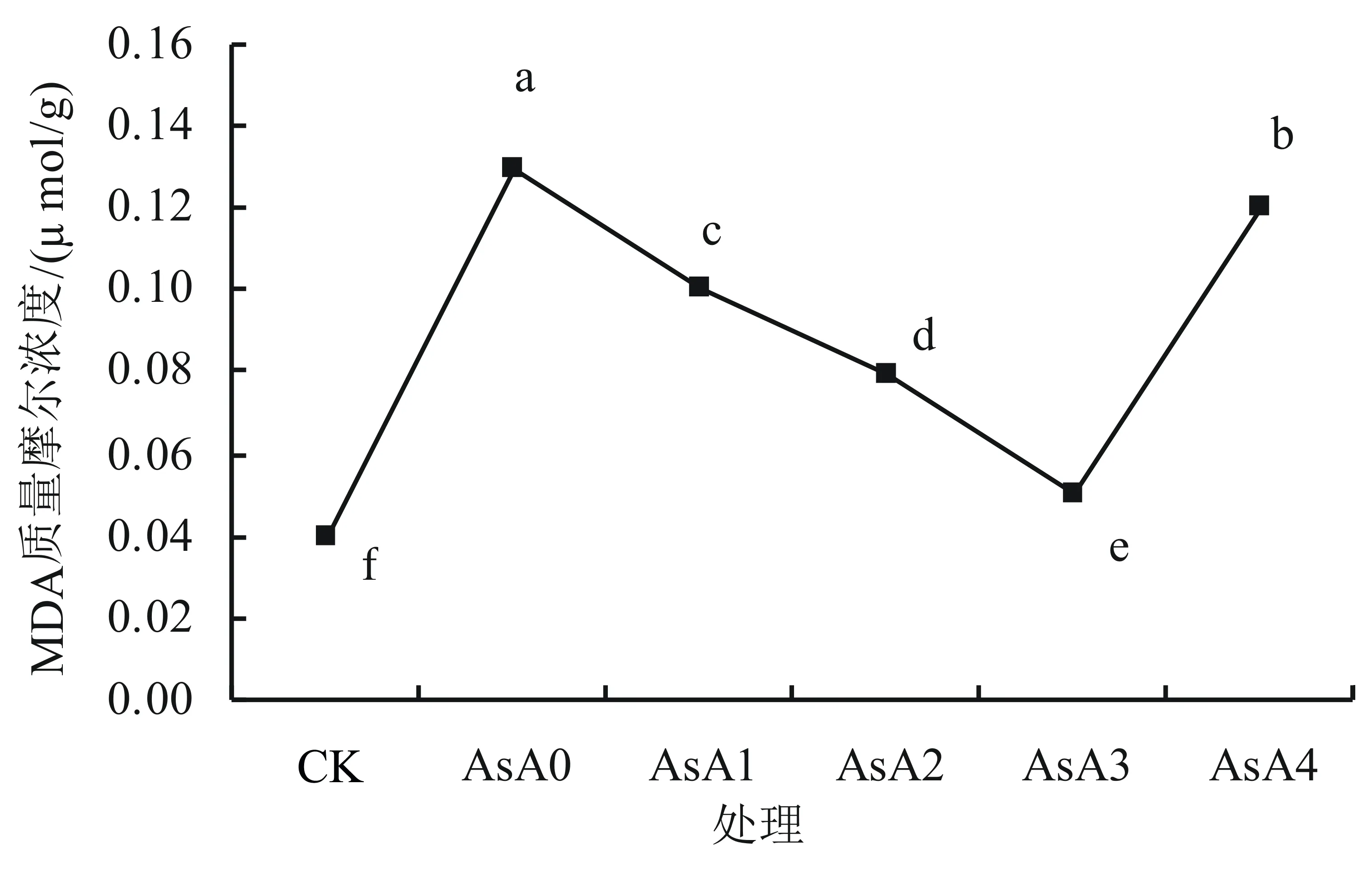
图7 AsA处理对盐胁迫下小麦幼苗体内MDA含量的影响
3 讨论与结论
种子发芽率是指在适宜条件下,样本种子中发芽种子的百分数,发芽势是指在适宜条件下和规定时间内种子发芽数占供试种子总数的百分率。两者均能测验种子发芽能力,发芽率主要测试种子发芽多少,发芽势主要体现种子生命力强弱、发芽整齐度和发芽速度[23]。在单独盐胁迫条件下,商麦1619的发芽率最低,但是加入外源抗坏血酸能够显著提高小麦种子发芽势及发芽率。说明盐害影响商麦1619的种子发芽势及发芽率,但当加入外源AsA能显著缓解盐害,相应地提高种子的发芽势和发芽率,这与范美华等[24]的研究结果相似。
外源AsA促进盐胁迫下小麦种子萌发及幼苗生长的原因主要体现在两个方面:一方面通过提高植物体内脯氨酸和可溶性糖等渗透调节物质含量来缓解盐胁迫对种子萌发及幼苗生长的抑制作用;另一方面通过增强酶促或非酶促抗氧化途径的作用来有效清除胁迫产生的活性氧[24-25]。用NaCl单独处理时,商麦1619的幼苗体内游离脯氨酸、可溶性糖等渗透调节物质含量显著增加,用于自身调节以适应盐胁迫带来的伤害,而用外源AsA处理后其幼苗体内游离脯氨酸、可溶性糖等渗透调节物质含量均明显增加,说明外源AsA能增强其渗透调节能力,进一步缓解由于盐离子进入植物细胞带来的失水伤害及由此造成的次生伤害。这与张菊平等[26]的研究结果相一致。
超氧化物歧化酶、过氧化物酶是植物组织内清除活性氧的重要保护酶,它与植物的衰老和抗逆性密切相关。当植物遭受逆境胁迫时,其体内产生大量损伤细胞的活性氧自由基,植物可通过酶保护系统和非酶促防御系统清除活性氧自由基,保护植物细胞膜免受氧化伤害,以利于其它生理过程的进行。保护酶SOD可使超氧化物阴离子自由基(O2-)发生岐化反应,生成O2和H2O2,生成的H2O2可被过氧化氢酶分解为O2和H2O,以避免H2O2积累对细胞的氧化破坏作用[27]。在盐胁迫下,商麦1619幼苗保护酶活性显著高于对照组。本试验中,用抗坏血酸溶液处理盐胁迫下小麦幼苗,其保护酶活性都得到明显提高,且在0.15 g/L时,效果最佳。表明外源抗坏血酸可抑制逆境胁迫对小麦的伤害,增强其抗逆性,促进小麦幼苗的正常生长发育。
丙二醛(MDA)是植物组织或器官由于植物器官衰老或在逆境条件下膜脂质过氧化而产生的一类生理物质。丙二醛含量是鉴别逆境伤害的指标之一,与植物衰老及逆境伤害有着非常密切的联系。在正常情况下,植物细胞内活性氧自由基的代谢是维持在一定水平的动态平衡,但是自由基水平很低,不会对植物细胞造成伤害。而当植物遭受到逆境胁迫时,平衡遭到破坏,自由基迅速积累,造成膜脂过氧化,产生大量的MDA。因此盐胁迫下MDA含量的高低可以反映小麦幼苗叶片质膜受伤害的程度及其抗盐性的强弱。盐胁迫下,MDA含量得到明显的提升,而经过外源抗坏血酸溶液处理后,MDA含量显著降低,均低于对照组,且0.15 g/L质量浓度最佳。说明外源抗坏血酸可缓解膜脂过氧化的过程,降低小麦幼苗体内的丙二醛含量,有效维持细胞质膜系统的完整性,保证小麦幼苗体内各种生理生化过程的正常进行。这与樊瑞苹[28]的研究报道相类似。
脯氨酸和可溶性糖是增强植物抗性的生理基础,它们是植物细胞内重要的2种渗透调节物质,除了与调节植物体内渗透物质的积累有关以外,还和抗氧化作用酶类的活性的变化相关。植物体内脯氨酸含量的高低是反映植物抗逆境性强弱的指标之一。本试验中,用外源抗坏血酸处理盐胁迫下的商麦1619,其脯氨酸、可溶性糖的含量均高于对照组,且0.15 g/L质量浓度最佳。说明盐胁迫下施加抗坏血酸可有效提高脯氨酸、可溶性糖含量,降低盐胁迫对小麦幼苗生长的不利影响。但脯氨酸含量与植物耐盐性关系并未有定论,还有待继续研究考证[29-30]。
综上所述,适宜浓度的外源AsA具有提高盐胁迫下商麦1619的种子发芽势和发芽率及幼苗体内渗透调节物质含量和保护酶活性等作用,这对小麦缓解盐害胁迫,增强抗盐性,为小麦的种植和育种工作提供了理论参考。但本试验虽然完成了相关数据采集和指标分析,而对于商麦1619的大田栽培试验中相关生理生化指标的变化规律还有待进一步探讨。还应强调的是小麦抗盐性是不同因素作用下的综合表现,生理过程复杂,而且不同小麦品种抗盐性能力不一,同一品种不同生育期抗盐性也不相同,同时也受不同基因控制。由于以上原因,要全面详细了解外源AsA缓解商麦1619盐害的机制,还需要从植物生理生化及分子生物学的角度作进一步的研究探讨。

