猪伪狂犬病毒Real-time PCR检测方法的建立和弱毒疫苗病毒含量的检测
华 涛,唐 波,黄 江,常 晨,刘国阳,张雪花,侯继波,张道华*
(1.江苏省农业科学院 动物免疫工程研究所,江苏 南京 210014;2.江苏省农业科学院 国家兽用生物制品工程技术研究中心,江苏 南京 210014;3.省部共建国家重点实验室培育基地/江苏省食品质量安全重点实验室,江苏 南京 210014;4.江苏省动物重要疫病与人兽共患病防控协同创新中心,江苏 扬州 225009)
猪伪狂犬病(Pseudorabies, PR)是由伪狂犬病病毒(Pseudorabies virus, PRV)引起的一种以猪发热、呼吸障碍、流产和脑脊髓炎等为症状的急性传染病,严重危害我国养猪业[1]。PRV属疱疹病毒科、-疱疹病毒亚科,基因组为150 kb的双股DNA病毒[1]。2011年以后伪狂犬病毒变异严重,使我国的疫情更加严重[2]。PRV疫苗免疫是预防伪狂犬病最有效的方法,目前我国市场上主要使用的疫苗是BarthaK-61gE基因缺失活疫苗,一些研究显示其对我国流行毒株的保护力较经典强毒疫苗低[2-3];但随着研究的深入,Bartha K-61活疫苗对流行毒株同样也有保护效果[4-5]。目前我国生产PRV活疫苗有50多家企业,不同企业生产的疫苗含PRV量不尽相同,为了提高弱毒疫苗的免疫效果,很多企业将弱毒疫苗配苗标准提高到大于5000 TCID50/头份的国家标准[6-7]。
PRV基因组含有众多的基因,其中gB基因在野毒和疫苗株中高度保守,其作为PRV的必需基因参与病毒的感染和复制,缺失后病毒丧失感染性,且其也是病毒重要的保护性抗原,参与诱导免疫保护[8]。因此可以用gB基因序列建立检测疫苗含量的PCR方法,或用表达的蛋白建立免疫抗体的血清学检测方法。实时荧光定量PCR技术已被广泛应用于很多病毒的检测,不仅可以对检测的序列进行定性分析,而且可以对其进行准确定量,与常规PCR技术相比有更高的敏感性、特异性和更好的重复性,具有快速和污染几率低等优点[9]。本实验采用SYBR Green建立了一种PRV实时荧光定量检测方法,以期为PRV活疫苗含量的定量分析提供一种简便快速、经济和灵敏的检测方法。本文还利用这种方法对不同病毒滴度的病毒液进行检测,再与CPE法测出的病毒滴度进行比较分析,研究了荧光定量PCR检测PRV病毒滴度的可能性。
1 材料和方法
1.1 实验材料
BHK-21细胞和PRV Bartha-K61病毒由本实验室保存;小牛血清、DEME细胞培养液购自Gibico; SYBR Premix Ex Taq、rTaq聚合酶、质粒提取试剂盒、蛋白酶K、BamHⅠ和KpnⅠ等购自宝生物; Gel Extraction Kit 200凝胶回收试剂盒购自Omega; 7种PRV活疫苗购自疫苗经销商或由猪场赠送。
1.2 实验仪器
Takara PCR仪器、TANON电泳仪、TANON电泳图像分析系统、Thermo超微量分光光度计NanoDrop 1000、Roche Light Cycler 480荧光定量PCR仪。
1.3 gB基因质粒标准品的制备
根据JS-2012(KP257591.1)gB基因序列,用Primer 5设计上游和下游引物,其中gB up为5′-GCGTCGGGGTCCTCGCTCT-3′,gB down为5′-CACGTGAACGACATGCTGA-3′。PCR反应体系: Bartha-K61的DNA模板5 μL、dNTP 4 μL、MgCl23 μL、rTaq 0.5 μL、buffer 25 μL、上游和下游引物各1 μL,用H2O补足至50 μL。反应程序:94 ℃ 5 min;94 ℃ 1 min,68 ℃ 1 min,72 ℃ 1 min,共35个循环;72 ℃ 10 min。PCR完成后回收gB基因,连入pMD 18T,经酶切和测序正确后命名为pMD-gB。标准品用NanoDrop 1000检测质粒浓度,计算并稀释到1×1010拷贝/μL,经10倍稀释后于-20 ℃保存。
1.4 荧光定量PCR的建立
对Genbank中多株PRVgB基因进行比对分析,采用Primer 5软件在gB基因保守区设计引物,P-F:5′-GTCACCCGCGTGCTGATCGTCT-3′;P-R:5′-GGCAACCACCGGCGCTACTTT-3′。用pMD-gB质粒做标准品,经10倍梯度稀释成1×109、1×108、1×107、1×106、1×105拷贝/μL,进行定量PCR;以起始模板数的对数为X轴,以Ct值为Y轴做回归曲线,建立标准曲线。荧光定量PCR反应体系: SYBR 10 μL、上游和下游引物各0.4 μL、模板2 μL,用H2O补足至20 μL。用Roche LightCycler 480进行反应。程序:95 ℃ 5 min;95 ℃ 5 s,60 ℃ 15 s,共40个循环;40 ℃ 30 s。溶解曲线程序:95 ℃ 5 s,65 ℃ 15 s,97 ℃ 5 s。
1.5 荧光定量PCR的重复性实验
采用该荧光定量PCR方法,分别选取1×109、1×108、1×107、1×106、1×105拷贝/μL的质粒标准品进行检测,进行3次批内和批间重复性实验,来检验本方法的重复性。
1.6 特异性
采用该荧光定量PCR方法对PCV2、PPV、JEV、PRRSV、CSFV等常见猪源病毒的DNA或cDNA进行定量PCR扩增,检测该方法的特异性。
1.7 敏感性
选取1×109~1×102拷贝/μL共8个浓度梯度进行实时荧光定量PCR反应,并按以上浓度梯度进行常规PCR反应,观察荧光定量PCR反应和常规PCR反应的敏感性差异。
1.8 病毒DNA的提取和检测
采用配套稀释液稀释送检疫苗,取病毒液450 μL,加入50 μL 10%SDS和3 μL蛋白酶K,在56 ℃下作用30 min。采用酚∶氯仿法提取病毒DNA,加入30 μL H2O溶解。将108TCID50/mL的PRV Bartha-K61病毒连续进行10倍稀释,取450 μL不同稀释度的病毒液按以上方法提取DNA。用已优化的荧光定量PCR检测方法对样品进行检测,将样品的Ct值与标准曲线进行比对,所得结果即为对应病毒液中病毒基因组的拷贝数。
2 结果与分析
2.1 gB基因标准阳性质粒的制备
在PCR反应后进行电泳,发现了1154 bp的gB基因片段(图1A)。将gB片段连入pMD18-T,用内切酶BamHⅠ和KpnⅠ对重组质粒进行酶切鉴定,结果表明1154 bp为gB片段,2700 bp为pMD 18-T载体,鉴定正确(图1B)。测序后将该阳性质粒命名为pMD-gB。
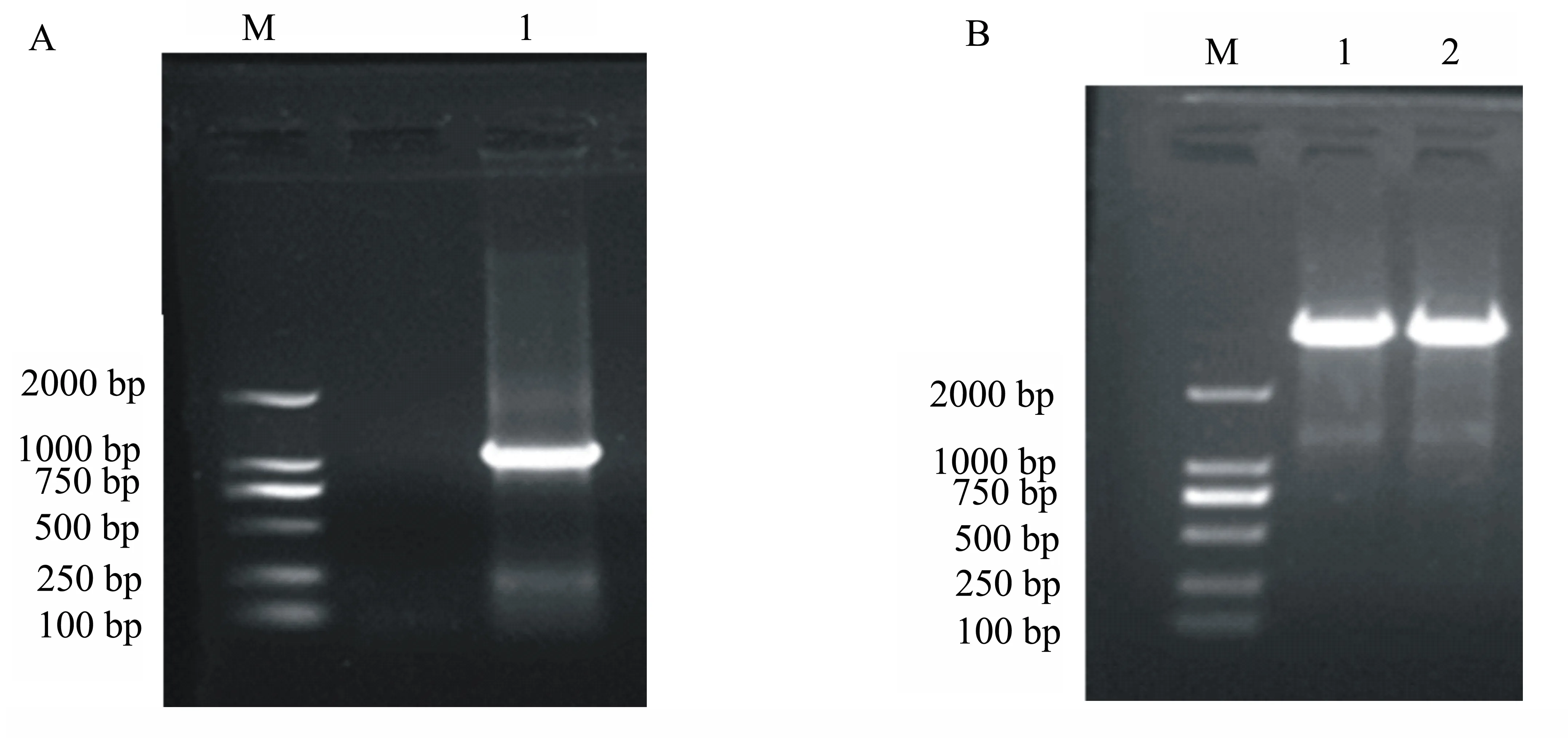
图1 gB基因常规PCR扩增(A)和pMD-gB质粒BamHⅠ和KpnⅠ酶切鉴定结果(B)
2.2 标准曲线的建立
对标准质粒1×109~1×105拷贝/μL浓度按荧光定量PCR反应进行扩增,得到扩增曲线(图2A)。用Roche Light Cycler 480分析软件进行数据分析,获得标准曲线(图2B),拷贝数的对数值(X轴)与Ct值(Y轴)之间的线性关系为Y=-3.232X+40.56。溶解曲线(图2C)表明该产物的TM值在87.5 ℃左右。
2.3 重复性实验
检测荧光定量PCR方法的重复性,分别选取1×109、1×108、1×107、1×106、1×105拷贝/μL的质粒样本,进行3次批内和批间重复性实验。结果如表1和表2所示,变异系数均小于0.5%,表明本方法具有良好的重复性和稳定性。
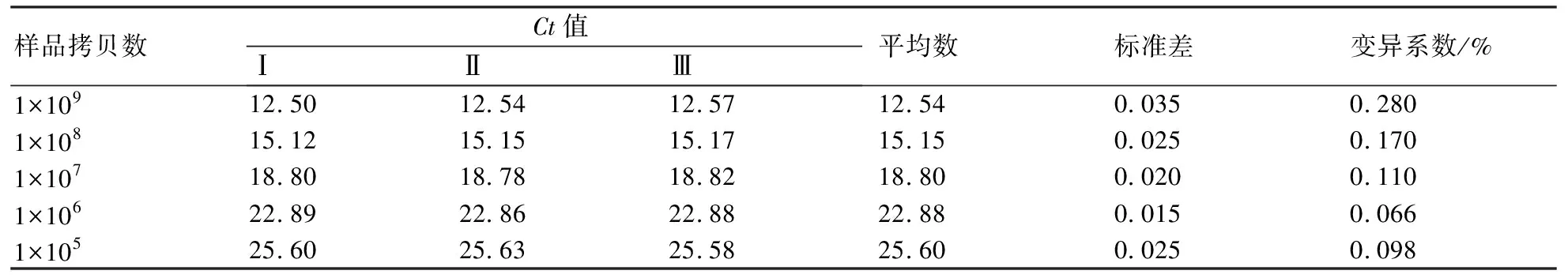
表1 批内重复性实验结果
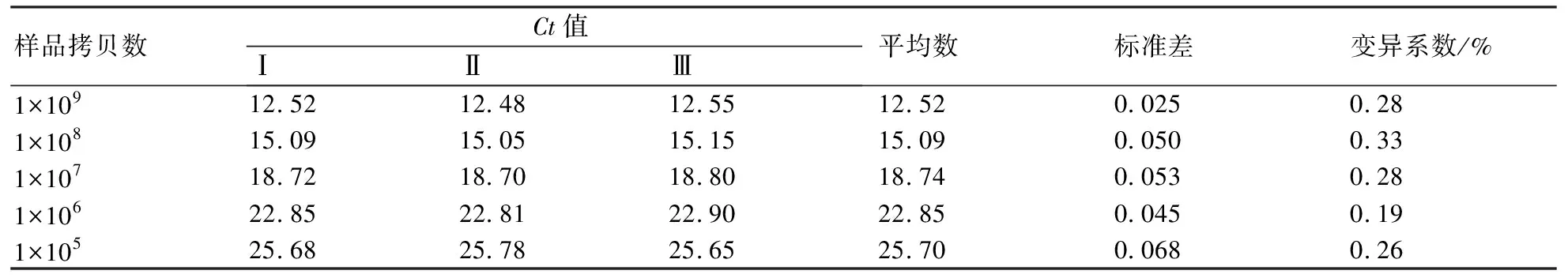
表2 批间重复性实验结果
2.4 特异性实验
用荧光定量PCR方法对PCV2、PPV、JEV、CSFV和PRRSV样品的DNA或cDNA进行特异性分析,选用1×106拷贝/μL的pMD-gB标准质粒作为标准品对照。结果如图3所示,除了模板质粒有荧光信号外,其他病毒的DNA或cDNA模板均无反应,说明本方法有较强的特异性。

1: 1×106拷贝/μL pMD-gB质粒; 2: PCV2;3: PPV; 4: JEV; 5: CSFV; 6: PRRSV。
2.5 敏感性实验
选取1×109~1×102拷贝/μL PRV阳性质粒8个浓度梯度进行实时荧光定量PCR反应,该方法的最低检出浓度为1×103拷贝/μL(图4)。常规PCR反应的最低检出浓度为1×105拷贝/μL(图5)。表明该实时荧光定量PCR的敏感性比常规PCR高100倍。
2.6 病毒滴度与基因拷贝数的关系
用Bartha-K61病毒接种96孔板中的BHK-21细胞,观察细胞形态变化,用Karber法计算病毒滴度。提取病毒的DNA,用实时定量PCR确定病毒的基因拷贝数。结果显示:108、107、106、105和104TCID50/mL病毒液的基因拷贝数分别为9.82×1011、1.32×1011、1.24×1010、1.34×109、1.27×108拷贝/mL。将不同病毒滴度的对数和病毒基因拷贝数的对数进行线性回归分析,结果见图6。病毒基因拷贝数的对数与病毒滴度TCID50的对数呈线性关系,线性回归方程为y=0.978x+4.216,其中y=lg(拷贝数/mL),x=lg(TCID50/mL),相关系数R2=0.9993,说明两者间有较好的相关性。
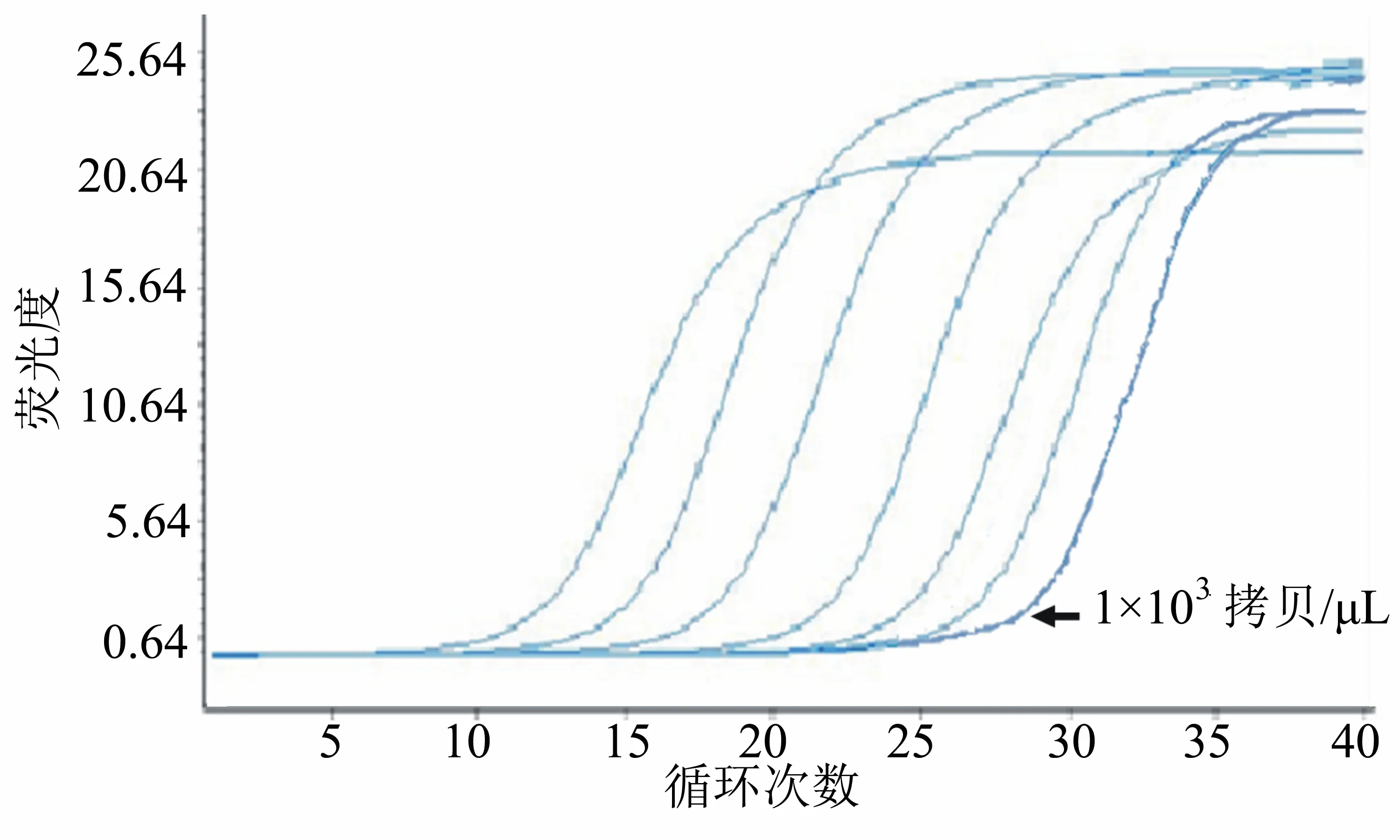
图4 实时荧光定量PCR的敏感性实验结果
2.7 商品PRV活疫苗的检测
从7种商品PRV弱毒活疫苗中提取病毒DNA,用荧光定量PCR检测gB基因的含量,计算7种弱毒活疫苗中的gB基因拷贝数,并采用病毒滴度与基因拷贝数回归方程计算病毒滴度。结果显示,疫苗A和C的每头份PRV病毒gB基因拷贝数明显高于其他5种活疫苗的,说明不同厂家生产的PRV弱毒活疫苗病毒含量存在明显的差异。
3 讨论
猪伪狂犬病是危害中国当前养猪生产的重要疫病之一,PRV的gE基因缺失弱毒疫苗免疫是预防伪狂犬病最有效的方法[1]。2011以来PRV在中国猪场广泛流行,给养猪业带来了巨大损失,虽然有些猪场进行了疫苗接种,但由PRV造成的新生仔猪神经症状乃至死亡时有发生[2]。疫苗的质量可能是其原因之一,评价疫苗的参数很多,其中弱毒苗含量是非常重要的参数[6-7]。已知PCR技术能直接检测病毒种类,特别是荧光定量PCR能够快速定量检测疫苗剂量。利用荧光定量PCR技术对疫苗剂量进行使用前的检测,可以明显加快疫苗质量检测,比细胞检测病毒滴度更加快捷方便[10-12]。

表3 PRV弱毒活疫苗的病毒含量检测结果
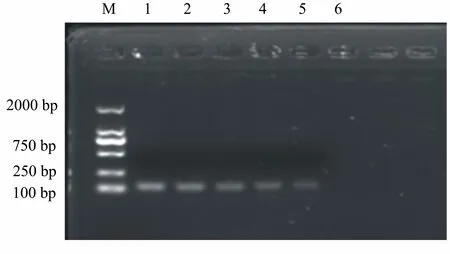
M: DL2000 Marker;1~6:pMD-gB质粒的浓度分别为1×109、1×108、1×107、1×106、1×105和1×104拷贝/μL。
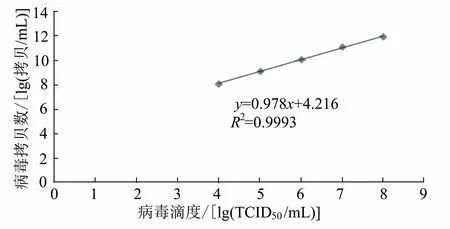
图6 用CPE法检测出的PRV滴度与用荧光定量PCR法测得的基因组拷贝数之间的线性关系
荧光定量PCR检测样品首先要构建重组质粒标准品,最为常见的建立DNA标准品的方法是向质粒载体中克隆一种病毒的基因序列。PRV的gB基因为2.8 kb,比其他基因保守,是PRV野毒株和基因缺失疫苗毒株的组分之一[8]。因此可以选择gB基因序列建立检测伪狂犬病基因缺失疫苗剂量的荧光定量PCR方法。针对PRVgB基因保守区构建重组质粒作为标准品,应用SYBR Green Ⅰ建立一种可检测PRV载量的荧光定量PCR方法。SYBR GreenⅠ实时荧光定量PCR相比于探针法荧光定量PCR具有成本低、应用范围广、变异系数低等特点[9]。
本方法采用gB基因标准质粒进行荧光定量PCR,结果显示倍比稀释的标准品荧光曲线相同,间距相等。到了低拷贝数间距变小,原始浓度与Ct值有明显的线性关系;本实验的扩增效率为2.039,接近于最高扩增效率2。说明本实验做出的标准曲线是成功的。重复性实验选取不同浓度的标准样品做多次重复检测,结果显示批内和批间重复性实验的变异系数均小于1%,可见本方法的重复性和稳定性较好。特异性实验结果显示,由本实验室保存的PCV2、PPV、JEV、CSFV和PRRSV的DNA或cDNA进行实时定量PCR扩增,结果均无特异性反应,说明本实验对PRV有良好的特异性。
相关研究发现,被测样品中原始目的基因的含量和PCR扩增产物的量有良好的对应关系,因此能通过对扩增产物的含量分析来反映被测病毒的实际含量[10-12]。在对多种病毒的研究中,荧光定量PCR检测病毒滴度已经得到应用,如腺病毒[10]、慢病毒[11]、杆状病毒[12]等。本实验对用荧光定量PCR法检测的PRV病毒基因拷贝数和用CPE法检测的PRV滴度进行了线性回归分析,相关系数为0.9993,说明两者间存在良好的相关性。因此,可以通过分析病毒拷贝数来确定病毒的感染滴度。2种方法比较,荧光定量PCR方法在实际应用中,样品从提取到检测大约要4 h,而CPE法则需要铺细胞板、接毒,在3~5 d后观察,总时间达5~7 d,而且所得结果有一定的主观性。因此,相对于CPE法,荧光定量PCR节省了大量时间,降低了测定者的主观性,更适于大型猪场进行疫苗的快速鉴定和筛选。在成本方面,由于分子生物技术的飞速发展,现在的试剂价格有了很大的降低,而人工成本则显著提高,因此荧光定量PCR的成本比CPE法低。但病毒受冻融、自身半衰期等因素的影响,感染性病毒数难免要低于总病毒颗粒数。因此,综合考虑,荧光定量PCR法检测PRV病毒滴度更适用于猪场进行疫苗的快速检测或新鲜病毒样品的检测。
PRVgE基因缺失弱毒疫苗含量是评价疫苗优劣的重要指标,我国的弱毒疫苗配苗标准为大于5×103TCID50/头份[6]。本实验选用江苏、江西和浙江地区广泛使用的7种PRVgE基因缺失弱毒疫苗,用荧光定量PCR方法对疫苗的病毒基因拷贝数进行检测。经定量PCR之后,采用建立的拷贝数和病毒滴度相互关系回归方程计算病毒滴度,结果显示各厂家的疫苗在配苗时病毒含量均高于国家制定的标准,应为各厂家在配苗时都考虑到了活疫苗的冻干、保存和冻融损失,与说明书标识含量基本相符。但不同厂家疫苗的PRV含量仍存在明显的差异,最高与最低含量甚至相差50倍以上,其中2种疫苗显著高于另外5种疫苗,这2种疫苗从病毒含量来看性价比更好,可能临床效果更好。但真实的临床免疫效果是否存在不同,需要临床试验进一步确认。
本研究建立了荧光定量PCR法来检测PRV的gB基因含量,结果表明荧光定量PCR测定的病毒拷贝数与CPE法检测的病毒滴度有较好的线性关系;对市售疫苗的检测结果说明所建立的荧光定量PCR法可以快速检测疫苗的病毒含量,具有很好的临床参考意义。

