鼠神经生长因子与川芎嗪注射液联合头部亚低温治疗对缺血缺氧性脑病新生儿血清MBP和GFAP水平的影响
丁泽卿 李小娟
(1.河南省周口市川汇区中医院儿科,河南 周口 466000;2.河南省安阳市第二人民医院儿科,河南 安阳 455000)
缺血缺氧性脑病(hypoxic-ischemic encephalopathy,HIE)以中枢神经系统异常为主要症状,若未及时处理,可引起脑瘫、癫痫等后遗症,且后遗症发生率高达35%[1],对新生儿生长发育及生命健康造成严重威胁。目前,针对HIE新生儿,临床尚无完整统一的治疗方法,主要通过头部亚低温、干细胞移植、高压氧等方法进行治疗。头部亚低温以物理方法将患者体温降低至预期水平,以起到保护脑细胞、治疗疾病的目的。鼠神经生长因子为临床常用药物,在促进中枢神经元生长、发育、修复再生等方面具有重要价值。川芎嗪注射液对于脑栓塞、脑血栓、脑供血不足等闭塞性脑血管疾病具有良好疗效。近年研究发现,血清髓鞘碱性蛋白(MBP)、胶质纤维酸性蛋白(GFAP)水平变化均能反映脑损伤严重程度[2-3]。本研究中通过观察鼠神经生长因子与川芎嗪注射液联合头部亚低温治疗后HIE新生儿康复进程及血清MBP、GFAP水平变化,以评估其治疗效果,报告如下。
1 资料与方法
1.1 病例纳入与排除标准 ①病例纳入标准:符合HIE诊断标准[4];娩出后1 min内Apgar评分不足3分;新生儿家属知情同意本研究。②病例排除标准:母体宫内感染的患儿;宫内感染、颅内出血者;合并先天畸形、先天代谢性疾病的患儿;对本研究药物过敏患儿。
1.2 病例 选取2017年1月—2019年1月河南省安阳市第二人民医院收治且符合病例纳入和排除标准的123例HIE新生儿,随机数字表法分为3组,每组41例。亚低温对照组男21例,女20例;胎龄36~42周,平均(38.79±0.78)周;体质量2.05~4.51 kg,平均(3.58±0.25)kg;病情严重程度[5]:9例重度,18例中度,14例轻度;亚低温+川芎嗪组男22例,女19例;胎龄36~41周,平均(38.62±0.85)周;体质量2.23~4.45 kg,平均(3.34±0.37)kg;病情严重程度:8例重度,19例中度,14例轻度;观察组男23例,女18例;胎龄36~41周,平均(38.52±0.91)周;体质量2.24~4.35 kg,平均(3.29±0.42)kg;病情严重程度:6例重度,20例中度,15例轻度。3组在胎龄、体质量、病情严重程度、性别等方面比较差异无显著性(P>0.05),具有可比性。本研究经我院伦理委员会审核通过。
1.3 方法 ①3组均行常规对症治疗,包括控制血压,限制液体输入量,纠正水、电解质失衡,维持动脉血气,降低颅内压,营养支持治疗,呼吸支持等。②亚低温对照组给予头部亚低温治疗,用降温帽包裹新生儿头部,放置体温探头于新生儿前额中心,启动并控制降温仪,使其保持在6~12 ℃,通过飞利浦多功能监护仪测定新生儿皮肤温度、直肠温度,体表温度控制在33~34 ℃,直肠温度控制在34.5~35 ℃,低温治疗持续72 h。然后利用远红外辐射加温床复温,速率设置为0.5 ℃/2 h。③亚低温+川芎嗪组给予头部亚低温联合川芎嗪注射液治疗,头部亚低温治疗方法同亚低温对照组,同时静脉滴注川芎嗪注射液(黑龙江福和华星制药集团股份有限公司,国药准字H20056623)5~8 mg/kg +30 ml质量分数为10%的葡萄糖溶液,1次/d,连续治疗14 d。④观察组给予头部亚低温联合川芎嗪注射液和鼠神经生长因子治疗,头部亚低温、川芎嗪注射液治疗方法同亚低温+川芎嗪组,同时肌内注射鼠神经生长因子(商品名恩经复,厦门未名生物医药有限公司,国药准字s20171207)18 μg/次,1次/d,连续治疗14 d。
1.4 疗效判定标准[6]经治疗后肌张力及原始反射恢复至正常水平,对外界刺激反应显著,无易激惹现象为显效;经治疗新生儿肌张力及原始反射趋于正常水平,对外界刺激反应一般,无易激惹现象为有效;经治疗各项临床症状及体征均无明显变化为无效。
1.5 观察指标 ①治疗14 d后治疗效果。有效率与显效率之和为总有效率。②神经反射恢复时间、意识恢复时间、肌张力恢复时间。肌张力恢复评估标准:参照改良Ashworth分级标准评估,待患儿肌张力恢复至0级时即为肌张力恢复。意识恢复评估标准:瞳孔恢复正常,无扩大或缩小,意识迟钝、嗜睡、昏迷等症状消失,对外界特定环境刺激偶可作出有目的的动作或情感反应。③新生儿神经行为。于治疗前、治疗3、14 d后,通过新生儿20项行为神经评分法(NBNA)[7]评估3组新生儿神经行为,包含被动肌张力、原始反射、行为能力、主动肌张力、一般状况等项目,分值越高提示新生儿脑损伤程度越轻。④脑神经功能恢复情况。于治疗前、治疗3、14 d后通过智力发育指数(MDI)[8]、心理运动发育指数(PDI)[9]评估3组新生儿脑神经功能恢复情况,分值越高提示新生儿脑神经功能恢复越好。⑤于新生儿开始治疗前1~2 d内、治疗3、14 d后抽取3 ml股静脉血,离心(3 000 r/min)取上清液,保存于-80 ℃环境中。应用酶联免疫吸附法(ELISA)检测3组血清MBP、GFAP水平,上海酶联生物科技有限公司提供试剂、试剂盒。⑥不良反应。
1.6 统计学处理 以SPSS 25.0统计学软件分析数据。计数资料以例数(百分数)表示,采用χ2检验;计量资料以x±s表示,多组间比较用单因素方差分析,两两比较用LSD-t检验;检验水准a=0.05。
2 结 果
2.1 临床治疗效果 治疗14 d后,观察组显效21例,有效18例,无效2例,总有效率95.12%。亚低温+川芎嗪组显效14例,有效17例,无效10例,总有效率75.61%。观察组显效12例,有效16例,无效13例,总有效率为68.29%。3组总有效率差异有显著性,以观察组最高,亚低温对照组最低(P<0.05)。见表1。
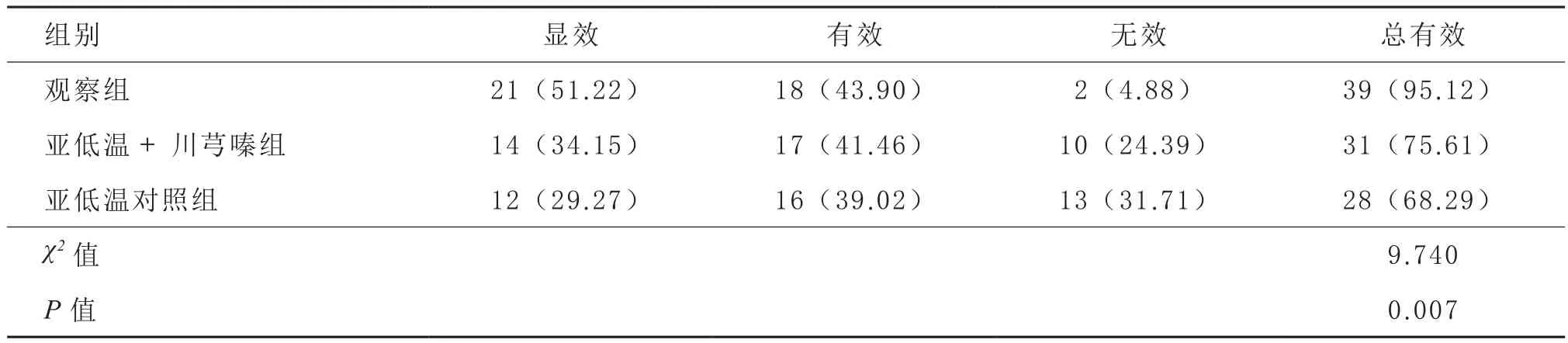
表1 3组治疗效果比较[n=41,例(%)]
2.2 临床症状改善情况 治疗14 d后,3组肌张力恢复时间、神经反射恢复时间、意识恢复时间相比,观察组短于亚低温对照组和亚低温+川芎嗪组(P<0.05)。见表2。
表2 3组临床症状改善情况比较(n=41,,d)
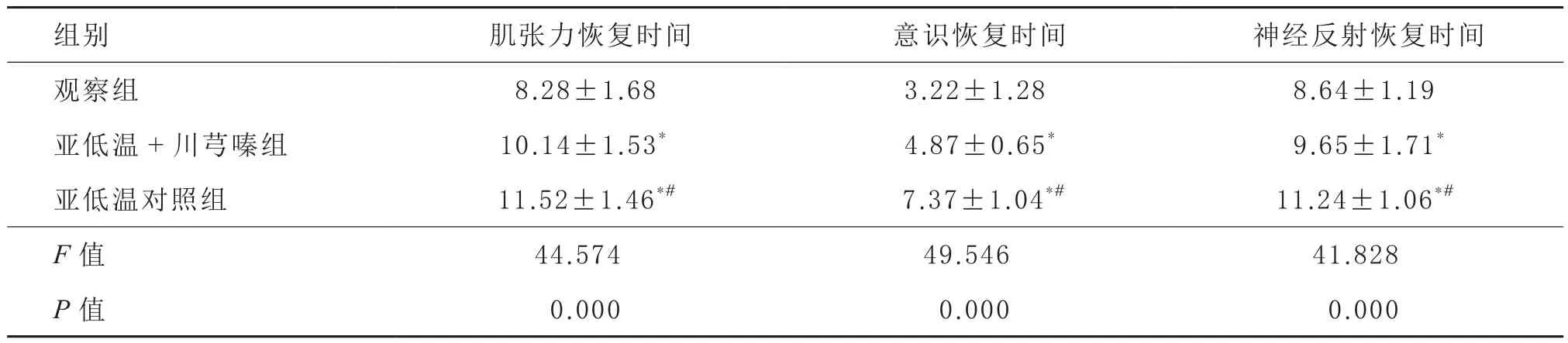
表2 3组临床症状改善情况比较(n=41,,d)
注:与观察组比较:*P<0.05;与亚低温+川芎嗪组比较:#P<0.05
组别 肌张力恢复时间 意识恢复时间 神经反射恢复时间观察组 8.28±1.68** 3.22±1.28** 8.64±1.19**亚低温+川芎嗪组 10.14±1.53** 4.87±0.65** 9.65±1.71**亚低温对照组 11.52±1.46*# 7.37±1.04*# 11.24±1.06*#F值 44.574 49.546 41.828 P值 0.000 0.000 0.000
2.3 NBNA、PDI、MDI评分 3组治疗前PDI、NBNA、MDI评分相比,差异无统计学意义(P>0.05);治疗3、14 d后观察组PDI、NBNA和MDI评分均高于亚低温对照组和亚低温+川芎嗪组,且亚低温+川芎嗪组PDI、NBNA和MDI评分高于亚低温对照组(P<0.05)。见表3。
2.4 血清MBP和GFAP水平 3组治疗前血清MBP和GFAP水平相比差异无统计学意义(P>0.05);治疗3 d后、14 d后观察组血清MBP水平低于亚低温对照组和亚低温+川芎嗪组(P<0.05),且亚低温+川芎嗪组低于亚低温对照组(治疗3 d后,P<0.05);治疗后14 d观察组血清GFAP水平低于亚低温对照组和亚低温+川芎嗪组(P<0.05)。见表4。
表3 3组NBNA、PDI和MDI评分比较(n=41,分)

表3 3组NBNA、PDI和MDI评分比较(n=41,分)
注:与观察组比较:*P<0.05;与亚低温+川芎嗪组比较:#P<0.05;与本组治疗3 d后比较:△P<0.05
PDI治疗前 治疗3 d后 治疗14 d后 治疗前 治疗3 d后 治疗14 d后观察组 29.72±1.98 32.04±2.03 38.21±2.69△ 63.63±7.07 78.42±5.68 92.38±6.35△亚低温+川芎嗪组 29.34±2.02 31.56±1.88 35.44±2.03*△ 64.18±6.46 75.21±6.27* 82.34±5.71*△亚低温对照组 28.94±2.46 30.25±2.33*# 33.51±2.91*#△ 64.52±6.99 70.26±5.31*# 79.23±6.16*#△F值 1.332 8.070 34.628 0.176 20.833 52.400 P值 0.268 0.000 00.000 0.838 00.000 00.000组别 NBNA MDI治疗前 治疗3 d后 治疗14 d后观察组 67.31±7.67 78.81±5.59 91.40±6.72△亚低温+川芎嗪组 66.57±6.69 73.45±6.05* 82.28±6.33*△亚低温对照组 65.70±7.22 71.07±6.38*# 80.35±6.93*#△F值 0.513 17.808 32.154 P值 0.600 00.000 00.000组别
表4 3组血清MBP和GFAP水平比较(n=41,)

表4 3组血清MBP和GFAP水平比较(n=41,)
注:与观察组比较:*P<0.05;与亚低温+川芎嗪组比较:#P<0.05;与本组治疗3 d后比较:△P<0.05
组别 MBP(μg /L) GFAP(ng/L)治疗前 治疗3 d后 治疗14 d后 治疗前 治疗3 d后 治疗14 d后观察组 24.91±5.32 10.33±3.44 5.50±2.64△ 110.64±36.55 85.26±24.82 69.61±28.74△亚低温+川芎嗪组 23.89±5.67 12.18±4.23* 7.01±2.33*△ 110.33±36.74 88.47±25.51 77.06±25.66*△亚低温对照组 23.16±6.05 14.46±4.08*# 8.07±2.87*#△ 109.57±37.12 93.03±24.16 85.48±26.59*△F值 0.979 11.351 9.943 0.009 1.013 3.538 P值 0.379 0.000 0.000 0.991 0.366 0.032
2.5 不良反应 观察组有2例恶心,1例呕吐,不良反应发生率为7.3%。亚低温对照组未发现不良反应。亚低温+川芎嗪组出现1例恶心,1例呕吐,不良反应发生率为4.9%。3组间不良反应发生率差异无显著性(χ2=2.919,P=0.232)。
3 讨 论
HIE是新生儿窒息后常见并发症之一,发病机制复杂,一般认为与兴奋性氨基酸毒性、氧自由基损伤、能量代谢障碍相关[10]。HIE发生时,可出现脑组织缺血缺氧,随病情不断进展,可出现线粒体氧化损伤,氧自由基大量生成、神经元能量缺乏等现象,进而导致细胞内钙离子超载,加重脑组织应激损伤,大量炎性细胞因子产生,炎症反应逐步扩大,最终导致脑细胞变性或坏死[11]。既往临床多采用钙离子拮抗剂、氧自由基清除、神经营养剂等措施,在缓解临床症状、延缓病情进展等方面具有一定作用,但长期疗效不佳,预后较差。
头部亚低温治疗为临床常用治疗手段,可增强脑组织对缺血耐受力,降低脑细胞新陈代谢,减少耗氧量,抑制氧自由基、一氧化氮生成,从而抑制神经细胞凋亡。研究显示, HIE发生6 h内予以头部亚低温治疗可最大程度发挥神经细胞功能保护作用[12]。但由于亚低温治疗无法修复已损害神经细胞,故需联合相应药物治疗[13]。鼠神经生长因子具有促神经突起再生长、营养神经元的双重生物学作用,可促使损伤神经纤维生长,形成功能性连接,增加损伤神经细胞存活率;且可通过刺激多种信号传导途径,调节神经细胞基因转录,提高其生物活性。同时鼠神经生长因子与人体神经生长因子存在高度同源性,故在营养周围神经、修复损伤神经元、缓解临床症状及体征等方面具有良好疗效。目前,头部亚低温治疗联合鼠神经生长因子治疗HIE效果已得到临床肯定[14]。川芎嗪注射液可通过建立线粒体ATP敏感性K+通道,促使K+内流,减少跨膜电位差,使膜去极化,阻碍Ca2+内流,从而减少线粒体内Ca2+超载现象[15]。川芎嗪注射液还可通过降低缺血部位血管内皮细胞黏附分子水平,改善血液微循环[16]。本研究结果显示,观察组治疗后临床总有效率及PDI、NBNA、MDI评分均高于亚低温对照组和亚低温+川芎嗪组,肌张力恢复时间、神经反射恢复时间、意识恢复时间均短于亚低温对照组和亚低温+川芎嗪组(P<0.05),充分说明鼠神经生长因子与川芎嗪注射液联合头部亚低温可提高HIE新生儿治疗效果,改善临床症状,保护神经功能。
MBP是中枢神经系统重要蛋白质,正常情况下其水平较低,一旦中枢神经系统出现病变并损伤髓鞘时,MBP水平可快速升高[17]。GFAP为中枢神经系统表达蛋白。脑组织缺血缺氧可刺激星形胶质细胞生成大量GFAP,进而刺激祖细胞分裂,生成新型星形胶质细胞。星形胶质细胞的过度增生可影响神经细胞修复及再生,不利于HIE新生儿神经功能恢复[18]。邓祖群等[19]研究显示,GFAP水平随HIE新生儿病情严重程度增加而升高。本研究中发现,观察组治疗后血清MBP、GFAP水平低于亚低温对照组和亚低温+川芎嗪组(P<0.05),充分说明鼠神经生长因子与川芎嗪注射液联合头部亚低温治疗具有协同增效作用,可减轻脑组织损伤,延缓病情进展。同时这3种治疗方案均具有较高安全性。
综上可知,鼠神经生长因子与川芎嗪注射液联合头部亚低温治疗可降低HIE新生儿血清MBP、GFAP水平,改善临床症状,保护神经功能,提高治疗效果,且安全性较高,其具体作用机制有待临床多中心、大样本研究证实。

