固有淋巴细胞在病毒感染性疾病中作用的研究进展
李倩文 白 羽 卞正颖 高 悦 郭 薇 田 野
(1.中国药科大学生命科学与技术学院,中国药科大学江苏省生物药物成药性研究重点实验室,江苏 南京 210009;2.南京医科大学附属儿童医院,江苏 南京 210008)
固有淋巴细胞(innate lymphoid cells,ILCs)最初作为CD4+T细胞亚群的镜像细胞而被广泛研究,但是近年来研究发现ILCs的功能具有多样性。一方面有研究发现ILCs可通过与上皮细胞、神经细胞和纤维母细胞等组织细胞相互作用影响组织发育、代谢和稳态等过程[1];另一方面ILCs可以像Th细胞亚群一样分泌细胞因子调控机体免疫,但是由于ILCs的分布特点及其表面不表达T细胞受体和B细胞受体,它可以迅速分泌细胞因子抵抗病原体入侵并修复受损组织[2]。此外ILCs可通过直接或间接与T或B细胞相互作用影响其生物学功能,调控机体适应性免疫,从而参与自身免疫性疾病、肿瘤和病毒或细菌感染性疾病的发生发展[2]。本文将从ILCs的分类及其可塑性、ILCs的适应性免疫调节作用和其在抗病毒免疫中的作用来综述ILCs的研究进展。
1 固有淋巴细胞分类及其可塑性
1.1 ILCs分类 ILCs是由淋巴祖细胞(common lymphoid progenitor cells,CLP)分化而来的一类具有淋巴细胞形态的异质性细胞群体,与常规T或B细胞不同的是ILCs表面缺乏T细胞受体或B细胞受体,但存在着白介素-7受体α(interleukin 7 receptor α subunit,IL7Rα,即 CD127)和IL-2Rα(CD25)的表达[2-3]。根据其是否具有细胞毒性可将其分为自然杀伤细胞(natural killer cell,NK细胞)和辅助性ILC。辅助型ILCs与Th细胞具有相同的关键转录因子和主要效应细胞因子,因此又被称为Th细胞的“镜像细胞”[3]。根据Th细胞亚群的分类方法,辅助性ILCs又可以分为ILC1、ILC2、ILC3。在核因子白介素3调节蛋白(nuclear factor interleukin-3-regulated protein,NFIL3)的调控下,CLP分化为固有淋巴细胞前体从而失去分化成T、B细胞的潜能,固有淋巴细胞前体可发育成为辅助型ILC前体,在转录因子调控下进一步分化成为ILC1、ILC2、ILC3亚群(见图1),其各个亚群具体的相关活化分子、分布特点及表型见表1。ILCs细胞亚群之间的平衡与免疫稳态息息相关。一方面,ILCs细胞过度激活会导致炎症和自身免疫性疾病的发生;另一方面,由于ILCs的组织驻留性,其在病原体入侵时可迅速释放细胞因子参与病原体的清除。

图1 ILCs亚群的分化和转分化过程

表1 人和小鼠体 内各个ILC亚群的特征
1.1.1 NK细胞 NK细胞是最早发现的固有淋巴细胞,主要通过抗体依赖性细胞介导的细胞毒作用和释放穿孔素、颗粒酶发挥抗病毒和肿瘤杀伤作用。固有淋巴细胞前体分化成NK细胞依赖于转录因子Eomes和T-bet,且IL-12、IL-18和IL-15的协调刺激可诱导NK细胞分泌γ干扰素(IFN-γ)。NK细胞在静息状态下低表达CD56,不表达CD16,经刺激活化后转变为具有细胞毒性的CD56dimCD16+的NK细胞,从而参与肿瘤和抗病毒免疫[8]。
1.1.2 ILC1细胞 尽管ILC1和NK细胞的分化成熟都依赖于T-bet,且二者都能分泌IFN-γ,但是ILC1的分化成熟独立于Eomes且不具有或者具有较低的细胞毒性,它主要通过分泌IFN-γ、IL-2和粒细胞-巨噬细胞集落刺激因子参与免疫调控,进而参与胞内菌、寄生虫和病毒的清除。ILC1是由共同辅助淋巴样细胞前体在GATA-3的调控下分化而来的,但是T-bet在维持ILC1表型及功能方面发挥重要作用。ILC1主要驻留在人扁桃体和肠道固有层内,在病原体入侵时组织微环境中IL-12和IL-18水平显著增加,可刺激ILC1迅速分泌IFN-γ参与抗病毒和抗细菌免疫。尽管大部分ILC1不具有细胞毒性,但是少量组织中驻留的ILC1表面会表达细胞毒性受体NKp44、NKp46和CD56,从而具有轻微的细胞毒作用[8]。
1.1.3 ILC2细胞 ILC2最早由DR等在2010年发现,其关键转录因子为GATA-3,主要通过分泌2型细胞因子如IL-5、IL-13等介导2型炎症反应,进而参与哮喘、过敏、慢性鼻窦炎合并鼻息肉等疾病的发生发展[5]。此外ILC2还可通过分泌表皮生长因子受体配体双调蛋白修复病毒或者细菌感染后的受损组织。ILC2主要存在于肠道组织、皮肤和呼吸道的黏膜组织中,其表面高表达IL-25受体(IL-17RB)、IL-33受体(ST2)、CRTH2和 CD161。病原体入侵引起微环境中的上皮细胞释放IL-25、IL-33和胸腺基质淋巴生成素(thymic stromal lymphopoietin,TSLP),促进ILC2分泌IL-13和IL-5,进而影响组织微环境中的免疫稳态。
1.1.4 ILC3和淋巴组织诱导细胞(lymphoid tissue inducer cells,LTi) ILC3的分化和功能维持依赖于RORγt,主要通过分泌3型细胞因子IL-17A和IL-22发挥免疫调控作用,调节肠道免疫[6]。根据其细胞表面是否表达趋化因子CCR6,ILC3可以分为CCR6-LTi和CCR6+ILC3[7]。LTi是最早发现的一类3型ILC细胞,LTi可在肿瘤坏死因子-α(TNF-α)和淋巴毒素β的刺激下促进胚胎时期淋巴组织的形成,且在出生后机体淋巴结和PP结(Peyer's patches)的形成中发挥重要作用[6]。除了LTi,根据其天然细胞毒性受体(natural cytotoxicity receptor,NCR)NKp46、NKp44和NKp30的表达量,人ILC3可进一步分为NCR+ILC3和NCR-ILC3两个细胞亚群[7]。人肠道总ILC中的70%均为NCR+ILC3,其表面高表达NKp44,低表达NKp46,主要通过分泌IL-22促进肠道炎症。小鼠NCR+ILC3表面高表达NKp46,其他表型和功能与人NCR+ILC3相似。NCR-ILC3主要分布在皮肤、肠道和上皮组织中,主要通过分泌IL-17A促进炎症发生,进而加剧结肠炎的发生。此外在IL-1β和IL-23的刺激下,NCR-ILC3在体外可以转变为NCR+ILC3。
1.1.5 其他ILCs亚群 Wang等[7]在2017年发现了一类新型ILC细胞亚群,并将其命名为调节性ILC(regulatory ILC,ILCreg),它主要通过分泌IL-10和TGF-β缓解肠道炎症。一方面,这类细胞不表达CD4和Foxp3,高表达CD25、IL-2R、Sca-1和CD90等ILC细胞特征分子,另一方面,ILCreg的分化成熟依赖于转录因子Id3和Sox4,但是不表达T-bet、Eomes、GATA-3和RORγt等其他ILC细胞亚群的关键转录因子。ILCreg不仅可以通过分泌IL-10直接抑制肠道炎症,还可以抑制ILC1和ILC3分泌IFN-γ和IL-17A,进一步缓解炎症反应[9]。此外Crome 等[10]在肿瘤组织中发现了一群CD56+CD3-IL-22+的ILC细胞。与NK细胞表征类似,这些细胞表面高表达NKp46,但是只具有轻微细胞毒杀伤作用,主要通过分泌IL-22抑制肿瘤浸润淋巴细胞的功能,从而介导肿瘤免疫耐受。随着高通量测序技术的发展,大数据分析将会帮助我们更加细致地了解ILC细胞分类及其生物学功能,发现更多的ILC细胞亚群。成熟的ILCs在特定组织中发挥相应的免疫调节作用,但是在特定的应激条件下ILCs的表型和功能会发生改变,以维持微环境中ILCs的平衡。
1.2 ILCs的可塑性 成熟的ILC存在可塑性,即在特定的应激条件下,其细胞形态和功能会发生改变,转分化为其他类型的ILC细胞亚群,从而打破机体ILCs亚群和免疫反应之间的平衡,进而影响疾病的发生发展。其可塑性主要表现为3个方面:①在特定免疫微环境的调节下,ILC3具有向ILC1转分化的潜能。有研究发现,克罗恩病患者肠道固有层中富含ILC1,而肠道微环境中的IL-12可以进一步诱导人ILC3转分化为ILC1从而分泌大量的IFN-γ,进而参与肠道炎症的发生,此外在体外该转分化过程可在IL-23/IL-1β/视黄酸的协同刺激下被逆转[11]。②ILC2也具有向ILC1转分化的潜能。在慢性阻塞性肺病患者的肺部组织中IL-1β和IL-12的水平显著上升,促使ILC2向分泌IFN-γ的ILC1细胞转变,进一步加重肺部炎症反应,但是该过程可被招募而来的嗜酸粒细胞所分泌的IL-4逆转[12]。此外在鼻窦炎患者的鼻息肉组织中也发现了类似现象,表明ILC2和嗜酸粒细胞之间可能存在着交叉调控,而这种交叉调控机制在由Th2和ILC2介导的炎症反应占主导地位的2型炎症反应的发生及维持过程中发挥重要作用[13]。③在特定的应激条件下,ILC2具有向ILC3转分化的潜能。Krabbendam等[14]利用金黄色葡萄球菌感染的鼻息肉上皮细胞和ILC2体外共孵育,发现上皮细胞分泌的IL-1β、IL-23和TGF-β可促使ILC2转分化为分泌IL-17A的ILC3。且在金黄色葡萄球菌感染引起的囊性纤维化患者体内发现,IL-17A+ILC3显著上升,而ILC2几乎耗竭,表明ILC2向ILC3的转分化与囊性纤维症的发生发展密切相关。虽然目前有大量研究报道ex-ILC1/ILC3可在IL-4的诱导下恢复ILC2的表征及功能,但是针对真正的ILC1或者ILC3是否具有向ILC2转分化的潜能目前尚无报道。
2 ILCs在适应性免疫中的作用
ILCs主要分布于黏膜组织,通过介导级联放大的炎症反应参与早期的免疫监视和调节。当病原体入侵时,一方面组织微环境中的上皮细胞或者基质细胞会分泌大量趋化因子和细胞因子,另一方面微环境中的髓系细胞如树突状细胞和单核细胞分泌细胞因子,招募ILCs并促进ILCs的活化;活化的ILCs可通过分泌细胞因子、抗原提呈和受体介导的细胞相互作用等方式调控T或B细胞的分化和功能,进一步影响机体适应性免疫。下面我们主要介绍ILCs与B细胞和CD4+T细胞亚群之间的相互作用。
2.1 ILCs和CD4+T细胞的相互作用 一方面,ILC和CD4+T细胞功能相似,但两者介导的免疫反应在时间和空间上功能互补,这种互补性在适应性免疫调节中发挥重要作用[15]。在时间上,组织驻留ILCs在其迁移前诱发组织微环境免疫,而多数CD4+T细胞必须首先表达归巢受体,并从次级淋巴器官迁移到效应位点进而诱发机体免疫反应。在空间上,ILCs在局部位点迅速诱发免疫反应,而后续激活的CD4+T细胞可进一步诱发全身或者局部的免疫反应。另一方面,ILCs不仅通过分泌细胞因子和趋化因子等间接性调控CD4+T细胞的迁移、分化和功能,还可以通过MHC II分子-T细胞受体和CD40L-CD40等介导的相互作用直接影响CD4+T细胞的分化和活性[16]。
2.1.1 ILC2和CD4+T细胞的相互作用 ILC2主要通过以下两个方面调控CD4+T细胞功能(见图2):①ILC2主要通过分泌细胞因子调控Th2或者调节性T细胞(Treg细胞)的分化和功能[17]。例如在小鼠模型中发现,ILC2通过分泌IL-13招募树突状细胞(DC细胞),进而促进Th2分泌IL-4或者诱发Th2介导的记忆免疫。此外ILC2通过分泌IL-4抑制Treg的免疫抑制作用,进而加剧食物过敏反应[17]。②ILC2通过MHC II分子-T细胞受体、OX40L-OX40、PD-L1-PD-1或 者 ICOS-ICOSL介 导的相互作用影响Th2或者Treg细胞的功能[18-20]。有研究发现,ILC2可作为抗原提呈细胞将抗原肽呈递给naïve CD4+T细胞,促进Th2细胞偏极化[18]。Schwartz等[19]发现,ILC2细胞表面PD-L1与naïve CD4+T细胞表面PD-1的结合不仅不会抑制CD4+T细胞激活,还可以促进GATA-3的表达进而促进Th2细胞分化。此外有研究表明ILC2可通过ICOS-ICOSL相互作用激活Treg细胞[17]。

图2 ILC2和T细胞或B细胞之间的相互作用
2.1.2 ILC3和CD4+T细胞的相互作用 ILC3主要通过以下两个方面调控T细胞功能(见图3):①ILC3主要通过分泌细胞因子和趋化因子等调控T细胞的迁移、分化和功能[6]。例如,LTi通过分泌胎儿淋巴毒素a招募CD4+T细胞迁移到肠道PPs中,进而促进B细胞分泌IgA[16]。此外小肠组织内的ILC3通过分泌大量IL-2维持Treg细胞的免疫抑制功能[21]。②ILC3可通过MHC II分子-T细胞受体、OX40L-OX40和CD30L-CD30等的结合直接影响CD4+T细胞迁移、分化和功能[22]。有研究发现,肠道ILC3可通过激活芳香烃受体信号抑制Th17介导的炎症反应。LTi可通过其细胞表面的OX40L结合记忆性CD4+T细胞表面的OX40,从而激活免疫记忆。Von Burg等[23]发现外周血中的NCR-ILC3s可在体外摄取抗原,并通过MHC II分子将抗原呈递给CD4+T细胞,促进CD4+T细胞的活化和增殖。
2.2 ILCs和B细胞的相互作用 ILCs不仅可以调控T细胞功能,还可以影响B细胞的生存,分化成熟,增殖和分泌IgA、IgG、IgM和IgE的能力(见图2和图3)。例如有研究发现普通变异型免疫缺陷病(common variable immunodeficiency)患者体内ILC2水平和IgD+IgM+MZ B细胞水平呈显著负相关关系[24]。此外, Drake等[20]将IL-33刺激活化的ILC2和B细胞共孵育,发现ILC2不仅可以促进B1和B2细胞的增殖,还可以增强其IgM、IgG1、IgA和IgE的分泌。ILCs主要通过以下2个方面调控B细胞分化、生存和功能(见图2):①ILCs通过分泌IL-5等细胞因子或者趋化因子间接调控B细胞功能;在伴有胸膜炎症小鼠模型中发现棉鼠丝虫(Litomosoides sigmodontis)感染引起脂肪相关淋巴细胞集群(fatassociated lymphoid clusters)基质细胞分泌IL-33,促进ILC2分泌IL-5进而增强B细胞分泌IgM的能力[25]。此外,利用IL-5缺陷型小鼠体内的ILC2与B细胞体外共孵育,结果发现,IL-5-ILC2并不会影响B细胞IgM的分泌[20]。②ILCs可通过受体介导的细胞相互作用直接调节B细胞的分化和功能。Komlosi等[26]发现,人扁桃体中的ILC3可通过分泌B细胞活化因子促进B细胞分泌IL-15,进而诱导自身CD40L的表达,且该CD40L+ILC3可与B细胞表面CD40相互结合增强B细胞存活、增殖和分泌IL-10的能力。另有研究表明,人外周血中的ILC2通过CD40L-CD40的相互结合直接促进B细胞分泌IgE。此外,在慢性鼻窦炎患者的鼻息肉组织中,ILC2可能通过ICOSICOSL结合直接诱导B细胞表达EBI2(卵泡外浆细胞表面分子标记),表明在不依赖生发中心介导的B细胞经典活化途径情况下,ILC2仍可促进B细胞的活化[27]。
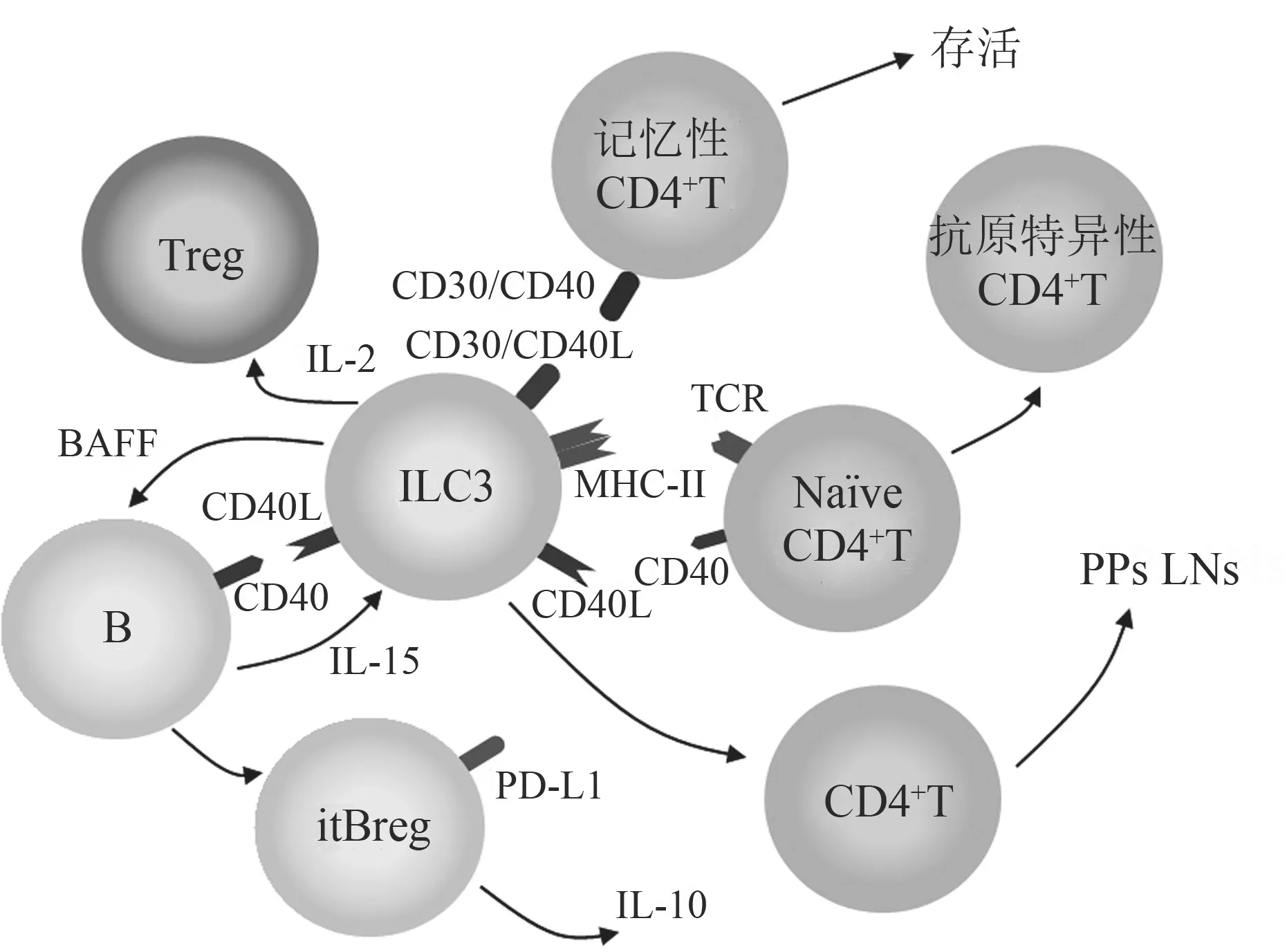
图3 ILC3和T细胞或B细胞之间的相互作用
3 ILCs在抗病毒免疫中的作用
组织驻留ILCs在早期免疫监视和免疫调节中发挥重要作用。在病毒感染初期,一方面,ILCs可迅速感应到微环境中的危险信号,分泌IFN-γ等大量细胞因子参与黏膜抗病毒免疫[15];另一方面,ILCs可通过分泌细胞因子、抗原提呈和配体介导的细胞相互作用影响T细胞或B细胞的迁移、分化和功能,进一步调控机体固有免疫和适应性免疫,影响病毒感染性疾病的发生发展[17]。
3.1 ILC1在抗肝炎病毒免疫中的作用 丙型肝炎病毒(HCV)或乙型肝炎病毒(HBV)等肝炎病毒感染通常会引发肝炎、肝硬化乃至肝癌等疾病。与其他组织驻留ILC1相比,肝脏驻留ILC1细胞表面高表达肿瘤坏死因子相关凋亡诱导的配体(TNF-related apoptosis-inducing ligand,TRAIL)和FasL等配体[28],具有较高的细胞杀伤毒性,在调节肝脏免疫中发挥重要作用。有研究报道乙肝患者外周血ILC1水平显著上升,表明ILC1在HBV感染中发挥重要作用。一方面肝脏驻留NKG2A+ILC1可消除CD8+T细胞介导的抗病毒免疫,引起肝脏内HCV或者肝腺病毒的免疫逃逸[29]。此外,在HCV感染患者体内,ILC1表面NK细胞抑制性受体2A(NKG2A)表达水平升高,阻断ILC1表面NKG2A受体作用可提高机体对HCV的清除能力[29]。另外,肝脏驻留ILC1可通过分泌IL-22促进肝脏细胞再生,修复受损肝脏[30]。cNK还可通过其细胞表面的TRAIL直接杀伤肝星形细胞,进而防止肝硬化的发生[31]。但是TRAIL+ILC1是否具有杀伤肝星形细胞的能力仍待探讨。基于以上研究,通过靶向抑制肝脏驻留ILC1或其相关分子可缓解或者治疗病毒感染诱发的肝脏疾病。
3.2 ILC2在抗呼吸道合胞病毒(respiratory syncytial virus, RSV)免疫中的作用 RSV感染通常会引起下呼吸道感染,进而诱发肺炎、支气管炎和哮喘,多发于2岁以下婴幼儿[32-33]。ILC2主要位于新生儿的肺部和呼吸道黏膜组织,在修复受损的呼吸道黏膜和维护肺组织稳态方面发挥重要作用。ILC2在抗RSV感染中发挥双面作用,一方面在不依赖于适应性免疫的情况下,TSLP激活的ILC2通过分泌大量IL-13和IL-5诱发气道高反应性,引发哮喘[34]。另一方面在促炎因子IL-12和IL-18的刺激下,ILC2可转分化为ILC1,通过分泌大量的IFN-γ参与RSV的清除[12]。此外,在H1N1等其他呼吸道病毒感染中也发现ILC2的“双刃剑”作用,ILC2的功能转变受到雄激素和雌激素信号的调节[35]。基于以上研究,通过靶向抑制ILC2的功能或者促进ILC2的转分化可缓解并改善呼吸道病毒感染引起的哮喘或者肺炎等相关疾病。
3.3 ILC3在抗人类免疫缺陷病毒( human immunodeficiency virus,HIV)免疫中的作用 HIV感染通常会破坏肠道屏障,导致肠道微生物转移,诱发全身免疫激活并加剧疾病进程[36]。ILC3在调节肠道炎症和维护肠道免疫稳态中发挥重要作用。有研究发现,HIV感染患者体内ILCs的耗竭与疾病炎症程度密切相关,但早期接受抗病毒治疗的患者体内ILCs水平明显回升[37]。Kramer等[38]发现,患者结肠中的ILC3水平和患者血清中的肠型脂肪酸结合蛋白(I-FABP)和sCD14存在明显的负相关关系,表明ILC3的缺失与HIV患者肠道屏障损坏和肠道微生物转移密切相关。此外,在接种猴免疫缺陷病毒(simian immunodeficiency virus,SIV)的SIVmac251疫苗的恒河猴体内发现NCR+ILC3可降低机体对SIV的敏感度[37]。这些研究都证明了ILC3在抗HIV免疫中的重要作用。目前对HIV患者体内ILC3耗竭的原因尚不完全清楚。但是有研究利用人源化小鼠模型证明HIV可能通过激活pDCIFN-I和CD95/FasL途径介导ILC3的凋亡。感染患者肠道菌群代谢产物可通过TLR3或者TLR4介导的信号通路诱导ILC3的凋亡,此外ILC3的耗竭可能与机体长时间缺乏Th17和Th22等CD4+T细胞密切相关[37]。基于以上研究,通过抑制ILC3凋亡或者重塑ILC3功能可以缓解并改善HIV的疾病进程。
4 展 望
近10年来,随着相关研究的不断深入,人们对ILCs的分类、分化发育、细胞和生物学功能及其在疾病发生发展中的作用有了更进一步的了解。ILCreg的发现进一步完善了ILCs家族成员,但未来我们仍需结合高通量测序技术进一步探讨ILCs的分类和分化发育图谱,完善ILCs的家族图谱。
鉴于不同ILCs亚群的分布特点及其在免疫监视、免疫维护、稳态维持和组织修复中的重要作用,ILCs细胞有望成为病毒感染性疾病的治疗靶点。通过抑制或阻断ILCs的活性及相关因子的表达,有助于缓解和治疗过敏性哮喘或慢性炎症相关疾病,而激活ILCs活性可帮助机体抵抗病原体入侵或修复受损组织。例如,由于ILCs表面表达PD-1、CD160和CD96等分子[5],因此可通过相应的免疫检查点抑制剂激活ILCs的功能,增强其抗病毒或肿瘤活性。此外也可利用相应细胞因子抗体抑制ILCs活性,用于治疗过敏性哮喘和慢性炎症性疾病。但是由于目前对ILCs亚群的分化发育尚未完全清楚,限制了ILCs亚群特异性治疗靶点的发现。
此外在特定的应激条件下,成熟的ILCs会转分化为其他类型的ILCs细胞亚群从而打破机体ILCs亚群和免疫反应之间的平衡,进而影响疾病的发生发展,但是对其具体的转分化机制和调控信号目前尚不清楚。因此未来针对调控ILCs转分化的靶点进行药物设计将为RSV感染诱发的哮喘等病毒感染性疾病的治疗提供新的研究方向。

