甲状腺乳头状癌组织常染色体和性染色体STR基因座变异分析
刘 奇,张海霞,董婷婷,党 珍,侯秀迪,赵 帅,韩亚文,王业全,*,崔 文,*
(1.济宁医学院法医学与医学检验学院,山东济宁 272067;2.济宁医学院司法鉴定中心,山东 济宁 272013;3.青岛大学医学部,山东 青岛 266071)
自20世纪90年代早期,短串联重复序列(short tandem repeats,STRs)被应用于法医遗传学领域,经过20多年的发展,基于复合PCR扩增和毛细管电泳(capillary electrophoresis,CE)的STR分析方法已经成为法医遗传学的金标准,所得到的STR分型图谱在犯罪案件中的个体识别、亲权鉴定等司法实践中发挥着重要作用。但是,同一个体不同组织细胞中的基因组DNA序列是一致的,这是根据DNA序列认定同一性的前提条件,并且对各STR基因座稳定性、突变率的认识及评价都是建立在对正常人体组织验证基础之上的[1]。
当代社会中肿瘤的发病率逐年上升,在司法鉴定实践中不可避免地会遇到要求对非正常人体组织(恶性肿瘤组织)检材涉及的案件进行鉴定,如患者怀疑医院调错术后组织导致误诊,要求对医院提供的肿瘤组织与患者自身进行鉴定。研究表明,肿瘤组织中STR基因座更容易发生高于正常组织的变异[2-3],表现为:①等位基因增加(additional alleles);②出现新等位基因(new alleles);③杂合性完全丢失(loss of heterozygous);④杂合性部分丢失(partial loss of heterozygous)[4],因此不能照搬正常组织的评价体系作出肯定或否定评判标准。目前一些解决方法尝试从肿瘤组织筛选更稳定的遗传标记,或者在STR变异的基础上进行身源鉴定算法的研究或者采用显微切割获取肿瘤组织中肿瘤细胞邻近正常组织等方面进行了研究。
甲状腺癌是临床常见的头颈部肿瘤,属于内分泌系统最常见的恶性肿瘤之一,其发病率逐年升高。按组织病理形态可分为乳头状癌、滤泡癌、髓样癌和未分化癌4种亚型,其中甲状腺乳头状癌(Papillary thyroid carcinoma,PTC)最常见。孙丽娟等人对9例妇科肿瘤组织进行显微切割研究,其间质细胞与癌旁组织的DNA分型结果完全一致,有7例肿瘤细胞与肿瘤组织的STR分型结果不一致,表明显微切割准确分离间质细胞可获得肿瘤组织正确的STR分型而不受肿瘤组织的干扰,能够代表肿瘤来源个体的正常DNA分型,是解决此类案件肿瘤组织身源鉴定的有效手段[5]。本文拟通过显微切割技术分离肿瘤细胞和间质细胞,选择多态性较高的21个常染色体、27个Y染色体和16个X染色体STR基因座对肿瘤细胞、间质细胞和癌旁正常组织进行了基因型检测,探讨甲状腺乳头状癌组织STR突变情况以及显微切割技术在PTC组织鉴定中的应用并结合患者临床资料进行变异相关性分析。
1 材料与方法
1.1 样本来源
收集43例病理明确诊断的甲状腺乳头状癌患者手术切除的癌组织和癌旁正常组织,所用样本均来自济宁医学院附属医院病理科,-80℃冷冻保存。其中男性13例,女性30例;青年组21例(20~44岁),中老年组(≥45岁)22例;甲状腺乳头状癌Ⅰ期24例,Ⅱ期11例,Ⅲ期8例[参照《AJCC肿瘤分期手册》(第7版)]。
1.2 主要试剂和仪器
Goldeneye®DNA 22NC试剂盒(含21个常染色体STR 基 因 座 : D4S2366、 D6S477、 GATA198B05、D15S659、D8S1132、D3S1358、D3S3045、D14S608、D17S1290、D3S1744、D2S441、D18S535、D13S325、D7S1517、D10S1435、D11S2368、D19S253、D1S1656、D7S3048、D10S1248 和 D5S2500), Goldeneye®DNA 27YB试剂盒(含27个Y染色体STR基因座:DYS456、YGATAH4、DYS439、DYS19、DYS392、DYS576、DYS518、DYS438、DYS389II、DYS390、DYS389I、DYS393、DYS627、DYS391、DYS437、DYS570、DYS635、DYS448、DYS533、DYF387S1a/b、DYS460、DYS458、DYS481、DYS385a/b和DYS449)和Goldeneye®DNA 17X试剂盒(含16个X染色体STR基因座和1个性别鉴定基因座:DXS6795、DXS9902、DXS8378、HPRTB、GATA165B12、DXS7132、DXS7424、DXS6807、DXS6803、GATA172D05、DXS6800、DXS10134、GATA31E08、DXS10159、DXS6789、DXS6810和Amelegin),均购自北京基点认知技术有限公司。
CM1850型冰冻切片机型冰冻切片机,Leica LMD6500激光显微切割系统购自德国MICROM公司;9700型PCR扩增仪和ABI 3500遗传分析仪均购自美国AB公司。
1.3 方法
制作甲状腺癌样本冰冻切片,置于聚萘二甲酸乙二醇酯(polyethylene naphthalate,PEN)膜片上,经苏木素染色后,用Leica LMD6500激光显微切割系统分别切取一定量的肿瘤细胞和肿瘤间质。取适量肿瘤细胞组织、肿瘤间质和癌旁正常组织,分别置于1.5 mL离心管中,纯水清洗1次,加入200μL Chelex-100,4μL蛋白酶K(20 mg/mL)和2μL DTT溶液,在振荡器上震荡混匀,置于恒温振荡器56℃过夜,然后金属浴100℃、8 min,最后130 000 r/min离心3 min,留取上清液备用。
采 用 Goldeneye®DNA 22NC、Goldeneye®DNA 27YB(和Goldeneye®DNA 17X试剂盒,按照操作说明书,在9700扩增仪上进行扩增。采用ABI 3500遗传分析仪分离扩增产物,Data Collection 3.1软件收集数据,GeneMapper ID-X软件分析数据得到每个样本的STR分型。对于出现的STR分型变异样本,重复检验1次进行确认。
1.3 统计分析
根据检测结果,统计STR变异类型,采用计数法统计STR突变情况,结合患者临床资料,应用R3.5软件进行卡方检验,探讨其相关性,检验水准α=0.05。
2 结果
2.1 激光显微切割
1例PTC患者癌组织样本激光显微切割前视野下可以清晰区分肿瘤细胞和间质细胞(图1A),选取肿瘤细胞区域进行显微切割分离肿瘤细胞(图1B)。

图1 甲状腺乳头状癌组织肿瘤细胞显微切割(×200)
2.2 同一个体肿瘤间质细胞与癌旁组织STR分型结果比对
经Goldeneye®DNA 22NC、Goldeneye®DNA 27YB和Goldeneye®DNA 17X试剂盒进行常染色体和性染色体STR基因座检测,43例PTC患者肿瘤间质细胞与对应癌旁组织的STR分型一致。
2.3 同一个体肿瘤细胞与间质细胞STR分型结果比对
43例PTC患者肿瘤细胞和间质细胞,经Goldeneye®DNA 22NC试剂盒进行常染色体STR基因座检测,36例分型结果一致,有7例肿瘤细胞的STR基因座分型结果发生7次变异(图2)。第1例肿瘤细胞在D3S1358基因座出现新等位基因,分型结果由15、17变异为15、16。第2例肿瘤细胞在D1S1656基因座等位基因增加,分型结果由11、15变异为11、13、15。第3例肿瘤细胞在D10S1435基因座等位基因增加,分型结果由11、13变异为11、12、13。其余4例肿瘤细胞分别在D17S1290、D5S2500、D15S659和D8S1132基因座出现等位基因部分杂合性丢失,分型结果分别为15、18,11、12,12、16和18、19。
43例PTC患者肿瘤细胞和间质细胞,经Goldeneye®DNA 17X试剂盒进行STR基因座检测,39例分型结果一致,有4例肿瘤细胞的STR基因座分型结果发生4次变异(图3)。第1例肿瘤细胞在DXS7424基因座等位基因增加,分型结果由15,17变异为15、16、17。第2例肿瘤细胞在DXS9902基因座出现新等位基因,分型结果由纯合子12变异为杂合子10、12。其余2例肿瘤细胞分别在HPRTB和DXS7424基因座发生等位基因部分杂合性丢失,分型结果分别为13、14和14、15。13例PTC男性患者肿瘤细胞和间质细胞,经Goldeneye®DNA 27YB试剂盒进行Y染色体STR基因座检测,分型结果一致。
43例PTC患者肿瘤细胞联合进行常染色体和X染色体STR基因座检测,9例肿瘤细胞的STR基因座共发生11次变异,其中等位基因增加3次,部分杂合性丢失6次,出现新等位基因2次。其中1例肿瘤细胞同时发生2次变异(常染色体和X染色体STR基因座各1次),即出现新等位基因1次、等位基因增加1次;另1例肿瘤细胞也同时发生2次变异(常染色体和X染色体基因座各1次),均为部分杂合性丢失。剩余7例各发生1次变异。Y染色体STR基因座没有检出变异。

图2 甲状腺乳头状癌细胞常染色体STR基因座变异
2.4 STR变异结合相关临床资料分析
2.4.1 STR变异与甲状腺乳头状癌分期 实验结果结合患者临床分期,经Fisher's Exact Test,在21个常染色体与16个X染色体STR基因座的变异与PTC患者的临床分期无明显相关关系(P>0.05);常染色体和X染色体联合检测的37个STR基因座的变异与PTC患者的临床分期无明显相关关系(表1)。

表1 STR基因座突变与临床分期相关性
2.4.2 STR变异与患者性别 实验结果结合患者性别,经Fisher's Exact Test,在21个常染色体与16个X染色体STR基因座的变异与PTC患者的性别无明显相关关系(P>0.05);常染色体和X染色体联合检测的37个STR基因座的变异与甲状腺乳头状癌患者的性别无明显相关关系(表2)。
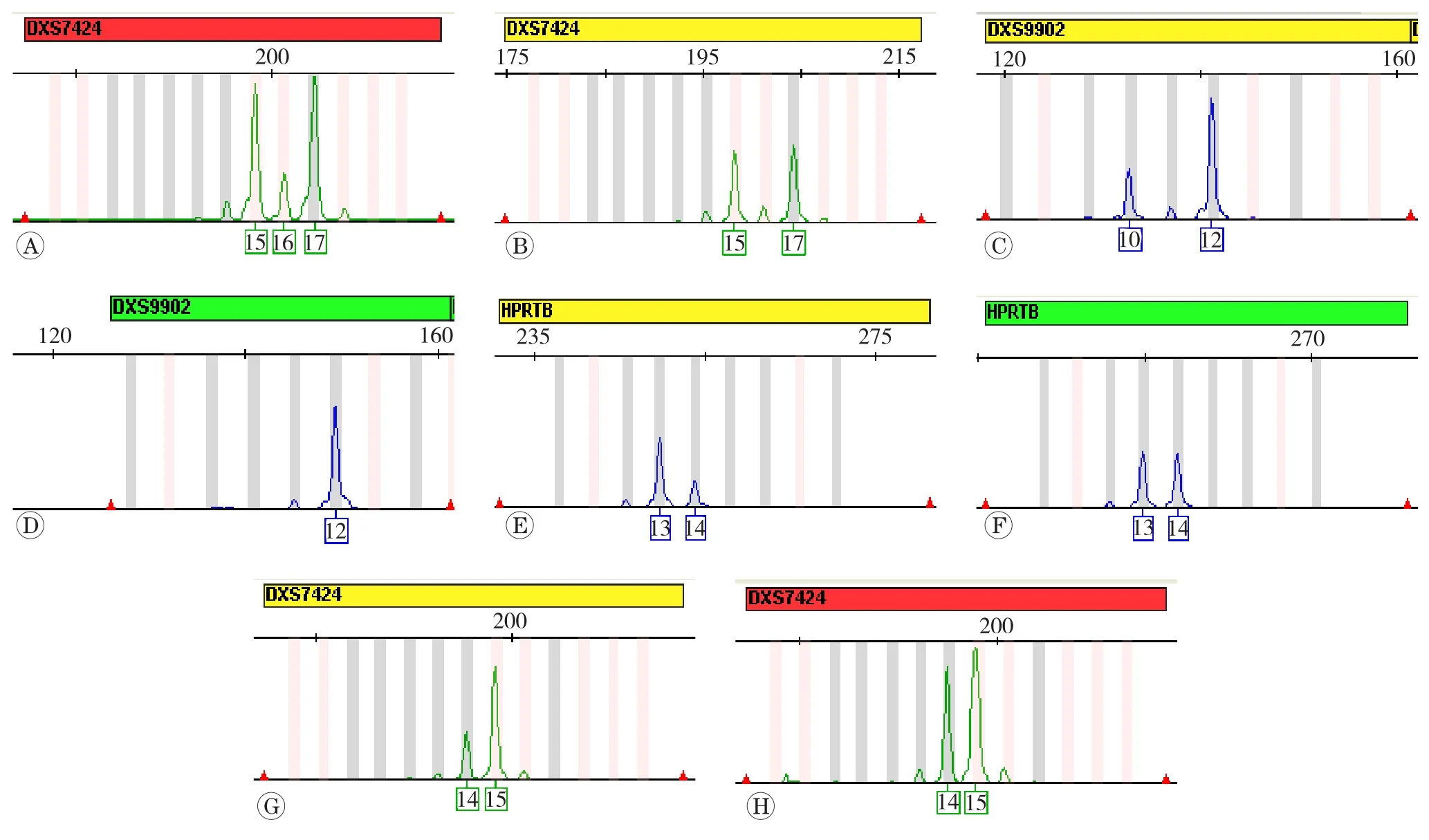
图3 甲状腺乳头状癌细胞X染色体STR基因座变异

表2 STR基因座突变与患者性别相关性
2.4.3 STR变异与患者年龄 实验结果结合患者年龄,经Fisher's Exact Test,在21个常染色体,STR基因座的变异在中老年组中变异率较高(P=0.008 9);16个X染色体STR基因座的变异与PTC患者的年龄无明显相关关系(P>0.05);常染色体和X染色体联合检测的37个STR基因座,变异在中老年组中变异率较高(P=0.021 3,表3)。

表3 STR基因座突变与患者年龄相关性
3 讨论
STR又称微卫星DNA或简单重复序列,以相对恒定的短序列作为重复单位,首尾相接,串联连接形成。STR基因座多态性程度高、突变率低以及良好的扩增稳定性,结合毛细管电泳可以实现DNA分型的标准化,因而广泛应用于个体识别以及亲缘关系鉴定。
相较于正常组织,同一个体的恶性肿瘤组织STR基因座存在显著的突变从而导致基因型改变,这种改变远高于其在减数分裂过程中的自发突变。基因型的改变违背了根据DNA序列认定同一性的前提条件,会导致错误的排除结论或者得不到明确的结论。STR基因座变异表现为DNA结构性等位基因的大小发生改变,即等位基因增加、出现新等位基因;一个基因座两个杂合子等位基因中的一个全部或部分缺失,即等位基因杂合性完全丢失、等位基因杂合性部分丢失。在这4种变异类型中,等位基因增加、出现新等位基因和等位基因杂合性完全丢失均可以引起基因型的改变,依据电泳图谱可以方便的进行判断。正常组织STR基因座经PCR扩增和毛细管电泳后会出现等位基因峰信号不均衡现象,国际法医遗传协会推荐杂合性均衡比应大于等于0.6[6]。国外曾有学者提出以肿瘤组织杂合子基因座两等位基因峰高或峰面积比值与相应正常组织对应基因座两等位基因峰高或峰面积比值的比值比(<0.5或>2.0)作为判断肿瘤组织杂合性部分丢失的判定标准。考虑到PCR扩增和毛细管电泳等因素的影响,李成涛等对肿瘤组织等位基因部分杂合性丢失的判定标准进行了适用性评估,表明以峰高比值比<0.5或>2.0作为部分杂合性丢失判定方法和标准适用于肿瘤组织的分型研究,即比值比=正常组织等位基因峰高比值/肿瘤组织等位基因峰高比值[7],在本研究中以此作为杂合性部分丢失的判断标准。
实体肿瘤组织中除含有肿瘤细胞外还含有间质细胞、结缔组织、浸润的炎细胞等杂细胞。不同种细胞含量的差异加之个体间的差异从而导致实体肿瘤组织具有高度的不均一性,致使在分子水平不能真实反应肿瘤细胞本身的变化[8]。激光捕获显微切割技术(laser capture microdissection,LCM)能够快速、准确、无损伤的进行单细胞分离,显著解决组织细胞异质性的影响,是进行分子病理学及肿瘤学研究的一项重要技术。目前,LCM技术已被广泛用于多种组织的分子生物学研究。Liu等[9]报道了1例在被检父尸体火化后对仅保留的胃肠道肿瘤组织进行亲子鉴定的案例。在肿瘤组织分型异常的情况下,采用显微切割技术分离邻近非肿瘤组织进行分型检测,结果显示非肿瘤区域DNA不存在等位基因改变,可以将其作为假设父的基因分型。刘彬等[10]通过显微切割更精确地了解和评价不同病理类型宫颈腺癌中的HPV感染及分布状况。因此,本文采用LCM技术分离43例PTC组织中的肿瘤细胞和间质细胞,与癌旁正常组织进行对比,对常染色体和性染色体STR基因座的基因突变进行了分析研究。
方建新等人对13个STR位点在55例人消化系统肿瘤组织中的变异分析表明,有2例肿瘤组织的STR位点发生了变异,变异类型包括基因型改变、杂合型丢失和杂合双峰不平衡,并且可以在多位点同时发生变异[1]。马若翔等[11]对75例肺癌组织的20个常染色体STR基因座及Amelegin基因座变异规律研究显示,癌组织变异率达32%,4种变异类型共检出55次变异。孙丽娟等人对62例妇科恶性肿瘤组织的20个常染色体和12个X染色体STR基因座突变分析显示,46.77%的妇科恶性肿瘤组织中观察到4种STR突变类型[5]。本实验选取内分泌系统最常见的恶性肿瘤之一的PTC作为研究对象,旨在为特殊检材的个体识别及亲缘鉴定提供参考,并结合相关临床资料,研究PTC组织中STR基因座的变异规律。本研究发现从PTC组织中分离的肿瘤邻近间质细胞与癌旁正常组织的DNA分型结果均一致,提示我们在无法获取PTC患者正常组织的情形下可分离肿瘤间质组织进行DNA分型,可代表肿瘤患者正常的基因分型。在后续实验中中,我们将加大样本量进一步验证肿瘤间质的稳定性。联合检测PTC患者肿瘤细胞的常染色体和X染色体共计37个STR基因座,在9例肿瘤细胞共检出11次变异(常染色体变异7次,X染色体变异4次),其中等位基因增加3次,部分杂合性丢失6次,出现新等位基因2次,并且同一PTC肿瘤细胞可同时发生多种变异。相比于常染色体和X染色体,Y染色体STR基因座没有观察到变异。因此相较于正常组织或肿瘤间质,肿瘤组织或肿瘤细胞容易发生突变,进行DNA分型时应多加慎重。
PTC是在多基因、多因素联合作用下,细胞生长、分化的刺激因素和基因突变因素共同作用导致甲状腺正常细胞转变为肿瘤细胞[12]。肿瘤分子生物学研究证实有两种方式的基因变异最终导致细胞分裂和增殖活动调控失常而发生肿瘤。一种是肿瘤抑制基因(TSG)2个位点相继点突变和杂合性缺失(LOH)变异,从而引起TSG持续功能丧失,即Knudsen“二次打击”理论;另一种是错配修复基因的突变导致核苷酸水平遗传不稳定性,称为微卫星不稳定性(microsatellite instability,MSI),可导致点突变或小片段插入/缺失[13-14]。MSI改变可作为肿瘤细胞克隆的分子标志,在近年的研究中提出可将人体组织STR变异作为癌症的易感指标之一[15]。结合目前实验结果和患者临床资料,我们发现PTC组织的STR变异与与患者临床分期、性别关系不显著,与患者年龄差异有统计学意义,说明年龄大的PTC肿瘤组织较易发生变异,故今后在此类检材的鉴定工作中,对于年龄大的案例应更加慎重。马若翔等人发现肺癌肿瘤组织的STR变异与肺癌的病理分型、患者性别关系不大,与肺癌的分期及患者年龄差异有统计学意义[11]。本研究没有发现PTC组织的STR变异与患者临床分期的相关性,推测与显微切割的样本数目较少有关。本研究拟以存在突变的STR基因座作为PTC可能的候选基因,在下一步研究中将加大样本量进行变异相关研究以评价其在PTC的筛查、诊断以及预后疗效评价应用的可能性。
综上所述,在司法实践中,基因型改变和杂合性丢失的DNA变异会严重影响STR分型结果。PTC肿瘤细胞中常染色体和X染色体STR基因座存在变异,而且变异更可能在年龄大的PTC组织中发生,进行STR分型时应谨慎判型。显微切割技术可准确区分肿瘤细胞和间质细胞,是解决此类恶性肿瘤组织检材涉及的案件进行身源鉴定的有效手段。鉴于本实验样本的有限性,在后续实验中,我们将加大显微切割样本量,进一步验证PTC肿瘤间质的稳定性。

