利用中国仓鼠肺细胞体外微核试验评价三七提取液的遗传毒性
唐 娇,杨 颖,李 庆,赵 敏,*,杨杏芬,3,*
(1.广东省疾病预防控制中心卫生毒理所,广东广州 511430;2.广东省公共卫生研究院健康风险评估研究室,广东 广州 511430;3.南方医科大学食物安全与健康研究中心,广东广州 510515)
三七是我国的传统中药,具有很高的药用价值。由于其具有活血化瘀[1]、调节免疫系统功能[2]、保肝[3-4]、降血脂及防止动脉粥样硬化[5]的作用,近些年被广泛用于日常保健及保健食品的开发利用。但是,对于三七的安全性评价资料多是零散、不成体系的,尤其是遗传毒性评价资料更是鲜见,而体外微核试验由于其可以简便、快速、准确地检测出断裂剂和非整倍体诱导剂故广泛应用于化合物遗传毒性筛选及评价[6-7]。鉴于此,本研究拟通过体外微核试验对三七提取液的遗传毒性进行初步评价,为其开发利用提供科学依据。
1 材料与方法
1.1 材料
1.1.1 受试物 三七购于广州健安堂药业有限公司,产地为云南文山州。机械粉碎成粉末,经中国广州分析测试中心检测三七粉中三七皂苷R1的含量为1.92%。参照文献制备三七提取液[8]:称取三七粉末200 g,加入70%乙醇1 L,提取2 h,共提取3次,合并醇液回收乙醇到无味,再浓缩水到300 mL。浓缩液5 000 r/min离心15 min,取上清液再浓缩至50 mL,相当于生药4 g/mL,血清瓶中密封保存,供试验用。
1.1.2 细胞株、主要仪器与试剂 中国仓鼠肺细胞(Chinese hamster lung cell,CHL),购于中国科学院上海细胞生物研究所;倒置显微镜,购于日本Olympus公司;光学显微镜,购于德国Zeiss公司;二氧化碳培养箱、低转速离心机、Varioskan Flash全波长扫描式多功能酶标仪,均购于美国Thermo公司。
环磷酰胺(cyclophosphamide)、丝裂霉素C(mitomycin C)、细胞松弛素(cyto B)、Giemsa染料均购自美国Sigma公司,MEM培养基、新生小牛血清、胰蛋白酶均购自美国Gibco公司,中性红染料购自美国Amersco公司,甲醇、乙酸等试剂为国产分析纯。
1.1.3 大鼠肝S9的诱导和制备 健康成年SD大鼠,体质量130~170 g,按500 mg/kg的浓度一次腹腔注射浓度为200 g/L的多氯联苯,5 d后解剖取肝脏称量质量,用新鲜冰冷浓度为0.15 mol/L的氯化钾溶液连续冲洗肝脏,每克肝脏加入0.1 mol/L氯化钾溶液3 ml,连同烧杯移入冰浴中,剪碎肝脏,用玻璃匀浆器制成肝匀浆,用低温高速离心机20 000 r/min离心10 min,吸出上清,分装于无菌冻存管中,鉴定活性后,置于-80℃保存备用。
1.2 方法
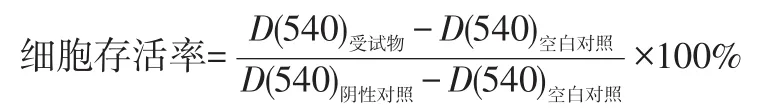
1.2.1 中性红摄取法测定三七提取液对CHL细胞的毒性 将CHL细胞复苏传代至对数增殖期,以1×105个/mL的浓度接种于96孔板中,设立空白组,阴性对照组及0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0 mg/mL共8个浓度的三七提取液组,每组设3个复孔,于37℃、CO2体积分数为5%的培养箱中培养24 h。细胞贴壁后,更换培养基,按不同的组别加入新鲜培养基及不同浓度的受试物,继续培养24 h。每孔中加入中性红,4 h后中止反应,加入中性红解析液,充分混匀,在酶标仪540 nm处读取各孔吸光度D(540)值,按照公式计算细胞存活率。
1.2.2 体外微核试验 采用体外胞质分裂阻断微核分析法进行体外微核试验[9]。取对数增殖期的细胞,调整细胞浓度为1×105个/mL接种于6孔板中,于37℃、CO2体积分数为5%的培养箱中培养24 h。吸去培养液,用磷酸盐缓冲液(PBS)洗细胞两次,加入无血清培养液及一定浓度的受试物(需要代谢活化的同时加入肝S9代谢活化酶系统)。用MEM培养基稀释三七提取液,使三七受试物的浓度分别为2.5、1.25、0.625 mg/mL,阳性对照为20μg/mL环磷酰胺(+S9)和1.0μg/mL丝裂霉素C(-S9),阴性对照为等量的MEM培养基,每组设3个平行孔,置于二氧化碳培养箱中继续培养6 h。结束后吸去含受试物的培养液,用PBS洗细胞两次,加入含10%血清的新鲜培养液和浓度为3μg/mL的细胞松弛素B后,继续培养24 h后收集细胞。将用胰酶消化后收集的细胞用0.075 mol/L氯化钾低渗液低渗,反复固定后滴冰玻片,再以10%Giemsa磷酸盐缓冲液染色,纯净水冲洗后自然风干。在光学显微镜下观察,每个浓度组均观察3张玻片,每张玻片分析1 000个结构完整、着色清晰的双核细胞,计算微核细胞率。

1.2.3 统计学分析 利用SPSS 18.0统计软件进行数据统计学分析,吸光度值比较采用单因素方差分析,微核率比较采用χ2检验,以α=0.05为检验水准。
2 结果
2.1 中性红摄取法测定细胞毒性
细胞毒性试验结果见表1。可以观察到当三七提取液浓度为2.5 mg/mL时,与阴性对照相比,吸光度值显著降低(P<0.05),且随着三七提取液浓度的增加,吸光度值逐渐降低,细胞存活率也逐渐降低,存在浓度效应关系。
2.2 体外微核试验
微核的判断如图1所示。三七提取液各浓度组对CHL细胞微核细胞率的影响见表2。在有无代谢活化系统存在的两种条件下,三七提取液各浓度组微核细胞率与阴性对照组相比差异无统计学意义(P>0.05),体外微核试验结果为阴性。
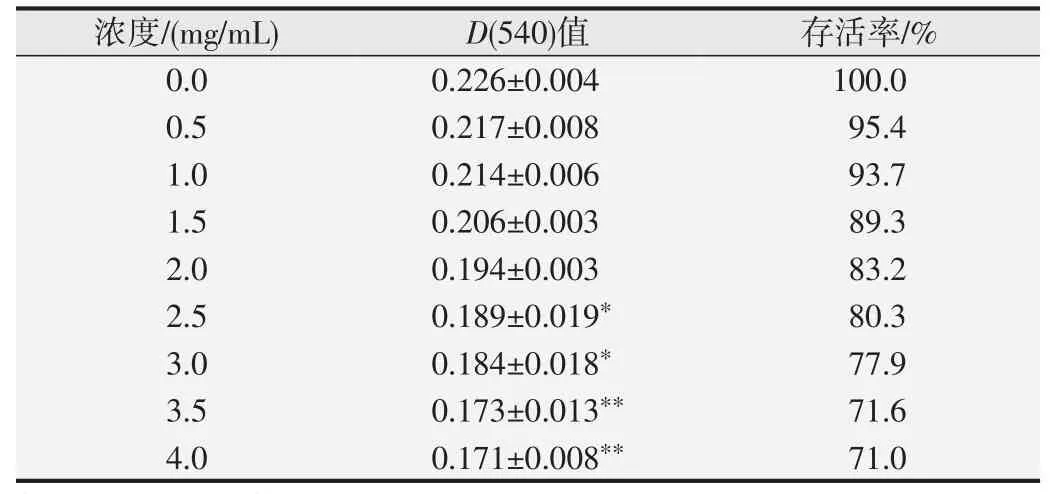
表1 中性红摄取法测定三七提取液对CHL细胞的毒性作用

图1 具有一个微核的双核细胞

表2 三七提取液的CHL细胞体外微核试验结果
3 讨论
Heddle[10]在1978年首次提出体外微核试验,由于相较于体内试验简便、快速、准确、耗费低、试验周期短、不受动物个体差异的影响、易于实现自动化而快速发展,在评价遗传毒性的试验体系中有重要位置。欧洲替代方法验证中心(European Centre for the Validation of Alternative Methods,ECVAM)对体外微核试验及染色体畸变试验的相关性进行验证,认为体外微核试验是一种重现性好,精确度高的染色体畸变试验的替代方法[11],2008年发布了体外微核试验可以替代体外染色体畸变试验用于遗传毒性检测的指导原则[12]。2010年,经济合作与发展组织(Organization for Economic Cooperation and Development,OECD)将体外微核试验列入指导原则TG487[9]。2011年,国际协调委员会(International Conference on Harmonization,ICH)将体外微核试验列入指导原则S2R(1)[13]。体外微核试验是以微核作为遗传毒性检测终点,常用的方法为细胞分裂阻滞微核分析法。通过加入细胞松弛素B使胞质分裂受阻,形成双核细胞,表明观察的细胞经过一次有丝分裂,如果受试物是染色体断裂剂或非整倍体诱发剂,就可能在双核细胞中出现微核。此方法解决了不同细胞分裂不同步的问题,使微核实验结果灵敏度、准确性更高,并有助于实现微核实验标准化流程的建立[14-15]。本实验即用细胞分裂阻滞微核分析法来检测三七提取液对CHL细胞微核细胞率的影响,评价三七提取液的遗传毒性。
三七为五加科植物三七的干燥根,是我国传统的名贵中药,也是普遍食用的药食同源物质[16],现在三七以低于临床的剂量用于保健品的开发,被添加入能量饮料、茶或功能性食品中[17]。伴随着三七越来越广泛的应用,也亟需不断完善三七的安全性评价资料。本实验中,三七提取液的体外微核试验的剂量是通过中性红摄取法测定细胞毒性试验的结果来确定的。在遗传毒性试验前先进行细胞毒性试验,确定受试物对细胞的毒性浓度。在中性红摄取法测定细胞毒性试验中,当三七提取液浓度为2.500 mg/mL时,OD值出现显著性降低,对CHL细胞表现出细胞毒性,使CHL细胞活细胞数减少。故体外微核试验以2.500 mg/mL作为受试物的高浓度,按照2倍间距递减设中、低浓度。本实验表明三七提取液在0.625、1.250、2.500 mg/mL浓度下,加与不加S9均不会引起CHL细胞微核细胞率较阴性对照组的显著增加,体外微核试验结果为阴性,未观察到三七提取液对CHL细胞有染色体损伤作用,不具有遗传毒性。本研究首次利用体外微核试验评价三七的遗传毒性。关于三七遗传毒性的既往研究表明[18],参考《食品安全性毒理学评价程序》完成的三七小鼠骨髓嗜多染红细胞微核试验、小鼠精子畸形试验和Ames试验的结果均为阴性,显示三七不具有遗传毒性。本研究结果与其一致。

