维生素E琥珀酸酯通过酸性神经磷脂酶-神经酰胺诱导胃癌细胞凋亡的机制研究
张旭光,杜瑞琥,陈彦平,赵 艳*
(1.哈尔滨市儿童医院儿童保健科,黑龙江哈尔滨 150010;2.哈尔滨医科大学公共卫生学院预防医学专业,黑龙江 哈尔滨 150081;3.哈尔滨医科大学营养与食品卫生学教研室,黑龙江 哈尔滨 150081)
胃癌是一种常见的恶性消化道肿瘤,临床上治疗胃癌的手段主要有手术与化疗,但常规化疗药物副作用大,加之肿瘤细胞常对化疗药物产生耐药,从而限制了化疗药物的临床应用[1]。维生素E琥珀酸酯(vitamin E succinate,VES)是天然维生素E的衍生物,VES对胃癌等多种肿瘤细胞均能表现出极强的杀伤作用,而对正常细胞却无任何毒副作用。本课题组前期研究结果表明VES能够通过激活酸性神经磷脂酶(acid sphingomyelinase,ASmase)作为起始因子来促进胃癌细胞发生凋亡,其下游信号通路包含了内质网应激途径,但ASMase早期活化后其下游因子神经酰胺的聚集情况还未明确[2]。此外,本课题组早期研究还发现VES能够通过死亡受体信号通路、氧化应激途径促进人胃癌细胞发生凋亡,而ASMase与上述两条信号通路之间的关系也尚未明确[3-4]。因此,本研究拟进一步探讨VES通过ASMase促进人胃癌细胞发生凋亡过程中神经酰胺的聚集变化、死亡受体信号通路及氧化应激反应在这一过程中的作用,以进一步明确VES在促进人胃癌细胞发生凋亡过程中各信号通路的上下游关系。
1 材料与方法
1.1 细胞和试剂
低分化人胃癌细胞株SGC-7901由哈尔滨医科大学营养与食品卫生学教研室保存。VES、ASMase抑制剂地昔帕明(desipramine,DES)与抗Cer抗体均购自美国Sigma公司,ASMase活性试剂盒购自美国Echelon Biosciences公司,4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)购自美国Invitrogen公司;活性氧簇(reactive oxygen species,ROS)探针购自碧云天生物技术研究所;Fas、DR5、caspase-8、caspase-9以及PARP多克隆抗体均购自美国Cell Signal公司。
1.2 实验方法
1.2.1 细胞培养与分组 人胃癌SGC-7901细胞在含有10%胎牛血清、2 mmol/L L-谷氨酰胺、100μg/mL链霉素以及100 U/mL青霉素的RPMI-1640培养基中培养,培养箱条件为温度37℃,CO2体积分数5%。待其生长状态良好后,用0.02%EDTA消化传代,细胞铺满85%瓶底面积时,弃去原培养液,更换为2%RPMI-1640培养液并加受试物处理:VES组用20 μg/mL VES处理细胞;VES+DES组用12.5μmol/L DES预处理细胞2 h,再加20μg/mL VES处理细胞;阴性对照组用2%RPMI-1640培养液处理细胞;DES组用12.5μmol/L DES提前2 h处理细胞。分别在不同时间点检测VES组和VES+DES组中ASMase和Cer的表达情况来确定两者表达高峰的出现时间和DES对两者的抑制作用。根据本课题组前期研究结果,选择VES作用后细胞发生凋亡最明显的时间点(24 h)检测4组细胞的凋亡率、死亡受体信号通路蛋白表达和氧化应激情况。
1.2.2 ASMase活性检测 收集VES组、VES+DES组0、1.5、3、6 h的细胞各1.5×106个,超声裂解后取上清液20μL(含20μg蛋白)分别置于96孔板内,每孔加入1∶40稀释的底物50μL,于37℃下震荡孵育3 h后加入50μL终止液,以酶标仪在360 nm激发光以及460 nm发射波长检测吸光度,代入到标准曲线中计算ASMase活性。
1.2.3 Cer蛋白表达检测 采用免疫荧光染色法测定VES组、VES+DES组在0、1.5、3、6、9 h细胞中的Cer蛋白表达。6孔板中细胞用冷PBS清洗2次后在室温下用4%多聚甲醛固定15 min,清洗细胞后室温下以0.1%的Triton X-100处理15 min,阻断缓冲液孵育1 h,用4μg/mL的抗Cer抗体孵育细胞过夜后再用二抗孵育1 h,用激光共聚焦仪获取图像。
1.2.4 DAPI染色检测凋亡率 收集培养基中的死亡细胞和贴壁生长的细胞至Eppendorf管中,洗细胞2次,每管加入2μg/mL的DAPI 50μL,吹打混匀后在37℃、避光条件下孵育30 min,洗细胞2次后取细胞悬液滴于载玻片上,在300~500 nm紫外波长下以倒置荧光显微镜观察凋亡小体(目镜×物镜=400),每组均随机选取不低于100个细胞的视野计数阳性细胞,计算百分比并拍照。
1.2.5 死亡受体相关蛋白的表达检测 以Western blot法检测各组细胞中Fas、DR5、caspase-8、caspase-9以及PARP的蛋白表达情况。收集各组处理24 h的细胞,裂解并提取蛋白,等量上样,SDS-PAGE电泳分离后常规转膜、封闭,与一抗杂交过夜,再用碱性磷酸酶标记的二抗于37℃条件下孵育1 h,用数字成像仪对图像进行拍照并分析。
1.2.6 检测氧化应激反应 将各组细胞收集后悬浮于终浓度为10μmol/L的2',7'-二氯荧光黄双乙酸盐中,使细胞浓度为5×106/mL,37℃下避光孵育30 min,每隔3~5 min颠倒混匀一次,之后用培养液洗细胞2次备用。以流式细胞仪检测各组细胞的氧化应激反应发生率(激发波长488 nm,发射波长525 nm)。
1.3 统计学分析
采用SPSS 19.0统计学软件对实验数据进行统计分析,统计结果以xˉ±s表示,对照组、DES组、DES+VES组及VES组细胞的凋亡率,DR5、Fas、c-caspase-8、c-caspase-9和c-PARP蛋白表达,氧化应激反应发生率间差异的分析均采用单因素方差分析,以α=0.05为检验水准。
2 结果
2.1 各组细胞中ASMase活性
按试剂盒方法制作标准曲线为Y=192.08 X+2 183.17(r=0.998),提示ASMase活性与相对荧光单位间的相关性良好。VES处理细胞0、1.5、3、6 h后细胞中ASMase比活力分别为476.35、658.60、923.85和717.90 U/mg,提示VES处理后胃癌细胞中的ASMase活性随时间逐渐增加,在3 h达到高峰,随后逐渐降低;DES+VES组细胞中的ASMase活性在上述时间点的比活力分别为87.75、93.80、98.55和98.70 U/mg,提示DES抑制了SGC-7901细胞中ASMase的基础活性及VES的促ASMase表达作用,结果见图1。
2.2 各组细胞中Cer蛋白的表达

图1 酶联免疫吸附实验检测SGC-7901细胞的ASMase活性
采用免疫荧光法检测VES处理0、1.5、3、6、9 h后细胞中的Cer蛋白表达情况,结果发现Cer蛋白在Ves处理1.5 h开始升高并聚集于细胞膜上,在6 h时的荧光强度最高,随后开始降低;以DES抑制ASMase活性后,再以VES处理细胞,结果发现细胞中Cer在0、1.5、3、6、9 h的表达均受到抑制,提示DES能够通过抑制ASMase活性来抑制Cer的表达,见图2。
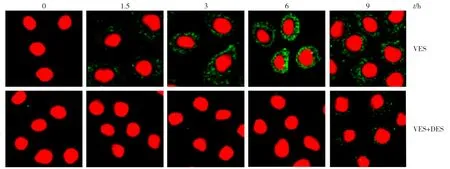
图2 免疫荧光法检测SGC-7901细胞Cer蛋白的表达情况
2.3 各组细胞的凋亡率
VES处理24 h后,对照组细胞镜下细胞核均完整,染色质均匀,无凋亡小体出现;DES组细胞镜下细胞核及染色质情况与对照组基本一致;VES组细胞镜下有大量的细胞核发生碎裂,染色质固缩,出现典型的凋亡小体;VES+DES组细胞与VES组相比,核质和染色质相对均匀完整,凋亡小体数量明显减少,提示抑制ASMase后,VES促进胃癌细胞发生凋亡的作用被降低,统计3次平行实验结果,发现对照组与DES组的凋亡率无显著差异[分别为(2.00±1.00)%和(2.67±0.57)%,P>0.05],DES+VES组凋亡率[(20.00±2.00)%]高于对照组和DES组(P均<0.01),低于VES组[(41.00±1.00)%,P<0.01],见图3。
2.4 ASMase对死亡受体信号通路的影响
采用Western blot法检测各组细胞中Fas、DR5、caspase-8、caspase-9以及PARP蛋白的表达。结果发现对照组及DES处理组细胞中的上述因子表达量差异均无统计学意义(P均>0.05),提示DES本身不会促进上述因子的表达;VES+DES组细胞中上述因子的表达水平较单独VES处理组降低(P均<0.01),提示抑制ASMase活性后,VES促进死亡受体信号通路表达的作用也受到了抑制,见图4。
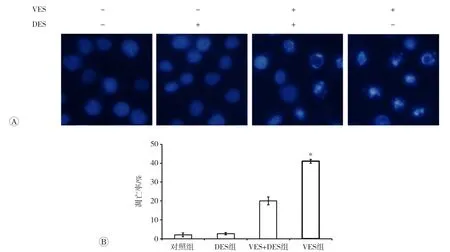
图3 DAPI染色检测SGC-7901细胞的凋亡率
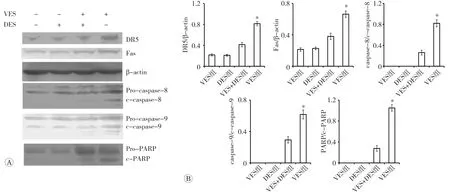
图4 Western blot法检测细胞中DR5、Fas、caspase-8、caspase-9和PARP的蛋白表达水平
2.5 ASMase对氧化应激反应的影响
药物作用24 h后,以活性氧探针处理细胞,采用流式细胞术检测细胞发生氧化应激的比例,检测结果见图5。表明对照组发生氧化应激的细胞比例为(0.12±0.06)%;DES组细胞发生氧化应激的比例与对照组基本一致(P>0.05),说明DES不引起细胞发生氧化应激反应;VES组细胞发生氧化应激反应的比例[(91.22±3.88)%]明显高于对照组(P<0.01),而VES+DES组细胞发生氧化应激反应的比例[(64.04±2.58)%]较VES组明显降低(P<0.01),提示ASMase参与了VES诱导胃癌细胞发生氧化应激反应的过程。
3 讨论

图5 流式细胞术检测SGC-7901细胞中发生氧化应激反应的比例
目前在胃癌的常规治疗手段中化疗的毒副作用较大,在杀伤肿瘤细胞的同时亦杀伤正常的组织和细胞。VES具有极强的抑癌活性,能够选择性抑制多种属来源的肿瘤细胞增殖并诱导细胞发生凋亡,但机制还未完全明确。本研究探讨了ASMase在VES促进人胃癌SGC-7901细胞发生凋亡过程中Cer、氧化应激反应和死亡受体信号通路的表达,结合前期研究结果[2],发现:①VES处理早期即可促进细胞中ASMase活性升高;②VES能够促进Cer表达并聚集在细胞膜上;③抑制ASMase部分阻断了VES促进细胞发生凋亡的作用;抑制了Cer、Fas、DR5、裂解的caspase-8、caspase-9以及PARP的表达;抑制了细胞内发生的内质网应激以及氧化应激反应,提示VES可能是通过ASMase来促进Cer的表达做为上游调节因子,再分别通过死亡受体信号通路、内质网应激和氧化应激反应3条通路来共同促进胃癌SGC-7901细胞发生凋亡的。
ASMase被激活后会迅速从细胞内囊泡转移到质膜的外叶[5],进而水解膜鞘磷脂生成Cer,后者在细胞膜中的积累导致了质膜的重建和富含神经酰胺的平台的形成,称为“脂质筏”[6],并促进Fas和DR5的聚集并使它们与其配体相结合,导致死亡受体依赖性凋亡的发生。本研究结果首次验证了VES能够激活ASMase/Cer做为上游调节因子,促进下游的Fas和DR5表达,再使caspase-8裂解为c-caspase-8,通过线粒体途径激活caspase-9及其下游因子,使细胞中的DNA修复酶PARP被剪切,最终诱导胃癌SGC-7901细胞发生凋亡,与Li等人[7]发现α-生育酚醚链乙酸在诱导乳腺癌细胞发生凋亡和Palau等人[8]报道的γ-生育三烯醇在诱导胰腺癌细胞发生凋亡时的机制相同。因此,我们认为ASMase/Cer-死亡受体信号途径可能是具有抗癌活性的维生素E衍生物诱导肿瘤细胞发生凋亡的共同机制。
在正常情况下细胞内的ROS处于正常水平,并不会对细胞造成损伤,当细胞受到不利的外来刺激时会使ROS在细胞内蓄积从而发生氧化应激反应[9]。本研究的结果表明VES能够诱导SGC-7901细胞发生氧化应激反应来促进细胞发生凋亡,与本课题组之前的结果相一致[3]。但以DES抑制ASMase活性后,VES诱导SGC-7901细胞发生凋亡和活性氧蓄积的能力仅被部分阻断,说明ASMase/Cer可能仅是VES诱导胃癌细胞发生氧化应激反应的机制之一。目前ASMase与ROS之间的上下游关系还存在争论,也有研究表明细胞中ROS能够调节ASMase进而促进细胞发生凋亡,提示氧化应激反应可能是ASMase的上游信号通路[10],因此我们推测在VES诱导SGC-7901细胞发生凋亡的过程中ASMase与氧化应激反应可能存在交互作用。此外,本课题组前期研究表明VES在促进胃癌细胞发生凋亡过程中氧化应激反应与内质网应激反应也存在交互作用,因此,推测ASMase、氧化应激反应和内质网应激三者之间均存在交互作用,有待于下一步工作来明确上述推论。
综上所述,本研究结果发现ASMase/Cer可能是VES通过死亡受体信号通路及氧化应激反应促进胃癌SGC-7901细胞发生凋亡过程中的上游因子,其下游途径包括死亡受体信号通路以及氧化应激反应,但抑制ASMase活性后,VES的促凋亡和活性氧蓄积的作用并未被完全阻断,推测ASMase与ROS之间存在交互作用,有待于进一步研究。

