miR-95与胃癌细胞洛铂敏感性的关系及作用机制研究
温 转,檀碧波,李 勇,*,赵 群,范立侨,王 冬,尔丽绵
(1.河北医科大学第四医院质量控制办公室,河北 石家庄 050011;2.河北医科大学第四医院外三科,河北 石家庄 050011;3.河北医科大学第四医院内镜室,河北 石家庄 050011)
胃癌在我国的发病率与死亡率高居第2位,仅次于肺癌,并且进展期胃癌占大多数[1]。化疗在我国胃癌的综合治疗中占有重要地位,但多药耐药性(multidrug resistance)常影响化疗效果[2-3]。microRNA(miR)通过调控靶基因转录后的水平,参与肿瘤的发生、发展与耐药[4-6]。有报道,miR-95为microRNA家族中的一员,参与乳腺癌、前列腺癌的抗辐射性及肺癌对放化疗的耐药[5,7]。但关于miR-95在胃癌中的表达及其与胃癌细胞耐药性的关系尚不明确。本研究应用qPCR法检测miR-95在胃癌组织中的表达,并应用miR-95抑制物(anti-miR-95)和miR-95模拟物(miR-95 mimics)分别转染人胃癌细胞株SGC7901,检测转染前后细胞经洛铂(lobaplatin,LBP)处理后细胞活性的变化,探讨miR-95与胃癌细胞对洛铂敏感性的关系及作用机制。
1 材料与方法
1.1 组织标本
选取2017年1月—2017年12月在河北医科大学第四医院外三科手术切除的胃腺癌组织标本,共30例,术前均未接受放、化疗,未同时合并其他肿瘤。患者男21例,女9例。年龄45~70岁,平均年龄(60.7±15.8)岁,中位年龄62岁。术中分别取新鲜肿瘤组织和距肿瘤边缘超过3 cm的癌旁正常胃黏膜组织(手术后病理证实无癌细胞存在)各2份,1份于术中离体后立即放入液氮速冻,后转入-80℃冰箱冻存备用;另1份在2 h内行原代细胞培养。所有患者均签署知情同意书,本实验获得河北医科大学第四医院伦理委员会批准。
1.2 细胞株及试剂
人胃癌细胞株SGC7901购置于中国科学院上海细胞库。TRIzol试剂、LipofectamineTM2000转染试剂购自美国Invitrogen公司。反转录试剂盒和荧光定量RT-PCR试剂为美国Promega公司产品。Anti-miR95、miR-95 mimics购自中国百奥迈科生物技术有限公司。miR-95荧光定量PCR检测试剂盒购自美国Signosis公司。MDR1、GST-π、LRP、Survivin及β-actin抗体购自美国Sigma公司,xIAP、Bad抗体购自英国Abcam公司。CCK-8细胞增殖-毒性检测试剂盒购自同仁化学研究所。洛铂为海南长安医药公司产品(每支50 mg,批准文号H20050308)。
1.3 胃癌组织单细胞悬液的制备和细胞培养
取术中切除的胃癌新鲜组织1.0 cm×0.5 cm×0.5 cm,在2 h内经充分研磨,用200目细胞筛过滤制成单细胞悬液。调整细胞浓度为5×105个/mL,接种至细胞培养皿,置于37℃、CO2体积分数为5%的培养箱中孵育。每3 d用0.25%胰蛋白酶消化细胞并传代,每1~2 d对培养基进行换液,取对数生长期的细胞用于实验。
1.4 基因转染及细胞分组
实验分为miR-95 mimic或Anti-miR-95转染组、阴性对照组(转染无关序列)及空白对照组(仅转染试剂Lipofectamine2000)。取对数生长期(传代分瓶后48 h)的SGC7901细胞,铺至6孔细胞培养板中培养,待细胞融铺满70%~80%瓶底面积时进行转染。首先,经胰酶消化细胞制备细胞悬液,然后按照转染试剂说明书制备转染液:在EP管中制备A液(不含血清的培养基稀释miRNA)和B液(不含血清培养基稀释脂质体),分别将A液与B液轻弹混匀,静置5 min,吸取B液加入至A液中,轻弹混匀,室温中置10~15 min后,缓缓加入培养液中,轻轻摇匀,37℃孵育48 h,在荧光显微镜下观察转染效率(转染的miRNA为化学合成核酸序列,无表达载体,同时标记有绿色荧光,可于荧光显微镜下直接观察转染效率)。
1.5 实时荧光定量PCR法检测胃癌组织和细胞中m iR-95的表达水平及基因转染后目的基因转录水平
用Trizol提取组织及转染后各组细胞总RNA。按照逆转录试剂盒说明书,取2 mg总RNA建立20 mL逆转录反应体系,37℃反应30 min,将总RNA进行逆转录获取cDNA。使用相应靶基因引物及Go Taq®qPCR Master Mix建立20 mL实时荧光定量PCR(quantitative reverse transcription polymerase chain reaction,qPCR)反应体系,进行荧光定量PCR检测。PCR反应程序如下:95℃、5 min,然后40个循环反应:94℃、30 s,58℃、30 s,72℃、30 s,于每个循环的第3个步骤(即72℃、30 s)末期收集荧光信号。U6作为micro RNA的内参,GAPDH作为mRNA的内参。检测结果采用2-ΔΔCT方法计算,得到各mRNA表达的相对定量值。miR-95的检测采用Gene Copoia公司的All-in-One miRNA qRT-PCR Detection Kit微小RNA检测试剂盒。基因的引物序列见表1。
1.6 CCK-8法检测胃癌组织原代细胞及基因转染后SGC7901细胞对洛铂的敏感性
取方法1.3制备的胃癌组织细胞和胃癌细胞系以3×104个/mL的浓度接种于96孔板中,培养24 h,加入浓度为8μg/mL的洛铂后继续培养24 h,各组细胞均设置6个复孔。终止培养后,弃去培养液,加入100 μL含CCK-8的培养液(VCCK-8∶V培养液=1∶9),置于培养箱中继续培养2 h。用酶标仪于490 nm处测吸光度D(490)值[D(490)值越小则细胞存活率越低,对化疗药物敏感性越高]。

表1 各基因引物序列
1.7 Western blot法检测目的蛋白的表达
分别提取各细胞总蛋白,并检测蛋白浓度。取40μg蛋白样品经SDS-PAGE分离,转膜,封闭2 h后,加入抗 MDR1、GST-π、LRP、Survivin、xIAP、Bad、β-actin一抗,4℃孵育过夜,TBST洗膜3次,加入二抗(1∶10 000稀释)室温孵育1 h,TBST洗膜3次,经Odyssey红外成像系统分析,检测各条带的光密度积分值(integral value of optical density,IOD),以目的蛋白与内参照蛋白IOD值的比值代表蛋白表达水平。实验重复3次。
1.8 统计学处理
所有数据用SPSS 22.0统计软件对数据进行统计分析,两样本均数比较时,使用t检验;对符合正态分布、方差齐的数据比较,采用近似t检验;对方差不齐数据处理,用Wilcoxon检验;对非正态分布数据两样本均数比较、多样本均数比较时,用方差分析;对符合正态分布、方差齐的数据进行比较、多个样本均数间的两两比较采用最小显著差异法(least significant difference,LSD);非正态分布或(和)方差不齐的数据采用Kruskal-Wallis H检验。以α=0.05作为检验水准。
2 结果
2.1 miR-95在胃癌组织中的表达
胃癌组织miR-95的相对表达水平(0.106±0.023)显著高于癌旁组织(0.046±0.025)(P<0.05)。以癌组织miR-95相对表达水平的均值为界将胃癌组织分为miR-95高表达组17例,miR-95低表达组13例。
2.2 胃癌组织中m iR-95表达水平与洛铂敏感性的关系
应用CCK-8法分别检测洛铂对miR-95高、低表达的胃癌细胞(组织来源)的抑制率。结果显示,洛铂对miR-95表达水平高的胃癌细胞抑制率为(33.74±6.10)%,低于miR-95低表达的细胞(47.41±11.30)%(P<0.05)。
2.3 anti-miR-95、miR-95 mim ics转染对SGC7901细胞m iR-95表达的影响
在荧光显微镜下观察,转染效率接近100%。qPCR实验的结果见表2。anti-miR-95转染SGC7901细胞后,miR-95mRNA相对表达水平显著降低(P<0.01);miR-95 mimics转染SGC7901细胞后,miR-95 mRNA表达水平显著升高(P<0.01)。
表2 anti-miR-95、miR-95 mimics转染后SGC7901细胞miR-95 mRNA表达水平的比较(n=3,)
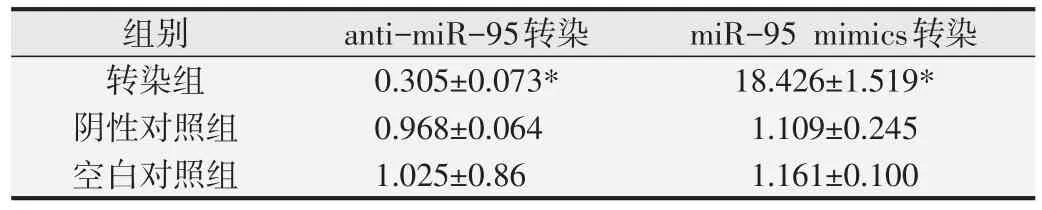
表2 anti-miR-95、miR-95 mimics转染后SGC7901细胞miR-95 mRNA表达水平的比较(n=3,)
与阴性对照组及空白组比较,*P<0.05.
组别转染组阴性对照组空白对照组anti-miR-95转染0.305±0.073*0.968±0.064 1.025±0.86 miR-95 mimics转染18.426±1.519*1.109±0.245 1.161±0.100
2.4 anti-miR-95、miR-95 mimics转染对SGC7901细胞对洛铂敏感性的影响
CCK-8实验的结果见表3。anti-miR-95转染后,SGC7901细胞对洛铂的敏感性明显增加(P<0.01);miR-95 mimics转染后,SGC7901细胞对洛铂的敏感性明显下降(P<0.01)。
表3 anti-miR-95、miR-95 mimics转染后SGC7901细胞SGC7901细胞对洛铂敏感性的比较(n=3,)

表3 anti-miR-95、miR-95 mimics转染后SGC7901细胞SGC7901细胞对洛铂敏感性的比较(n=3,)
与阴性对照组及空白组比较,*P<0.05.
组别转染组阴性对照组空白对照组anti-miR-95 0.526±0.141*1.120±0.106 1.180±0.119 miR-95 mimics 3.700±0.822*1.312±0.276 1.391±0.257
2.5 miR-95对 SGC7901细胞 MDR1、GST-π、LRP、Survivin、x IAP、Bad表达的影响
qPCR和Western blot实验的结果见图1和表4、5。anti-miR-95转染后,SGC7901细胞耐药相关基因MDR1、Survivin、xIAP mRNA和蛋白表达明显降低,而Bad mRNA和蛋白表达明显增高(P<0.05);miR-95 mimics转染后,SGC7901细胞耐药相关基因MDR1、Survivin、xIAP mRNA和蛋白表达明显增高,而Bad mRNA和蛋白表达明显降低(P<0.05);GST-π、LRP mRNA和蛋白表达在两者转染后均未见明显改变(P>0.05)。

图1 Western blot检测结果
表4 anti-miR-95转染后SGC7901细胞MDR1、Survivin、x IAP、Bad、GST-π、LRP m RNA和蛋白水平的比较(n=3,)

表4 anti-miR-95转染后SGC7901细胞MDR1、Survivin、x IAP、Bad、GST-π、LRP m RNA和蛋白水平的比较(n=3,)
与阴性对照组及空白对组比较,*P<0.05.
组别转染组阴性对照组空白对照组MDR1 mRNA 0.478±0.078*1.195±0.167 1.207±0.086蛋白0.366±0.075*1.181±0.131 0.168±0.105 Survivin mRNA 0.613±0.039*1.471±0.115 1.494±0.076蛋白0.483±0.057*0.951±0.102 0.982±0.088 xIAP mRNA 0.559±0.109*1.344±0.061 1.327±0.139蛋白0.406±0.076*1.049±0.125 1.034±0.041组别转染组阴性对照组空白对照组Bad mRNA 1.903±0.071*0.754±0.056 0.786±0.090蛋白0.972±0.046*0.478±0.090 0.501±0.060 GST-π mRNA 0.857±0.140 0.808±0.061 0.791±0.104蛋白0.844±0.059 0.825±0.066 0.806±0.502 LRP mRNA 1.125±0.050 1.086±0.085 1.172±0.067蛋白1.369±0.258 1.544±0.240 1.595±0.222
表5 miR-95 mimics转染后SGC7901细胞MDR1、Survivin、xIAP、Bad、GST-π、LRP mRNA和蛋白水平的比较(n=3,)

表5 miR-95 mimics转染后SGC7901细胞MDR1、Survivin、xIAP、Bad、GST-π、LRP mRNA和蛋白水平的比较(n=3,)
与阴性对照组及空白对组比较,*P<0.05.
组别转染组阴性对照组空白对照组Bad mRNA 0.366±0.075*0.656±0.082 0.697±0.053蛋白0.457±0.070*1.087±0.096 0.965±0.050 GST-π mRNA 1.861±0.119 1.755±0.110 1.797±0.123蛋白0.870±0.045 0.887±0.076 0.884±0.026 LRP mRNA 1.760±0.077 1.809±0.142 1.832±0.104蛋白0.937±0.039 0.949±0.072 0.935±0.056组别转染组阴性对照组空白对照组MDR1 mRNA 1.793±0.145*0.597±0.083 0.604±0.043蛋白1.064±0.170*0.561±0.101 0.585±0.083 Survivin mRNA 1.565±0.117*0.727±0.082 0.796±0.055蛋白0.917±0.114*0.601±0.090 0.627±0.083 xIAP mRNA 2.077±0.101*1.111±0.060 1.060±0.133蛋白1.193±0.114*0.571±0.036 0.539±0.053
3 讨论
探讨胃癌MDR机制及开发逆转胃癌MDR药物一直是胃癌治疗领域的热点与难点。研究表明,miRNA主要通过调节靶基因转录后水平参与肿瘤的发生、发展与耐药[7]。有报道表明,miR-95在非小细胞肺癌组织及细胞系中高表达,可降低非小细胞肺癌的化疗敏感性、增加其放疗耐受性[5]。洛铂是第三代铂类化疗药物,在胃癌治疗中取得了较好效果[8]。但由于胃癌细胞对化疗药物多存在明显的原发性耐药现象[9],常导致治疗效果不佳,甚至失败。因此,探讨胃癌组织细胞对洛铂的耐药机制有重要意义。
本研究发现,miR-95在胃癌组织中高表达,miR-95表达水平高的胃癌组织细胞对洛铂敏感性低于低表达者。抑制人胃癌细胞SGC7901 miR-95的表达后再给予洛铂干预,细胞的增殖活性明显增高;相反,提高miR-95表达后再给予洛铂干预,细胞的增殖活性明显降低。本结果提示miR-95表达增高可能是导致胃癌对洛铂耐药的重要原因,抑制miR-95表达有可能减轻胃癌细胞对洛铂的耐药性。
为探讨miR-95参与胃癌组织细胞对洛铂耐药的机制,我们检测了耐药相关基因MDR1、GST-π、LRP、Survivin、xIAP、Bad在miR-95受到调控后的表达变化。MDR1是经典MDR基因,其产物为P-糖蛋白(P-gp)。P-gp可将细胞内的化疗药泵出细胞外[10-11]。GST-π通过将亲脂性药物与谷胱甘肽结合,增加其水溶性,将药物排出细胞[12]。LRP能阻止药物进入细胞核或将细胞核内的药物泵出核外,再经胞吐途径排出细胞外[13-14]。肿瘤细胞的凋亡途径异常是造成MDR的另一重要机制,Survivin、xIAP、Bad均为其中重要成员,这些凋亡抑制基因的激活和凋亡促进基因的抑制使细胞耐药性增强[15-16]。本研究发现,转染anti-miR-95后,SGC7901细胞耐药相关基因MDR1、Survivin、xIAP表达明显降低,Bad表达明显增高;转染miR-95 mimics后,SGC7901细胞耐药相关基因MDR1、Survivin、xIAP表达明显增高,而Bad表达明显降低。同时,研究证实调控miR-95表达可影响细胞的增殖活性。有研究显示,miR-95能够通过促进DKK3进而激活Wnt/β-catenin信号通路导致前列腺癌细胞增殖能力增强[17];还有研究发现miR-95可通过调节增殖相关蛋白p21而促进肝癌细胞的增殖[18]。本研究虽然未对miR-95影响胃癌细胞增殖的机制进行深入分析,但这些结果为后续的研究提供了方向。这些结果提示,上述耐药相关基因可能受到miR-95的调控,这可能是miR-95参与胃癌洛铂耐药的机制,但miR-95对这些基因调控的分子机制还有待深入研究。
综上所述,胃癌组织中miR-95表达水平增高,且其表达水平与胃癌细胞对洛铂的药物敏感性有关。miR-95可能通过调节一些耐药相关基因如MDR1、Survivin、xIAP、Bad的表达而参与胃癌对洛铂的耐药形成。

