稳定剂对调配型酸性乳饮料的稳定性作用
刘江,雷激,张俊,苏菲烟
(西华大学 食品与生物工程学院,四川 成都,610039)
调配型酸性乳饮料是一种以鲜奶、奶粉为主要原料,辅以其他原料如甜味剂、稳定剂、香精等调配获得的,是当前市售蛋白质饮料中最流行的品种之一[1]。乳制品生产过程受体系酸度、添加剂等因素的影响,产品质量不稳定,易出现分层、沉淀等现象,这些是新型乳制品开发的难点,制约着酸性乳饮料产品的生产和开发[2]。牛乳酪蛋白的等电点为4.6,高于酸性乳饮料(pH 3.8~4.2),酪蛋白凝聚沉淀会使酸性乳饮料稳定性受到破坏。故要提高产品的稳定性,关键是解决牛乳酪蛋白在酸性条件下的稳定性,这需增加酪蛋白之间的静电相互作用,同时改善加剧酪蛋白聚集沉淀的不利因素的影响,可通过添加稳定剂来实现。
羧甲基纤维素钠(carboxymethyl cellulose,CMC)、藻酸丙二醇酯(propylene glycol alginate,PGA)和果胶被认为是能够有效稳定酸性乳饮料的亲水胶体[3]。目前酸性乳饮料稳定性的研究主要是测定酸性乳饮料的黏度、沉淀量和乳析率等来表征,这些在测量过程中会破坏酸性乳饮料的结构,对分析其稳定性具有一定的局限性。基于此,本试验重点研究不同稳定剂最佳添加量下产品的粒径分布、Zeta电位、水分子的流动性及流变性等指标的变化,从微观角度研究不同稳定剂对酸性乳饮料的稳定作用,分析产品中蛋白质稳定性问题,对了解不同稳定剂稳定酸性乳饮料的机制和拓展其应用领域有重要意义。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
伊利脱脂奶粉,双城雀巢有限公司;柠檬果胶粉,微波辅助法提取的柠檬果胶(自制,详见1.2.2);金装白砂糖,眉山市新纪元食品有限公司;食品级CMC,南京通盈生物科技有限公司;食品级PGA,郑州明瑞化工有限公司;食品级蔗糖酯,郑州富太化工产品有限公司;柠檬酸、乙二胺四乙酸(EDTA)、乙醇(分析纯),成都市科龙化工试剂厂。
1.1.2 仪器与设备
TB-214电子天平,北京赛多利斯仪器系统有限公司;PHS-320 pH计,上海霄盛有限公司;TD-5M低速离心机,四川蜀科仪器有限公司;HH-S恒温水浴锅,金坛市医疗仪器厂;78-1磁力搅拌机,金坛市富华仪器有限公司;FSH-2A均质机,河北慧采科技有限公司;UV-2450紫外分光光度计,上海元析仪器有限公司;FY-10型微波萃取仪,上海越众仪器设备有限公司;低频核磁共振分析仪(LF-NMR),苏州纽迈分析仪器股份有限公司;MCR xx2流变仪,奥地利安东帕(中国)有限公司;Malvern Zetasizer Nano ZS激光粒度仪,英国Malvern仪器有限公司。
1.2 实验方法
1.2.1 工艺流程[5]

1.2.2 操作要点
(1)微波辅助提取柠檬果胶(microwave assisted extraction lemon pectin,MAELP):参考文献[4]制备柠檬干渣,0.05 mol/L EDTA为提取溶剂,干渣与提取液的料液比1∶22(g∶mL),用0.5 mol/L柠檬酸调节pH值为2.3,在320 W功率下提取8 min;提取液离心过滤后经60 ℃旋转蒸发浓缩至原体积1/2,用2倍体积的90%乙醇沉淀45 min,并用无水乙醇洗涤4次,最后于60 ℃真空干燥粉碎得到果胶成品;
(2)复原乳配方:将6.0 g脱脂奶粉溶解在30 mL,40 ℃的蒸馏水中,用磁力搅拌器搅拌溶解,然后于90 ℃杀菌10 min;
(3)稳定剂胶体溶液的制备:将稳定剂与6%蔗糖、0.05%柠檬酸钠、0.1%蔗糖酯充分混合均匀后,将混合物缓慢加入75 ℃蒸馏水中,匀速搅拌并冷却至20 ℃,保证胶体充分溶解,制成胶体溶液(各成分添加的百分比为配制100 mL饮料的质量比);
(4)原料混合:将稳定剂胶体溶液与复原乳混合均匀,不加稳定剂的作为空白对照;
(5)调酸:采用滴加法,用10%柠檬酸溶液进行调酸,并使用搅拌器对溶液不断地进行高速搅拌,使pH值最终为4.0。必须保证各体系溶液温度控制在30 ℃以下,目的是为降低加酸过程中蛋白质的变性程度,同时应控制速度,保证充分分散;
(6)均质:样品加热到60 ℃后在20 MPa下分3阶段均质,前2次每次均质2 min,间歇1 min,最后1次均质1 min;
(7)杀菌:均质后的产品于90 ℃杀菌10 min,将杀菌后的产品装入经紫外消毒的塑料瓶中,密封,该操作在无菌操作台上完成。经检验,产品达到商业无菌要求,可在常温下长期保存。
1.2.3 酸性乳饮料试验方法
采用1.2.2所示工艺制备酸性乳饮料,选取提取的柠檬果胶、CMC和PGA添加量分别为质量分数0、0.10%、0.20%、0.30%、0.40%、0.50%,在室温储藏1 d后检测酸性乳饮料沉淀率,确定稳定剂的最佳添加量,在最佳添加量下测定不同稳定剂对产品感官、粒径分布、Zeta电位、水分子流动性以及流变性等的影响。
1.3 实验指标测定方法
1.3.1 酸性乳饮料沉淀率[6]
称量离心管的质量为W1,加入30 g酸性乳饮料样品(精确度为0.001 g),放入离心机中,3 800 r/min离心20 min,去除上清液并倒立5 min,称其质量为W2。每个样品进行3次平行测定,离心沉淀率取其平均值,计算如公式(1)所示:
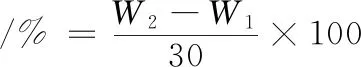
(1)
式中:W1,离心管质量,g;W2,倒立后离心管和样品质量。
1.3.2 酸性乳饮料感官评定
感官评分参照GB/T 21732—2008《含乳饮料》国家标准感官质量评鉴细则,评分标准见表1。由20名专业人士组成鉴评小组,对酸性乳饮料进行感官(包括色泽、滋味气味、组织状态)评价,总分100分,结果取其平均值[7]。

表1 酸性乳饮料感官评分标准Table 1 Sensory evaluation of acidic milk drinks
1.3.3 酸性乳饮料粒径测定[8]
将酸性乳饮料水平放置在室温中,测定储藏0、1、5、10、15 d后的产品粒径(volume mean diameter,D4,3)的变化,每次从底部吸取2 mL于激光粒度仪比色皿中,每个样品自动重复测定3次。
1.3.4 酸性乳饮料Zeta电位[9]
基于经典动态光散射理论,用激光粒度仪Zeta potential模式测定在室温中存放0、1、5、10、15 d后产品的电位,平衡时间为120 s,每个样品进行3次测定。
1.3.5 酸性乳饮料流变性质测试
采用安东帕RheoCompass流变仪测定酸性乳饮料流变性,包括稳态剪切和振荡频率扫描测试,每次测量之前,使样品平衡2 min。所有试验至少进行3次重复。
1.3.5.1 酸性乳饮料稳态剪切测试[10]
测定表观黏度随剪切速率的变化。选用同轴圆筒,酸性乳饮料样品刚好淹没圆筒内划线,转子下降后样品刚好覆盖其表面。剪切速率0.001~10 s-1,温度25 ℃,测定储藏0、5、10、15 d后含不同稳定剂的酸性乳饮料的黏度随剪切速率的变化。
1.3.5.2 酸性乳饮料动态振荡测试[11]
振幅扫描:固定频率1 Hz,温度25 ℃,在0.01%~100%进行应变扫描以确定线性黏弹区(linear viscoelastic region,LVR)。
由预实验结果可知,为保证测定过程中所有果胶样品均在线性黏弹区内,选择1%作为应变扫描值。在温度25 ℃,角频率0.1~100 rad/s时进行频率扫描测试。此试验选择直径为40 mm的P50平板。记录储藏0、1、5、10、15 d后含不同稳定剂的酸性乳饮料储能模量G′和损耗模量G″的变化。
1.3.6 酸性乳饮料水分子流动性[12-13]
利用核磁共振分析仪测量酸性乳饮料存放1、7、14 d后的横向弛豫时间T2。
测试条件:将装有25 mL标准样的玻璃试管(口径2 cm)置于磁体线圈中(温度32 ℃),选择FID序列,设置参数值。接收机带宽SW=250 KHz,采样起点RFD=0.080 ms,重复采用时间间隔TW=5 000.000 ms,90°和180°脉冲脉宽分别为P90=10.00 μs、P180=38.00 μs,量取25 mL测试样品放入探头内,使用CPMG序列测试,重复扫描次数NS=16,采样点数TD=750 100,回波个数NECH=6 000,利用纽迈多指数反演软件进行反演拟合,每个样品测定3次。
1.3.7 酸性乳饮料R值的测定
分别测定贮藏前后饮料顶层乳浊液的透光率。取2 mL乳浊液于100 mL容量瓶中,加去离子水定容,在750 nm下测定其贮藏前后的透光率。用R值来衡量体系的稳定性,R值按公式(2)计算[14]:
(2)
式中:R,饮料透光率变化;T1,贮藏0 d饮料顶层体系的透光率;T2,贮藏不同天数的饮料顶层体系的透光率。
1.4 统计分析
数据以均值±标准差表示,采用SPSS 21.0 对均值进行单因素ANOVA分析和最小显著差数法(LSD)多重比较,P<0.05差异有统计学意义。采用Origin 8.5进行统计图形的绘制。
2 结果与分析
2.1 不同稳定剂使用量对酸性乳饮料沉淀率的影响
不同稳定剂在添加量为0~0.5%对酸性乳饮料沉淀率的影响如图1所示。稳定剂种类及其用量对体系的稳定性影响显著(P<0.05)。当酸性乳饮料中不含稳定剂时,沉淀率高,体系失稳,酪蛋白发生聚集。随着稳定剂添加量的不断增加,酸性乳饮料沉淀率先迅速下降后趋于平稳,沉淀率出现平稳趋势时CMC、PGA及微波提取的果胶的添加量分别为0.4%、0.3%和0.3%,后期将以此添加量进行其他指标的考察。
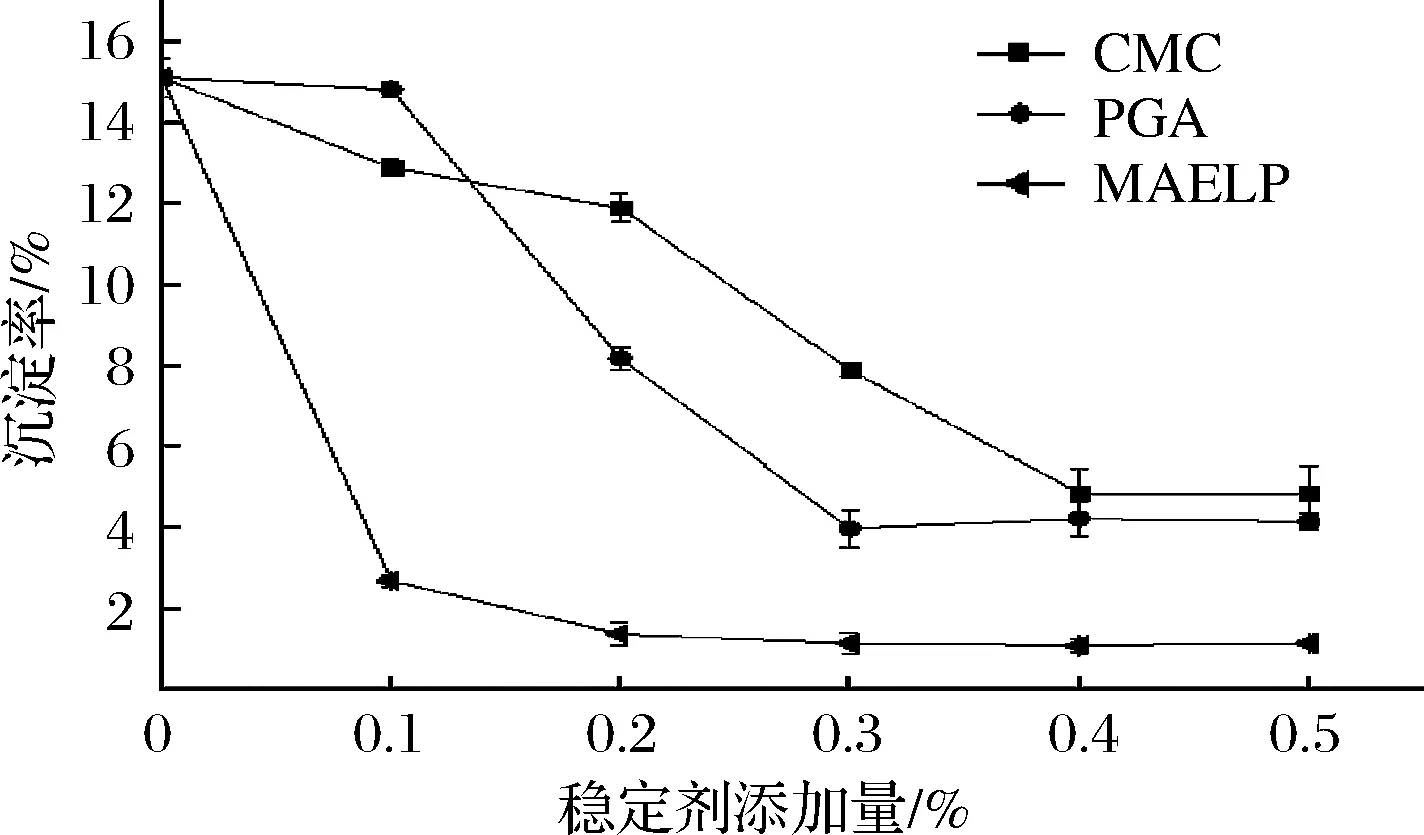
图1 不同稳定剂对酸性乳饮料沉淀率的影响Fig.1 Effects of different stabilizers on precipitation rate of acidic milk beverage
2.2 不同稳定剂对酸乳饮料感官的影响
如表2所示,不同稳定剂最佳使用量下对酸性乳饮料的感官差异显著(P<0.05)。感官评分由高到低分别为:MAELP、CMC、PGA、空白组。空白组感官评分远低于含稳定剂组,主要是由于未添加稳定剂的酸性乳饮料中酪蛋白在低于等电点的酸性条件下容易发生聚集沉淀,导致产品组织粗糙、不均匀、出现严重分层、沉淀现象;添加稳定剂组中,果胶的酸性乳饮料感官评分最高,其次是CMC。
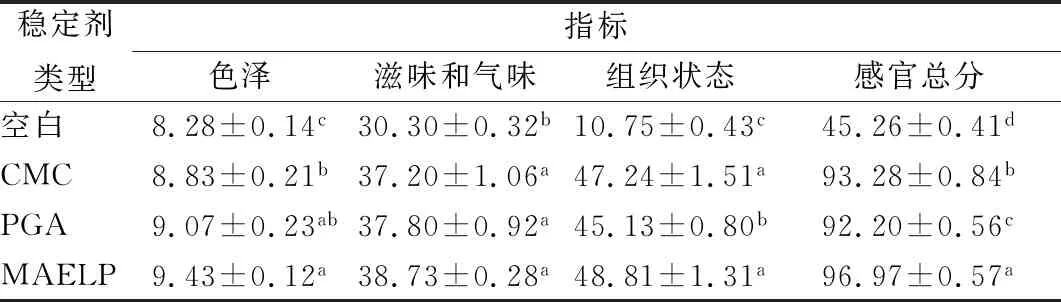
表2 稳定剂对酸性乳饮料感官品质的影响(n=20)Table 2 Effect of stabilizers on sensory quality of acidic milk beverage
注:相邻字母表示P<0.05;相间字母表示P<0.01。
2.3 不同稳定剂对酸乳饮料粒径的影响
产品的粒径分布是影响粒子沉降速率的一个重要因素[15]。正常情况下,酸性乳饮料中酪蛋白的下沉速度与其粒子半径成正比。半径越小,分布越均匀,其下沉速度越慢,饮料的稳定时间也就越长,乳液的稳定性越好[16]。如表3所示,不同稳定剂对产品粒径有显著差异(P<0.05)。粒径由高到低分别为:空白>CMC>PGA>MAELP。空白组粒径最大且随存放时间的延长饮料分层出现破乳现象;相比果胶,CMC、PGA粒径稍大,这可能由于果胶本身中性糖侧链多,在乳饮料表面形成水合层产生空间位阻效应大,使得产品粒径小[17]。此外,随着储存时间的延长,空白组粒径不断增加;添加稳定剂的乳液粒径变化不明显,说明所有稳定剂都具有较好的稳定性,都能提高酸性乳饮料产品的稳定性。在工业生产中,可以通过添加稳定剂来降低乳液粒径,提高产品的稳定性。
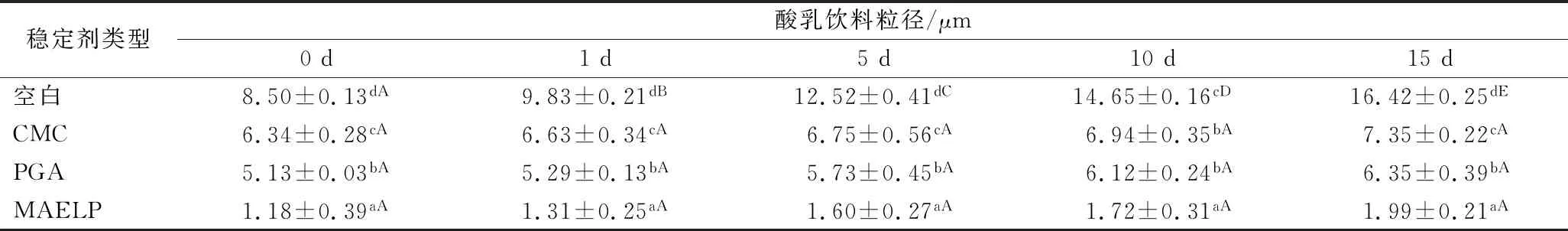
表3 不同稳定剂下酸性乳饮料粒度分布Table 3 Granularity distribution of acid milk beverage with different stabilizers
注:肩标小写字母表示同列差异显著P<0.05,大写字母表示同行差异显著P<0.05。下同。
2.4 不同稳定剂对酸性乳饮料电位的影响
Zeta电位是指带电微粒表面剪切层的电位,由微粒表面电荷和周围溶液环境条件共同决定,广泛用于描述溶液微粒之间的静电相互作用,是表征溶液体系稳定性的重要指标[18]。如表4所示,不同稳定剂产品Zeta电位绝对值由高到低依次为:MAELP、CMC、PGA、空白。酸性乳饮料pH值为3.8~4.2,低于酪蛋白的等电点4.6,空白组酪蛋白质胶粒带正电,蛋白聚集沉淀,溶液Zeta电位小且为正[19];添加CMC、PGA、果胶的产品的Zeta电位为负、绝对值高,这可能是由于带负电荷的阴离子多糖因静电吸附作用吸附在酪蛋白表面,酪蛋白“表观”Zeta电位为负,具有静电斥力和空间位阻作用,使酸性乳饮料具有一定稳定性[20]。此外,随着存放时间的增加,添加稳定剂的产品Zeta电位的绝对值减小但差异不大,说明添加的稳定剂都具有良好的稳定性。不同稳定剂对乳液Zeta电位差异显著(P<0.05),果胶产品比CMC、PGA产品电位高,这可能是由于果胶的带电性质引起的,其羧基基团的负电荷与蛋白质的氨基基团发生的静电交互作用比CMC、PGA强[21]。

表4 不同稳定剂的酸性乳饮料在储存过程产品Zeta电势的变化Table 4 Zeta potential of milk beverage with different stabilizers during storage
2.5 酸乳饮料流变性
2.5.1 不同稳定剂对酸性乳饮料表观黏度的影响
流变学特征作为表征乳饮料制品形态和稳定特性的重要参数,体系黏度高可降低微粒的沉降速率,提高产品的稳定性[10]。如图2所示,所有产品的表观黏度随着剪切速率的增加而降低,表现出剪切稀化行为,具有假塑性流体的性质。表观黏度稳定时,酸乳饮料表观黏度由高到低依次为:MAELP、CMC、PGA、空白。果胶和CMC黏度较PGA大,这可能是由于与PGA相比,果胶和CMC的增稠作用更强,达到一定浓度后,能完全覆盖在蛋白质表面,稳定酸性乳体系中的蛋白质,使体系稳定[11]。从图3中看出,随时间的延长,所有产品的表观黏度都有所降低但不显著,在存放过程中表观黏度变化曲线均未出现上升拐点,表示产品未发生絮凝而导致黏度增加[22]。说明这几种稳定剂都具有良好的稳定性,且其添加不会改变酸性乳饮料的剪切稀化特性。
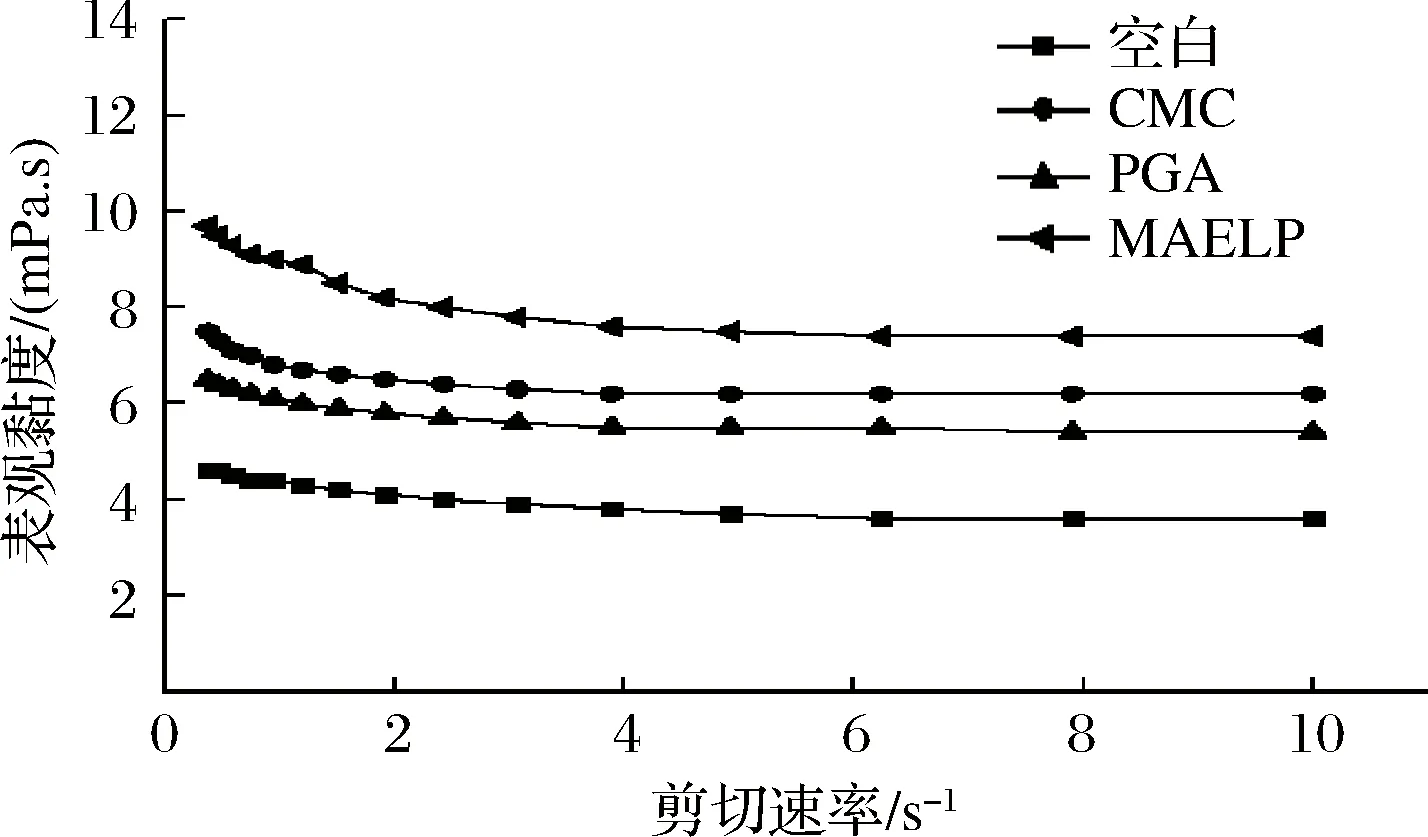
图2 不同稳定剂对酸乳饮料表观黏度的影响Fig.2 Effect of different stabilizers on apparent viscosity of acidic milk beverage
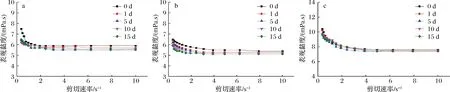
a-CMC表观黏度;b-PGA表观黏度;c-MAELP表观黏度图3 不同稳定剂酸乳饮料表观黏度变化图Fig.3 Apparent viscosity charts of acid milk beverage with different stabilizers
2.5.2 不同稳定剂对酸性乳饮料频率扫描的影响
酸性乳饮料的黏弹性可以通过动态流变学特性来描述,体系的动态黏弹性不仅能反应产品的实际稳定性,同时还能表征稳定剂与产品的相互作用。储能模量(G′)表示样品内部化学键数目和键能大小,损耗模量(G″)表示样品内部因摩擦损失能量的大小[10]。图4-a为CMC酸性乳饮料在存放过程G′和G″变化趋势图,G′和G″在存放时间内的变化无显著差异,说明在存放过程中酸性乳饮料未发生改变,具有一定的稳定性,且含其他稳定剂的酸性乳饮料在存放过程中G′和G″的变化与此类似(未列出)。对含不同稳定剂酸性乳饮料储存0 d的G′和G″分析,结果如图4-b、图4-c所示,所有样品G′和G″随着角频率的增加而增加,但大小有差异。损耗角正切值tanε为G″与G′比值,tanε越大,分子链段运动内耗越多,稳定性越差,其可反应样品体系的稳定性[22]。

a-CMC产品G′和G″变化;b-产品G′变化;c-产品G″变化图4 不同稳定剂酸乳饮料频率扫描图Fig.4 Scanning pictures of frequency of acid milk drinks with different stabilizers
由图5可知,添加稳定剂的样品较空白组tanε小,这可能是由于果胶、CMC、PGA是阴离子多糖,能通过氢键作用结合大量水,产品分子链缠绕较多,损耗正切值tanε小,具有长期贮藏稳定性[23],这一特性对于稳定剂在乳饮料中的应用具有积极的作用。
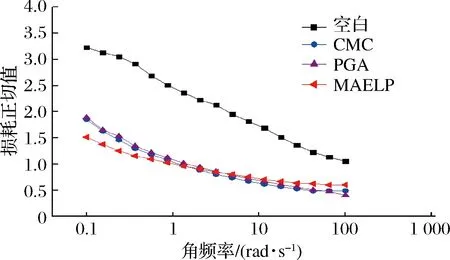
图5 不同稳定剂对酸性乳饮料损耗正切值的影响Fig.5 Effects of different stabilizers on tangent value of acid milk beverage
2.6 不同稳定剂对酸性乳饮料水分流动性的影响
核磁共振是一种优良的评价食品品质的技术手段,检测快速、灵敏、方便,被广泛应用于生物体系中水分的研究。核磁共振技术主要以氢质子为研究对象,能表征水分子流动性的纵向弛豫时间T1和横向弛豫时间T2[24]。横向弛豫时间T2大小代表水分流动性的强弱,T2减小,意味着体系中的大分子与水分子结合紧密,水分子的流动性减弱,产品具有更好的稳定性[12],通常根据T2推断水分子的结合力程度。
酸性乳饮料中质子弛豫时间的分布与样品中水分的存在状态及流动性密切相关。本实验利用核磁共振分析仪CPMG序列测量酸性乳饮料体系中水分子流动情况,使用纽迈多指反演软件反演所得的横向弛豫时间T2和信号幅度。如图6所示,所有样品都有2个T2区间:T21(0.05~5 ms)、T22(100~1 000 ms),其中0.05~5 ms的T21水分子可能是液体分子孔隙中所束缚的不易流动的水,也可能是与蛋白质等大分子表面极性基团紧密结合的水分子层,100~1 000 ms的T22可能表示样品中大量自由水。在T2区间,空白组的产品曲线弛豫时间T2最大,PGA其次,果胶和CMC小,这可能是由于果胶和CMC的增稠作用较PGA强,产品的黏度更高,产品水分子流动性弱,稳定作用强,影响了产品结合水和自由水之间的水[25]。将产品存放0、7、14 d后分别测定其水分流动性,如图7所示,在存放过程中,空白组的乳饮料弛豫时间T2随时间增加,信号幅度峰向右移动,T2增大,说明水分与其他组分结合的不紧密,样品稳定性差,而添加稳定剂的乳饮料在存放过程中弛豫时间T2并未发生显著性变化,只是信号强度略有改变,证明这几种稳定剂都具有很好的稳定性。
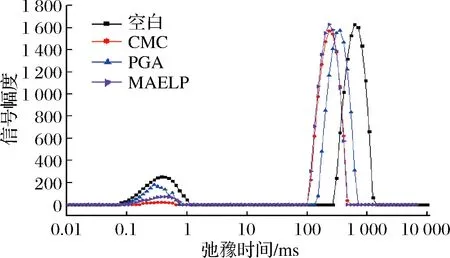
图6 不同稳定剂酸乳饮料0 d横向弛豫时间(T2)Fig.6 Transverse relaxation time(T2)distribution of acid milk with different stabilizers
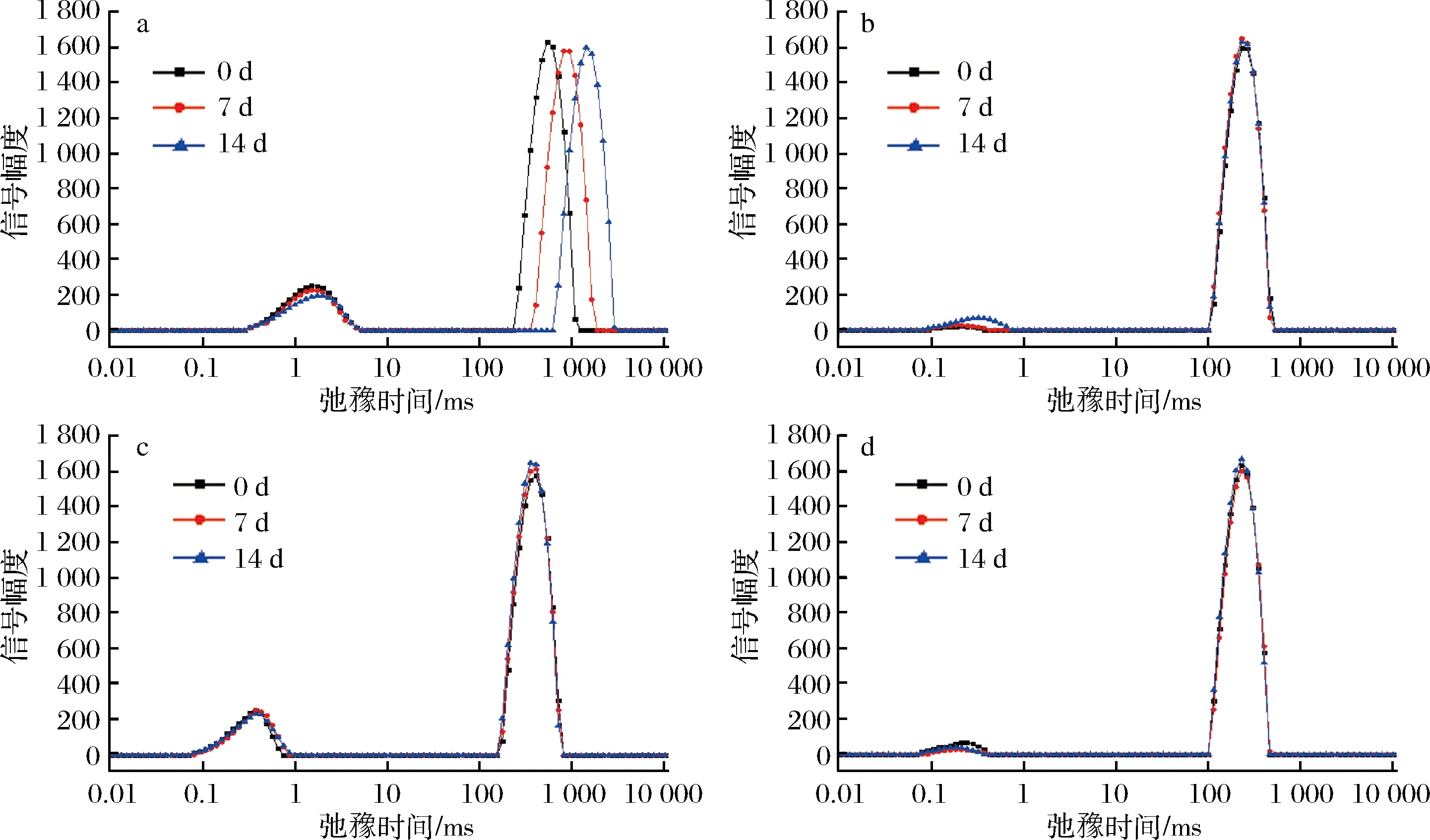
a-空白(T2);b-CMC(T2);c-PGA(T2);d-MAELP(T2)图7 稳定剂酸乳饮料储存过程中横向弛豫时间(T2)Fig.7 Transverse relaxation time (T2)of acid milk beverage during storage of stabilizers
2.7 不同稳定剂对酸性乳饮料R值的影响
R值大小可以更加直观、形象地表征酸性乳饮料的稳定性,实验对存放90 d后的含不同稳定剂的酸性乳饮料R值进行分析。由图8可知,将贮藏0 d的饮料R值定义为100%,空白组R值在存放过程中变化较大,随着存放时间的延长R值上升,这可能是由于在存放过程中出现分层现象,上层体系中大密度颗粒下沉;含不同稳定剂的酸性乳饮料R值的改变程度不同,添加MAELP的饮料R值最大且在整个存放过程中变化最小(2.63%),添加PGA产品R值最小但变化最大(4.16%)。与空白组相比,添加稳定剂的酸性乳饮料的R值在存放过程中变化小,这可能是由于加入的稳定剂与酪蛋白发生了缔合,增加了分子的空间体积,能更有效地吸附蛋白质分子,增强了产品的稳定性,R值变化再次从宏观角度证明了这几种稳定剂具有很好的稳定性。
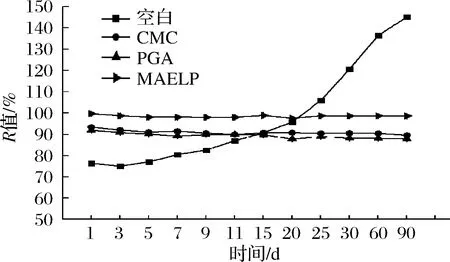
图8 不同稳定剂对酸乳饮料R值的影响Fig.8 Influence of different stabilizer on R value of acid milk beverage
3 结论
(1)以沉淀率为指标,稳定剂种类和用量对酸性乳饮料的稳定性均有显著影响(P<0.05),果胶、CMC、PGA的最适用量分别为0.30%、0.40%、0.30%。
(2)稳定剂对酸性乳饮料的稳定作用在宏观上表现为感官评分高、沉淀率降低、R值稳定,在微观性质上表现出产品的粒径减小、水分流动性减弱、表观黏度高、Zeta电位的绝对值升高。各指标随存放时间增加未发生显著性改变,几种稳定剂对酸性乳饮料都具有很好的稳定作用,就整体稳定效果而言,柠檬果胶的稳定作用最好,其次是CMC。

