核桃青皮提取物对铝在HNO3溶液中的缓蚀作用
李向红,邓书端2,徐 昕
(1.西南林业大学 化学工程学院,昆明 650224;2.西南林业大学 材料科学与工程学院,昆明 650224)
金属材料易发生腐蚀,缓蚀剂因具有操作简便、用量少、见效快等优势,已成为常用的重要防腐蚀技术之一[1]。铝作为产量和使用量最大的有色金属之一,其表面易被氧化形成一层氧化膜,因而具有一定的耐蚀性,但在酸性介质中(pH<4.5)这层氧化膜会发生溶解致使铝基体发生剧烈的析氢腐蚀。在铝材的酸洗工业中,需在酸洗过程中添加缓蚀剂来抑制酸对铝基体的腐蚀[2]。HNO3作为酸洗剂,不易使铝材发生氢脆现象,但目前关于HNO3溶液缓蚀剂的报道较少,主要有硫脲类衍生物[3-4]、三嗪衍生物[5]、苯甲酸衍生物[6]、席夫碱[7]等。
随着绿色发展意识的不断深入,研发绿色环保型缓蚀剂是当今乃至将来缓蚀剂研究领域的重要方向。从植物中提取制备的植物缓蚀剂具有资源丰富、成本低廉、可生物降解等优势,已成为当今绿色缓蚀剂的研究热点之一[8]。近年来,一些植物提取物对铝在HCl中的缓蚀作用已有相关报道,如竹叶[9-11]、三角枫叶[11]、滇润楠叶[11]、迎春花叶[12]、大蒜[13]、可乐树[14]、黄槟榔青原[15]等,而有关植物缓蚀剂对铝在HNO3溶液中的缓蚀作用却鲜见报道[16]。
核桃为胡桃科核桃属植物,与扁桃、腰果、榛子并称“世界四大干果”,我国作为核桃生产大国,种植面积、年产量均居世界第一[17]。云南省是我国核桃生产的第一大省,其栽培面积和产量约占全国的1/3[18]。在核桃果实采收后,大量核桃青皮成为垃圾堆放在田间、地头或沟边,成为蕴藏量特大且污染环境的废弃物,如果对其加以利用,不仅可以减少环境污染,还可以提升核桃资源的经济价值,具有广阔的开发利用前景。然而,在我国核桃果仁加工业迅速发展的今天,核桃青皮废弃物资源的综合利用明显滞后,基本处于未开发应用状态,特别是关于核桃青皮提取物(WGHE)作为缓蚀剂的研究目前鲜见报道。为此,本工作采用失重法、电化学法和金属表面分析仪测试研究了WGHE对铝在HNO3溶液中的缓蚀性能,系统考察了缓蚀剂含量(0.1~1.0 g/L)、温度(20~50 ℃)、溶液的酸浓度(1.0~4.0 mol/L)、腐蚀浸泡时间(3~48 h)等因素对其缓蚀性能的影响规律,探究了WGHE的电化学反应机理及其在铝表面的宏观吸附行为,并提出了缓蚀作用机理,以便为核桃青皮资源作为金属缓蚀剂的开发利用奠定基础,实现核桃青皮资源“变废为宝”。
1 试验
1.1 材料和试剂
试验材料为云南铝业昆明德海铝业有限公司生产销售的铝片,其化学成分(质量分数)为:99.60% Al,0.25% Si,0.03% Mn,0.05% Cu,0.32% Fe,0.03% Mg,0.03%Ti,0.05%Zn。核桃青皮为成熟的云南漾濞核桃(Juglans Silillata)剥离下来的副产物,在自来水下洗净除尘后、置于阴凉处风干水分后放入烘箱中于60 ℃烘干、粉碎(粒径约为350 μm),贮存于广口瓶中备用。乙醇、HNO3(质量分数65%)、石油醚(60 ℃~90 ℃)、丙酮,均为分析纯。
1.2 WGHE的提取制备及FTIR表征
取10 g核桃青皮粉末于三口烧瓶中,加入450 mL 体积分数为10%~60%的乙醇水溶液,室温(约23 ℃)下静置浸泡3 h后,置于水浴锅中于75 ℃ 回流3 h,过滤后用石油醚对滤液进行脱酯、旋蒸浓缩后,将浓缩液倒入表面皿中,随后放入真空干燥箱中干燥约48 h可得到棕黑色固体产物,即为WGHE(约为1.2 g,产率为12%)。采用AVATAR-FTIR-360红外光谱仪(美国Thermo Nicolet公司)对WGHE进行红外光谱(FTIR)测试,波数为400~4 000 cm-1。
1.3 失重法
将尺寸为25 mm×20 mm×2.0 mm的铝片用耐水砂纸(500~1 000号)逐级打磨后、丙酮脱脂,采用电子天平称量。将铝片悬于玻璃钩上全浸于不同温度的250 mL不含和含有WGHE的HNO3溶液中,恒温一定时间(24 h)后取出铝片,清洗表面腐蚀产物、吹干、称量,计算腐蚀失重。失重法测试的缓蚀率(ηw)根据式(1)计算:
ηw=[(W0-W)/W0]×100%
(1)
式中:W0、W分别为铝片在不含和含WGHE的HNO3溶液中的腐蚀质量损失,g。
1.4 电化学测试
采用三电极系统在PARSTAT2273电化学工作站(美国Princeton Applied Research公司)上进行电化学测试。辅助电极为铂电极(尺寸为1.0 cm×1.0 cm),参比电极为套有Luggin毛细管的饱和KCl甘汞电极(SCE)。工作电极(裸露面积为1.0 cm×1.0 cm)采用环氧树脂灌封,裸露面按1.3节中所述进行表面处理后放入装有250 mL腐蚀溶液的电解池中,浸泡2 h后使开路电位稳定。动电位极化曲线的扫描区间为-250~+250 mV(相对于开路电位),扫描速率为0.5 mV/s,据式(2)计算缓蚀率(ηp):
ηp=[(Jcorr-Jcorr(inh))/Jcorr]×100%
(2)
式中:Jcorr,Jcorr(inh)分别为铝在不含和含WGHE的HNO3溶液中的腐蚀电流密度,μA/cm2。
1.5 表面形貌观察
将尺寸为25 mm×20 mm×2.0 mm的铝片按1.3节中所述进行表面处理后,在20 ℃不含和含有1.0 g/L WGHE的1.0 mol/L HNO3溶液中浸泡24 h后取出,清洗、吹干,采用S-3000N型扫描电子显微镜(日本Hitachi High-Tech Science Systems Corporation)进行SEM形貌观察。
2 结果与讨论
2.1 WGHE的提取制备条件及FTIR
图1为乙醇体积分数(φ)对WGHE产率(P)的影响以及采用不同体积分数乙醇制得WGHE(加入量为1.0 g/L)对铝基材在1.0 mol/L HNO3(20 ℃)溶液中的缓蚀率(ηw)。由图1可见:WGHE的产率和缓蚀率均先随乙醇体积分数的增加逐步增加,当φ为40%时达到最大值(P=14.4%,ηw=85.7%),但φ继续增加至60%时,P和ηw反而下降,故乙醇的最佳体积分数为40%,后文所述WGHE均采用40%(体积分数,下同)乙醇制得。

图1 乙醇的体积分数(φ)对WGHE产率(P)及缓蚀率(ηw)的影响Fig.1 Effect of volume fraction (φ)of ethanol on yield (P)and corrosion inhibition rate (ηw)of WGHE

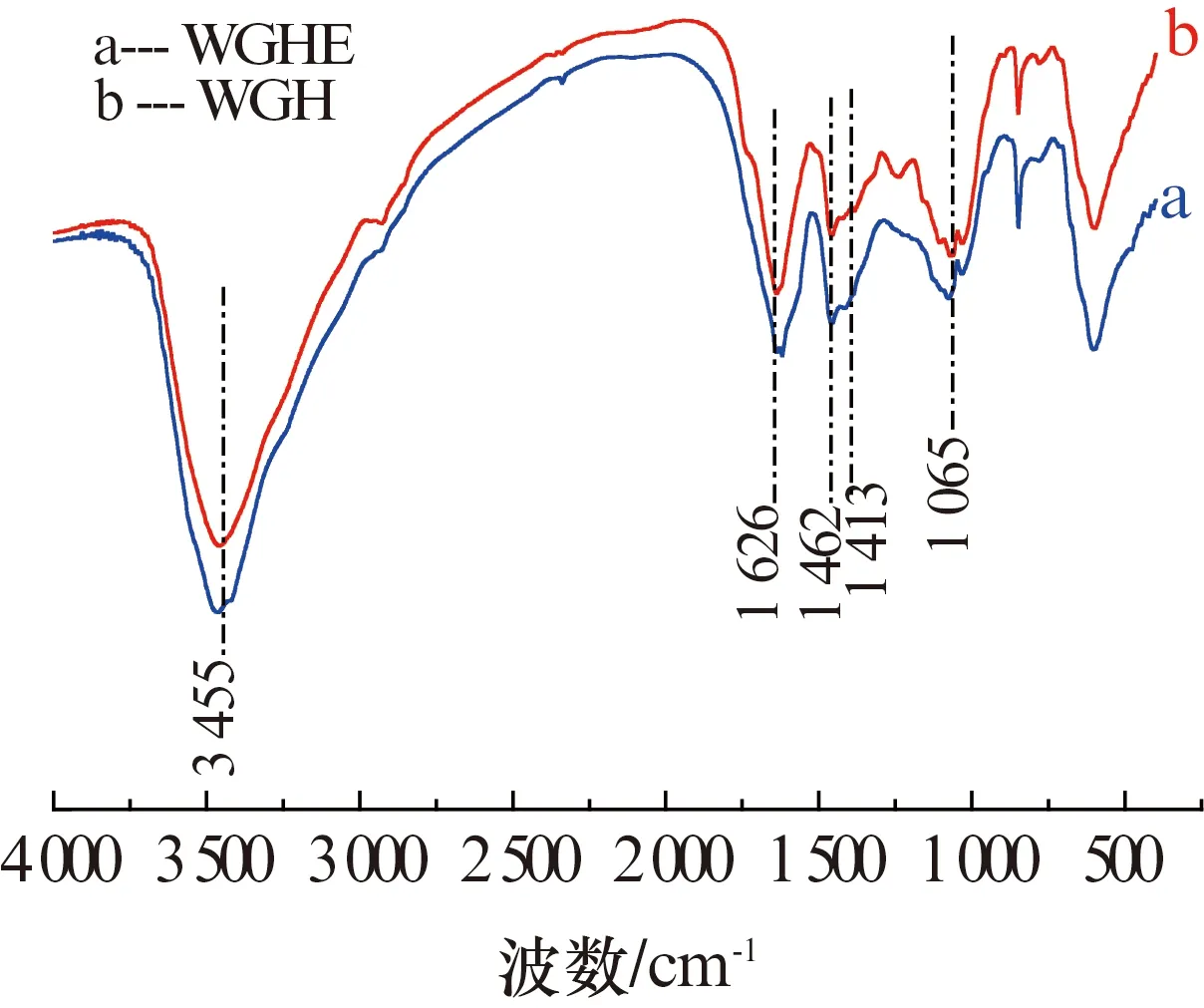
图2 核桃青皮(WGH)和核桃青皮提取物(WGHE)的红外光谱Fig.2 Fourier transform infrared spectroscopy of walnut green husk (WGH)and walnut green husk extract (WGHE)
2.2 失重法试验结果
2.2.1 WGHE质量浓度的影响
由图3可见:不同温度1.0 mol/L HNO3溶液中,ηw-c曲线呈现相似的变化趋势,即WGHE对铝的缓蚀性能随着WGHE加入量的增加而增大,但当WGHE加入量超过0.5 g/L后,缓蚀率逐渐趋于平缓,基本不再随缓蚀剂加入量的继续增加而增大,故0.5 g/L可以看作是WGHE的临界浓度。缓蚀剂分子在铝表面的吸附量随缓蚀剂浓度的增加而增大,而当缓蚀剂在铝表面的吸附量逐渐趋于饱和时,缓蚀性能也趋于稳定,不再随溶液中缓蚀剂含量的增加而增大。当WGHE的质量分数为1.0 g/L 时,其对铝在不同温度1.0 mol/L HNO3溶液中的ηw分别为85.7%(20 ℃)、80.5%(30 ℃)、74.0%(40 ℃)和69.0%(50 ℃),这表明WGHE对铝在1.0 mol/L HNO3溶液中具有良好的缓蚀作用。
图3亦表明,WGHE对铝的缓蚀率随着温度的升高而下降,这可能是由于温度升高加速酸对铝表面的碰撞频率,铝表面的腐蚀加剧。铝表面的析氢气速率加快,一方面会造成溶液中的缓蚀剂分子难以在铝表面发生吸附产生缓蚀膜层,另一方面也会使已吸附在铝表面的缓蚀剂分子易于发生脱附,造成缓蚀性能降低。
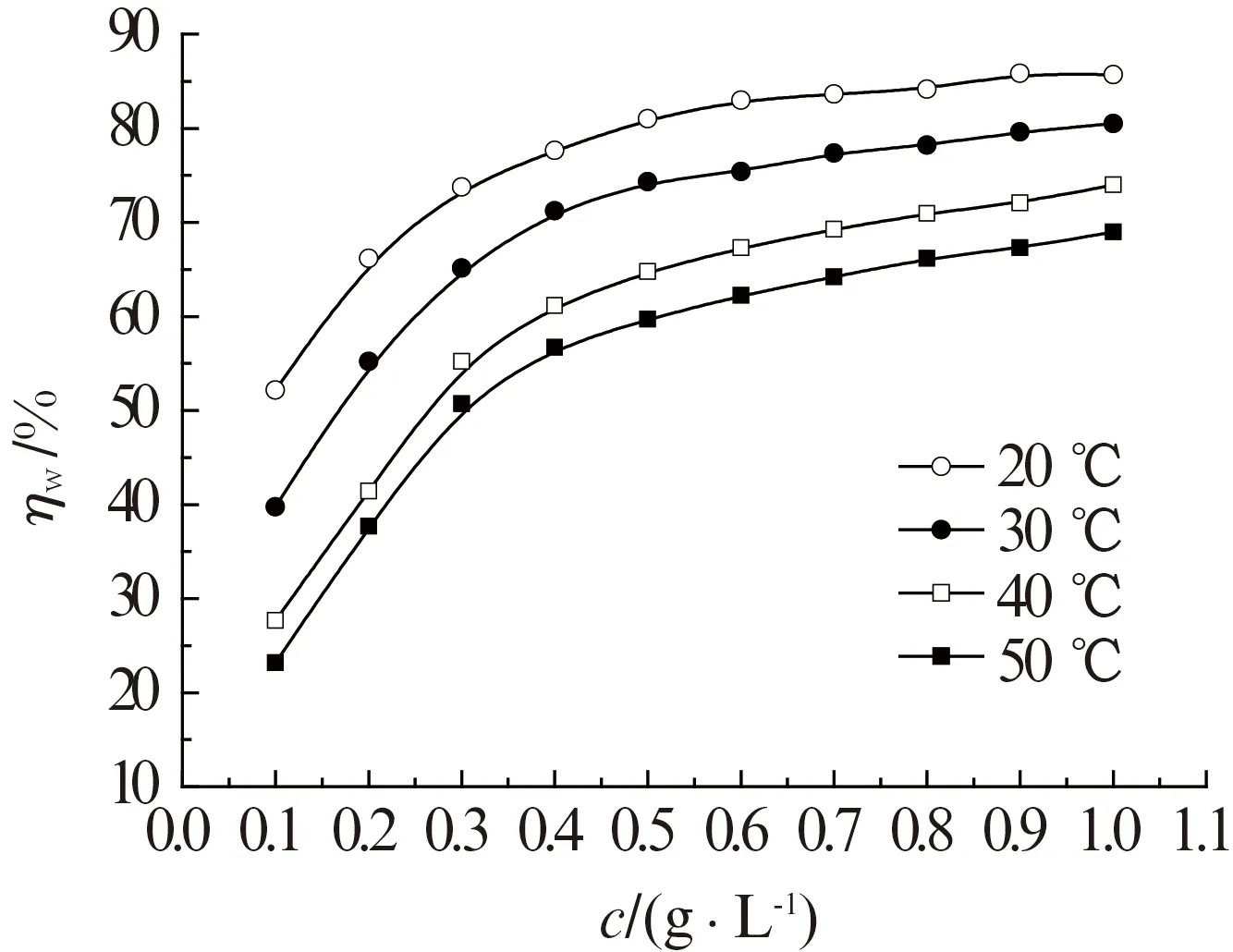
图3 不同温度1.0 mol/L HNO3溶液中,WGHE加入量对其缓蚀率的影响Fig.3 The effect of WGHE addition on its corrosion inhibition rate in 1.0 mol/L HNO3 solution at different temperatures
2.2.2 腐蚀浸泡时间的影响
腐蚀浸泡时间与缓蚀剂的缓蚀性能也有较大的相关性,故采用失重法测试了WGHE对铝在1.0 mol/L HNO3溶液中的缓蚀率随铝片浸泡时间的变化规律。由图4可见:当铝片的腐蚀浸泡时间为3 h时,不同温度下1.0 g/L WGHE对1.0 mol/L HNO3溶液中铝片的缓蚀率分别为69.8%(20 ℃)、51.1%(30 ℃)、39.4%(40 ℃)和32.8%(50 ℃)。这表明当腐蚀浸泡时间较短时,WGHE还未完全表现出良好的缓蚀作用。随着腐蚀浸泡时间的延长,WGHE的缓蚀性能不断加强,这可能是由于随着腐蚀浸泡时间的延长,WGHE在铝表面的覆盖愈加致密,从而使缓蚀作用不断加强。当腐蚀浸泡时间为24 h时,ηw趋于稳定,此后继续增加腐蚀浸泡时间直至48 h,缓蚀性能基本保持不变,不再随腐蚀浸泡时间的延长而发生明显改变,说明24 h 为临界腐蚀浸泡时间。且当铝片的浸泡时间为24~48 h时,WGHE在铝表面的吸附趋于饱和稳态,继续延长铝片的浸泡时间仍能保持良好的缓蚀后效性。由图4还可见:当浸泡时间为3~38 h时,WGHE的缓蚀性能随温度的升高而下降。

图4 不同温度含1.0 g/L WGHE 的1.0 mol/L HNO3溶液中缓蚀率(ηw)与腐蚀浸泡时间(t)的关系Fig.4 Correlation between corrosion inhibition rate (ηw)and corrosion soaking time (t)in 1.0 mol/L HNO3 solution with 1.0 g/L WGHE at different temperatures
2.2.3 HNO3浓度的影响
腐蚀浸泡时间为24 h,采用失重法测试不同温度条件下,1.0 g/L WGHE对铝片在不同浓度HNO3溶液中的缓蚀率,结果见图5。由图5可见:不同温度下,1.0 g/L WGHE对铝片在HNO3溶液中的缓蚀率随HNO3浓度的增加而呈线性下降趋势,MU等[21]研究表明有机缓蚀剂对H3PO4中的钢有相似的作用,这可能是因为增加酸的浓度,金属表面的腐蚀加剧,缓蚀剂分子难以在金属表面形成有效的缓蚀保护膜层,故缓蚀率下降;此外,由于缓蚀体系中腐蚀速率随酸浓度的变化为常数,故缓蚀率随酸浓度的增加而线性下降。当HNO3浓度为4.0 mol/L 时,不同温度下,1.0 g/L WGHE对铝片的缓蚀率分别下降至73.3%(20 ℃)、67.9%(30 ℃)、62.3%(40 ℃)和60.2%(50 ℃)。
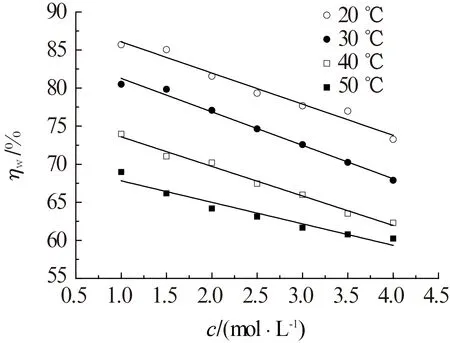
图5 不同温度下1.0 g/L WGHE的缓蚀率(ηw)与HNO3浓度(c)的关系Fig.5 Relationship between corrosion inhibition rate (ηw)of 1.0 g/L WGHE and HNO3 concentration (c)at different temperatures
2.3 极化曲线测试结果
由图6可见:在1.0 mol/L HNO3溶液中加入WGHE后,铝片阴阳两极的极化曲线均向低腐蚀电流密度方向移动,即加入WGHE对铝在1.0 mol/L HNO3溶液中的腐蚀阴阳两极反应均产生了抑制作用。对图5中的极化曲线进行Tafel拟合得出腐蚀电化学参数,结果见表1。
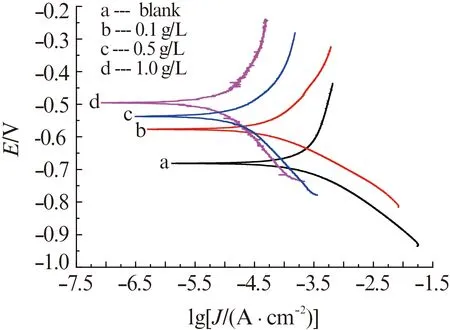
图6 20 ℃条件下铝片在不含和含不同量WGHE的1.0 mol/L HNO3溶液中的动电位极化曲线Fig.6 Potentiodynamic polarization curves for aluminum in 1.0 mol/L HNO3 solution with different concentrations of WGHE at 20 ℃

表1 极化曲线拟合结果Tab.1 Fitting results of polarization curves
由表1可见,在1.0 mol/L HNO3溶液中加入WGHE后,铝片的腐蚀电位(Ecorr)往正方向移动,且随着缓蚀剂加入量的增加,正移程度增大,当WGHE加入量为1.0 g/L时,腐蚀电位的最大正移值高达178 mV,已经超过85 mV,故WGHE可判断为阳极抑制型缓蚀剂[22]。腐蚀电流密度(Jcorr)随着WGHE加入量的增加而减小,对应的缓蚀率(ηp)则不断增加,WGHE加入量为1.0 g/L时缓蚀率高达92.7%,表明WGHE对铝在1.0 mol/L HNO3中具有良好的缓蚀性能。阴极Tafel斜率(bc)和阳极Tafel斜率(ba)在添加WGHE后发生了明显改变,这可能是由于WGHE吸附在铝表面后改变了铝电极表面的状态,致使极化电位随电流密度的变化发生明显变化。
2.4 SEM形貌观察
图7为铝表面的SEM微观形貌,从图7(a)可以看出,在1.0 mol/L HNO3溶液中腐蚀24 h后,铝表面有大量腐蚀坑孔、粗糙不平。与之形成鲜明对比的是,图7(b)中所示的铝在添加有1.0 g/LWGHE的1.0 mol/L HNO3溶液腐蚀24 h后表面没有形成腐蚀坑孔,且表面光滑平整,可观察到大量腐蚀浸泡前砂纸打磨过的条痕,表明WGHE明显抑制了铝在HNO3中的腐蚀,表现出良好的缓蚀性能。
2.5 WGHE在铝表面的吸附热力学
2.5.1 WGHE在铝表面的吸附等温式
WGHE的缓蚀性能与其在铝表面的吸附行为密切相关,假设WGHE在铝表面吸附后的表面覆盖度(θ)近似与缓蚀率(ηw)相等,即:
θ=ηw
(3)
采用各种吸附等温式对失重法试验数据(腐蚀浸泡时间为24 h)进行拟合,可得出1.0 mol/L HNO3中WGHE在铝表面的吸附符合Langmuir吸附等温式[9]:

(a)无WGHE

(b)含1.0 g/L WGHE图7 20 ℃下,铝片在不含和含1.0 g/L WGHE的1.0 mol/L HNO3溶液中浸泡24 h后的表面SEM形貌Fig.7 SEM morphology of aluminum sheet after soaking for 24 h in 1.0 mol/L HNO3 solution without (a)and with (b)1.0 g/L WGHE at 20 ℃
(4)
式中:c为缓蚀剂浓度,g/L;K为吸附平衡常数,L/g;θ为表面覆盖度。根据(4)式,作不同温度下的c/θ-c直线,见图8,由图8可见,c/θ与c之间存在良好的线性关系。表2列出了相应的c/θ-c线性回归参数。从表2中可以看出,各温度下c/θ-c的线性相关系数(r)和斜率均十分接近1,说明在此条件下,WGHE在铝表面的吸附符合Langmuir吸附等温式。
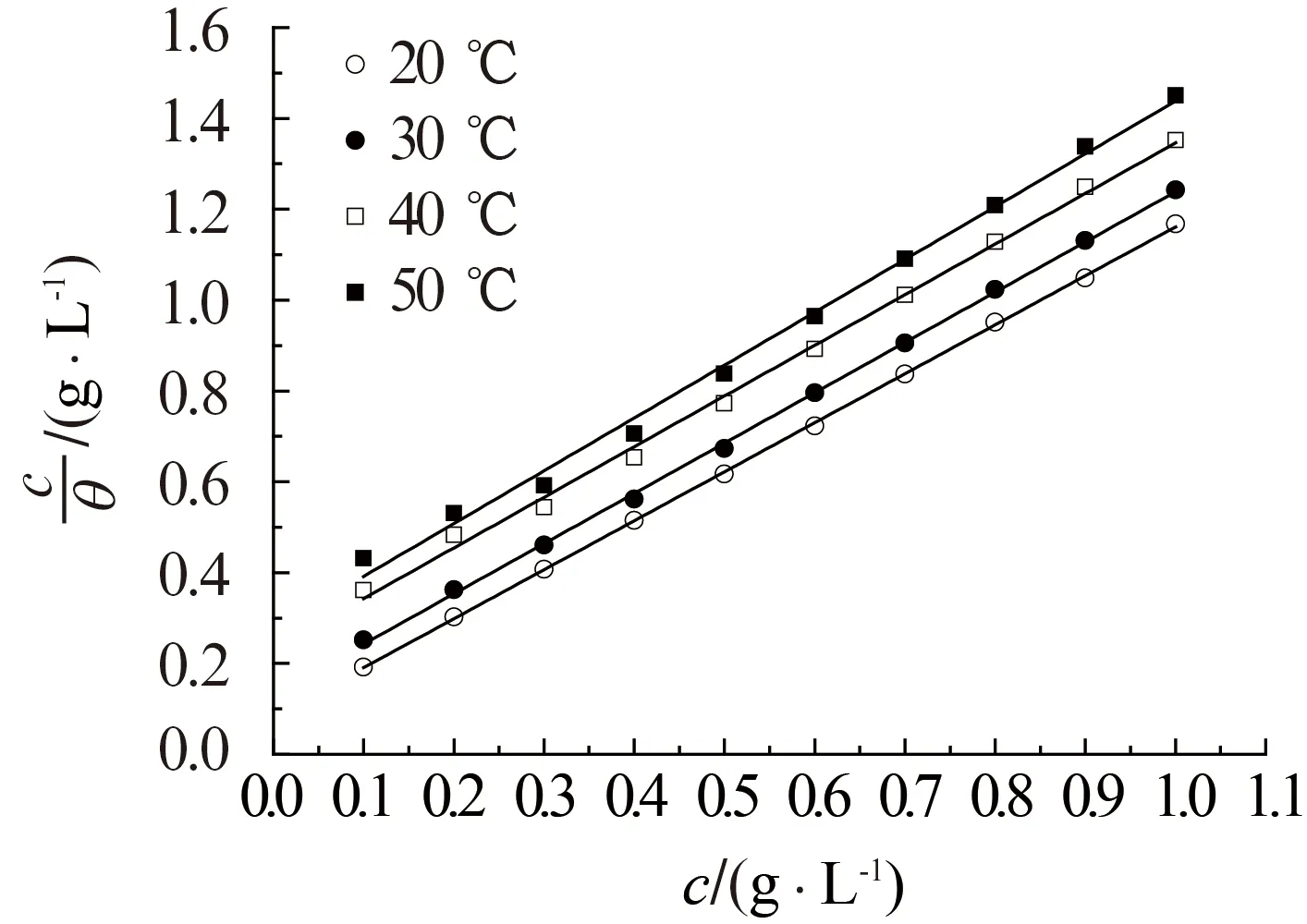
图8 1.0 mol/L HNO3溶液中的c/θ-c直线Fig.8 Straight lines of c/θ-c in 1.0 mol/L HNO3 solution
吸附平衡常数(K)可表征缓蚀体系中缓蚀剂分子从溶液中转移到金属表面吸附的转化程度,一般而言K值越大,缓蚀剂分子在金属表面的吸附程度越高,缓蚀性能也越强。从表2中可以看出,随着温度的上升K值下降,表明温度上升后WGHE分子在铝表面的吸附程度下降,吸附相对困难。

表2 c/θ-c的线性回归参数Tab.2 Linear regression parameters of c/θ-c
2.5.2 WGHE在铝表面的吸附热力学参数
为进一步探究WGHE在铝/酸界面上的吸附行为,利用物理化学中的基本公式处理试验数据,算出吸附热力学参数,并据此深入讨论了WGHE的吸附行为。吸附平衡常数(K)与温度(T)相关,两者之间的定量关系满足Van’t Hoff方程[9]
(5)
式中:ΔH0为标准吸附焓,kJ/mol;R为气体常数,8.314 J·K-1·mol-1;I为不定积分常数。根据式(5),作lnK-1/T拟合直线,见图9,相应拟合线性相关系数(r)为0.978 0,并由lnK-1/T直线斜率(-ΔH0/R)求算出ΔH0,结果列于表3。
缓蚀体系中WGHE在铝表面的吸附可近似看作溶液相中的缓蚀剂分子[WGHE(sol)]取代吸附在铝表面的溶剂分子[H2O(ads)]的过程,即

(6)
式中:WGHE(ads)为吸附在铝表面的WGHE分子,H2O(sol)为被缓蚀剂分子从铝表面取代下来进入溶液相的水分子。因此,标准吸附自由能(ΔG0)的计算中需引入溶剂水分子的浓度,按式(7)进行计算[23]。
(7)
式中:ρsolvent是缓蚀体系中溶剂的质量浓度;由于缓蚀剂的浓度用量很低,故缓蚀体系可看作稀溶液,对于溶剂H2O而言约为1.0×103g/L[24]。
得出ΔG0和ΔH0值后,标准吸附熵(ΔS0)可按式(8)进行计算:
ΔS0=(ΔH0-ΔG0)/T
(8)
不同温度1.0 mol/L HNO3溶液中,WGHE在铝表面的吸附热力学参数计算结果见表3。从表3可知,ΔH0为负值,表明当WGHE分子在铝表面发生吸附后会释放热量,即吸附过程为放热过程,缓蚀剂WGHE分子在铝表面的吸附量随温度的上升而下降,在高温时不利于吸附;值得注意的是,ΔH0的绝对值为10~60 kJ/mol,故WGHE分子在铝表面的吸附包含物理吸附和化学吸附[24]。ΔG0的绝对值为20~40 kJ/mol,进一步表明WGHE的自发吸附趋势较大,且吸附类型既含有物理吸附又含有化学吸附,且以物理吸附为主[24];ΔS0为负值,表明缓蚀剂WGHE分子自溶液相中吸附在铝表面后混乱度下降[25]。

图9 1.0 mol/L HNO3中lnK-1/T直线Fig.9 Straight line of lnK-1/T in 1.0 mol/L HNO3

表3 不同温度条件下,WGHE在铝表面的吸附热力学参数Tab.3 Thermodynamic adsorption parameters of WGHE on aluminum surface under different temperature conditions
2.6 腐蚀及缓蚀作用机理
铝在稀HNO3溶液中发生析氢腐蚀,腐蚀总反应为:

(9)
腐蚀反应由共轭的阳极反应和阴极反应构成,阳极反应机理如下[26]:

(10)

(11)
由反应式(11)可知,阳极反应的主要产物为[Al(H2O)6]3+,其在溶液中会继续发生下列变化反应:

(12)

(13)

(14)

铝在HNO3溶液中腐蚀的阴极反应为溶液中的H+得电子被还原为H2的过程,其反应机理如下:

(15)

(16)

(17)

3 结论
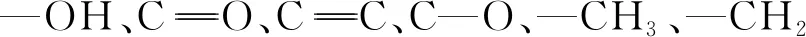
(2)WGHE对铝的缓蚀率随其加入量的增加而增大,随温度的升高而减小,随腐蚀浸泡时间的延长而增大。临界缓蚀剂质量浓度为0.5 g/L,临界腐蚀浸泡时间为24 h。
(3)WGHE能有效抑制铝在HNO3溶液中的腐蚀,其对铝在HNO3溶液中的缓蚀率随着HNO3浓度(1.0~4.0 mol/L)的增加而线性减小。

(a)黄酮类化合物与Al3+形成的配合物

(b)萘醌类化合物与Al3+形成的配合物图10 化学分子结构式Fig.10 Chemical molecular structures:(a)complex of falvanoid compound with Al3+;(b)complex of naphthoquinone compound with Al3+
(4)当WGHE的加入量为1.0 g/L,浸泡时间为24 h时,其对铝在不同温度1.0 mol/L HNO3溶液中的ηw分别为85.7%(20 ℃)、80.5%(30 ℃)、74.0%(40 ℃)和69.0%(50 ℃)。
(5)在HNO3溶液中添加WGHE后,铝的腐蚀电位正移,腐蚀电流密度下降,为阳极型缓蚀剂。WGHE在铝表面的吸附符合Langmuir吸附等温式,吸附平衡常数随温度的升高而下降;WGHE在铝表面的吸附为以物理吸附为主的混合吸附,且吸附后混乱度下降。

