低能N+离子注入诱变选育金耳多糖高产菌株的研究
蒋 益 郑惠华 刘广建* 薛 璟 季宏更 张 蕾
(1江苏省苏微微生物研究有限公司,江苏无锡214063;2江苏安惠生物科技有限公司,江苏南通226009)
金耳(Tremella aurantialba)为食药用菌中的珍稀品种之一,又称黄木耳,隶属担子菌亚门、层菌纲、银耳目、银耳科、银耳属。金耳多糖是金耳的重要化学成分之一,研究证实金耳多糖具有调节机体免疫能力、抑制肿瘤、降血糖、降血脂的作用,同时在抗溃疡、抗氧化、保肝、抗辐射、抗炎等方面具有良好的保健功效[1]。金耳子实体是由外层的金耳和内层的毛韧革菌组成的异质复合体,我国从20世纪80年代开始分离驯化金耳菌种,由于金耳寄生的特殊性及栽培的需求,目前金耳菌种多数为复合菌株[2],用于液体发酵的纯金耳菌种稀缺,因此,金耳菌种选育方面的研究显得尤为重要。在潮湿的条件下,金耳成熟的担孢子不容易发芽产生芽管,但容易似酵母菌那样以芽殖方式产生大量酵母状的分生孢子,这种分生孢子能像酵母菌那样,以芽殖的方式再产生大量酵母状的芽孢,使分生孢子的数量不断增多[3],这种生长速度快的酵母状分生孢子是诱变的理想材料。离子注入微生物是通过离子注入诱变出发菌株,通过对目标性状的生物效应分析,筛选获得高产、高效的突变菌株[4]。此方法在金耳人工诱变育种中尚未见报道,笔者进行了低能氮离子注入诱变选育金耳的试验,旨在为金耳选育提供参考。
1 材料与方法
1.1 供试材料
供试金耳菌株:金耳酵母状分生孢子菌株TA08,由江苏省苏微微生物研究有限公司分离得到,改良PDA培养基4℃保存。
培养基:改良PDA培养基为马铃薯200 g煮汁,葡萄糖20 g,KH2PO41 g,MgSO40.5 g,加水1000 mL,琼脂粉20 g,pH自然。金耳液体培养基为蔗糖10 g,葡萄糖 20 g,酵母膏 2 g,蛋白胨 2 g,KH2PO41 g,MgSO40.5 g,加水1000 mL,pH自然。发酵培养基为玉米粉30 g,豆饼粉10 g,蔗糖5 g,KH2PO41 g,MgSO40.5 g,加水1000 mL,pH自然。
主要设备:LZD-900型离子注入机(南京工业大学生物工程中心)。
1.2 试验方法
1.2.1 低能N+离子注入诱变
1.2.1.1 离子注入前处理
将金耳TA08接种于金耳液体培养基中,150 r∕min,25 ℃摇床培养2 d,然后用无菌水调整成浓度为105个∕mL级的金耳酵母状孢子悬液。吸取0.1 mL的孢子悬液于无菌空培养皿中,于超净工作台中快速涂匀风干,立即注入低能氮离子。
1.2.1.2 低能N+离子注入
低能N+离子注入前,LZD-900型离子注入机开机预热2 h,用紫外线对靶室持续消毒30 min,调节靶室真空度为10-3Pa,注入物质N+提前加速到20 KeV,对样品注入剂量分别为10×1014、20×1014、30×1014、60×1014、80×1014、100×1014、120×1014ions∕cm2。试验组采用间歇式脉冲注入低能N+离子,连续注入5 s后间隔15 s,对照组置于靶室真空中,不注入低能N+离子。每个处理设3个重复。
1.2.2 存活率统计
将经过氮离子注入的培养皿和对照处理(仅抽真空而没有离子注入)的培养皿用1 mL无菌水洗脱,取0.1 mL涂布于金耳固体培养基平板上,25℃避光培养4 d后计数,然后以注入剂量为横坐标,存活率为纵坐标,绘制金耳在不同剂量的N+离子注入下的存活率曲线。
存活率=某剂量下离子注入组菌落数∕对照组平板上生长的菌落数×100%
1.2.3 低能N+离子注入对金耳菌株突变率的影响
以出发菌株作为对照,随机挑取接受离子注入诱变后形成的菌落分别进行液体发酵试验,每个剂量挑取30个菌株,考察菌株的多糖产量。高于对照5%以上的为正突变,低于对照5%以上的为负突变,正突变的菌株数占所取菌株总数的比值为正突变率,负突变的菌株数占所取菌株总数的比值为负突变率。
1.2.4 诱变金耳菌株的筛选
1.2.4.1 初筛
将经离子束注入后的培养皿用1 mL无菌水洗脱,取0.1 mL涂布于固体平板上,待菌落长成后,挑取生长较快、菌落较大的保存于试管中。根据以上步骤2最终确定的剂量,选择该剂量下保存的菌株,接种于金耳液体培养基,150 r∕min,25℃,摇床培养3 d后,再按5%接种量与出发菌株同步接种到金耳液体培养基摇床培养,150 r∕min,25℃培养4 d后用血球计数法统计酵母状孢子数量。
1.2.4.2 复筛
将初筛得到的优势菌株接种于金耳液体培养基中,150 r∕min,25 ℃,摇床培养3 d后,按5%接种量与出发菌株同步接种到发酵培养基中,与出发菌株同时进行液体发酵。测定多糖产量,选择多糖产量高于对照菌株5%以上的菌株作为复筛后的诱变高产菌株。
1.2.4.3 多糖测定
发酵结束后,将发酵液(包含菌体)收集后,超声30 min,而后煮沸处理2 h,离心收集上清后残渣加等体积水继续煮沸2 h,合并两次提取液,浓缩至原体积1∕5,加入4倍体积的无水乙醇静置沉淀,后采用硫酸-蒽酮法[5]测定多糖含量,再计算多糖产量。
1.2.5 遗传稳定性试验
对筛选所得的优势诱变菌株进行发酵性能稳定性试验。诱变菌株连续传代20代,取第10代和20代发酵,测定生物量和多糖产量,与第一代比较,选择多糖产量稳定、性状无变化的菌株作为最终的诱变多糖高产金耳菌株。
2 结果与分析
2.1 低能N+离子注入诱变对存活率的影响
不同N+注入剂量下金耳的存活率曲线(图1)显示,在注入剂量10×1014~120×1014ions∕cm2,随着注入剂量的增加,存活率呈现先降低、后升高再降低的“马鞍型”变化趋势。可能是由于低剂量离子注入细胞的射程较短,离子只对细胞表面造成损伤和刻蚀,因而存活率较高;随着注入剂量的增加,细胞表面的刻蚀严重,离子损及细胞内部并产生大量的自由基等,致使存活率急剧下降;但下降到一定值时出现饱和现象,当剂量累积到一定值时,细胞某种修复机制被激活,存活率有所回升;当剂量继续增加时,细胞损伤将无法修复,存活率继续下降。研究发现,在“马鞍型”区域菌株最容易出现较高的正突变。

图1 不同N+离子注入剂量下金耳的存活率曲线
2.2 低能N+离子注入对菌株突变率的影响
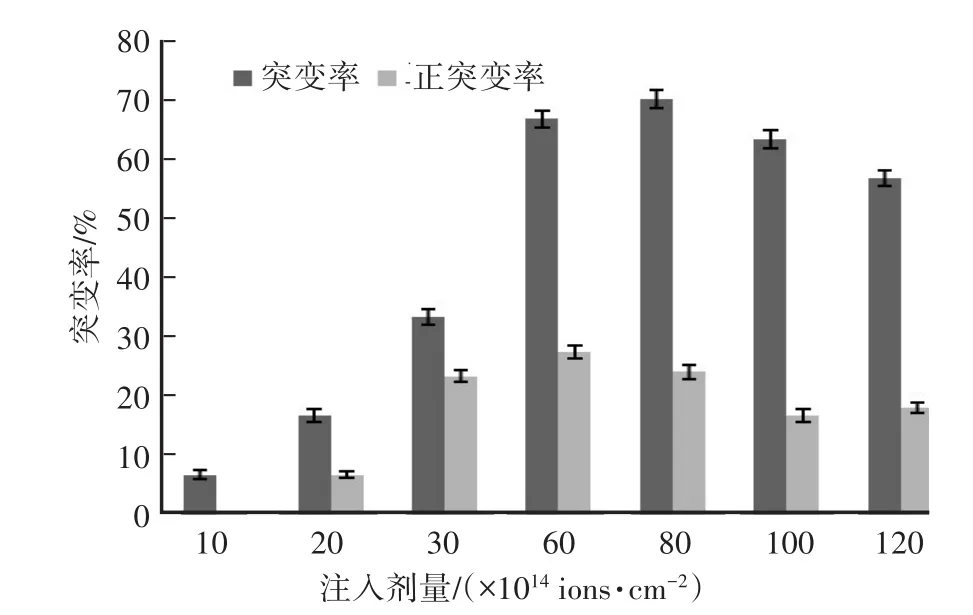
图2 不同N+离子注入剂量对金耳突变率的影响
在低能N+离子注入剂量60×l014~80×1014ions∕cm2内正突变率较高,在剂量 60×l014ions∕cm2时,正突变率最高(图2)。有研究表明,当诱变致死率达70%~80%时,产生较高的正突变,试验中正突变占优势的注入剂量范围正对应存活率19.3%~26.2%的曲线段(图1),综合图1及图2的结果,低能N+离子注入最适诱变剂量为 60×l014ions∕cm2。
2.3 诱变菌株的筛选结果
2.3.1 初筛
选择60×l014ions∕cm2注入剂量下的诱变菌株进行初筛,选取生长快、菌落大的单菌落与出发菌株(TA08)进行液体发酵,结果筛选到29株孢子量高于对照5%的菌株,部分菌株(前9位)结果见表1。其 中 菌 株 TAY6034、TAY6042、TAY60104、TAY60108、TAY6048、TAY6098具有较高的产量,较出发菌株TA08均有20%以上的提升,而4 d内生长速度最快的为TAY6048。

表1 诱变菌株的初筛结果
2.3.2 复筛
对初筛菌丝量前9的优势菌株进行复筛,以多糖产量为考察依据,筛选得到多糖产量高于对照菌株5%的有5株,其中3株优势菌株TAY60104、TAY6048、TAY6098(图 3),其多糖产量分别为2.55 g∕L,2.66 g∕L,2.58 g∕L,比出发菌株分别提高了7.59%,12.34%,8.87%。
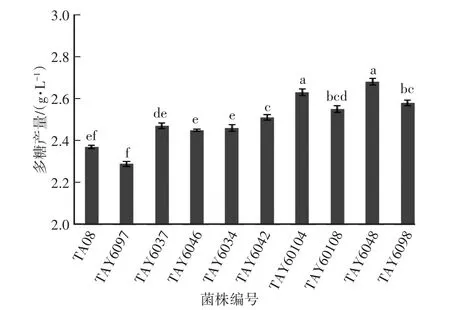
图3 诱变菌株的复筛结果
2.4 遗传稳定性试验
将复筛所得3株优势菌株与对照菌株一起进行遗传稳定性试验,结果见表2。由表2可知,多次传代后菌株TAY60104多糖产量下降较明显,菌株TAY6048与TAY6098从初代到20代,多糖产量变化不大,其中TAY6048产量稳定,基本上维持在2.7 g∕L左右,说明其遗传稳定性较好,故选定其为适宜于液体发酵的金耳多糖高产菌株。

表2 诱变菌株的遗传稳定性
3 小结与讨论
经过多年的研究实践,食用菌菌种选育己从最初的选择育种、杂交育种发展到物理化学诱变、原生质体融合育种以及运用分子生物学技术进行育种等[6],但目前金耳的诱变选育研究开展较少。离子注入技术是我国自主研发且具有独立知识产权的技术,以其独特的诱变机理和较显著的生物学效应受到广泛关注,离子注入的能量、剂量、脉冲次数等参数可以按需要进行不同组合,这种联合作用不但使诱变具有较高的方向性和可控性,还可使产生的生物学效应比单一辐射更为丰富,为筛选有利的突变型提供了较大空间[7]。该技术在食药用真菌诱变中已有应用。汪维云[8]采用20×1013~100×1013ion∕cm2剂量的 N+离子注入灰树花菌株,发现注入剂量在 40×1013~60×1013ion∕cm2时,能促进其菌体生长、提高纤维素酶活性,同时提高多糖产量,并用纸层析和GC法对离子注入处理和对照菌的产物进行比较鉴定,结果显示多糖性质与结构一致。凡启超[9]采用低能氮离子束注入松乳菇,筛选到诱变菌株Ld-135,其液体发酵生物量为1.24 g∕100 mL,胞内多糖的含量为1.27%,粗蛋白含量为26.13%,较出发菌株均具有显著性提高。董先茹等[10]采用氮离子束诱变蟹味菇菌株,筛选出了相对于出发菌株麦角甾醇显著提高的突变菌株X-004,其菌盖中麦角甾醇含量为 4.228 mg∕g,菌柄中为1.690 mg∕g,蛋白质和粗纤维含量分别达到35.41%和23.29%。
金耳子实体是由外层的金耳和内层的毛韧革菌组成的异质复合体,金耳菌丝的生长必须借助于有亲和性的伴生菌(毛韧革菌)菌丝体的帮助,才能正常地生长发育。用金耳子实体提取或混合菌株发酵生产的金耳多糖已少量投放市场,但由于金耳菌种寄生的这种特殊性,固体栽培金耳子实体产量小,周期长,易受季节影响以及病虫害侵袭,没有足够的金耳子实体进行工业化生产;而用混合菌株发酵时,条件不同导致金耳菌和毛韧革菌消长也会不同,常常粗毛韧革菌占优势,金耳少,所获得二次代谢物的多糖有差异,产量与品质不稳定。因而可以利用金耳酵母状分生孢子发酵生产多糖,在适宜条件下得到恒定的多糖成分。笔者采用氮离子注入技术对金耳进行诱变,提高了诱变的效率和正突变的概率,经不同剂量的氮离子注入后,在最适剂量 60×1014ions∕cm2下,筛选到一株遗传性状稳定的金耳新菌株,其液体发酵多糖产量远高于出发菌株,且诱变后的金耳菌株不易发生退化,遗传性状稳定,填补了金耳菌种诱变方面的空白,为金耳多糖的生产提供了一种新的高效高产菌株。

