大蒜素对重症中暑大鼠炎性介质和氧化应激及脏器功能的影响
沈德新 李庆华 孙荣青 吴籽欣 王海伟 董桂云 王楠楠 闫进


[摘要] 目的 觀察大蒜素对重症中暑大鼠炎性因子水平、抗氧化及脏器功能的影响。 方法 将60只雄性SD大鼠按随机数字表法分为正常对照组(n = 20)和热打击组(n = 40),将热打击组40只大鼠随机分为生理盐水组和大蒜素组,每组20只。实验开始前热打击组所有大鼠均接受环境模拟的适应性训练2周。并与适应性训练最后10 d,大蒜素组每日定时经口腔灌胃大蒜素20 mg/kg,生理盐水组给予相同体重比例的生理盐水。适应性训练结束后将热打击组大鼠置于仿真热气候动物舱进行热打击,时间为90 min。出舱24 h所有大鼠抽取股动脉血检测血清白细胞介素17(IL-17)、白细胞介素1β(IL-1β)、肿瘤坏死因子-α(TNF-α)、血清超敏-C反应蛋白(hs-CRP)、丙二醛(MDA)、超氧化物歧化酶(SOD)、总抗氧化能力(T-AOC)、晚期蛋白氧化产物(AOPPs);应用全自动生化分析仪检测血肌酐(SCr)、尿素氮(BUN)、丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)含量。 结果 与正常对照组比较,经热打击及运动处理后,大蒜素组及生理盐水组大鼠血清IL-17、IL-1β、TNF-α、hs-CRP及MDA、AOPPs均显著升高,SOD、T-AOCf均显著下降,肝、肾生化指标SCr、BUN、ALT、AST水平均显著升高,差异均有高度统计学意义(P < 0.01);与生理盐水组比较,大蒜素组大鼠血清IL-17、IL-1β、TNF-α、hs-CRP及MDA、AOPPs显著降低,SOD、T-AOC显著升高,血清SCr、BUN、ALT、AST含量水平显著降低,差异均有高度统计学意义(P < 0.01)。结论 热打击及运动处理后,大鼠血清炎性因子产生和释放增加,脂质过氧化水平提高。大蒜素可降低重症中暑大鼠血清炎性因子的产生和释放及脂质过氧化水平,达到保护脏器功能的作用。
[关键词] 大蒜素;重症中暑;氧化应激;炎性因子;脏器功能;大鼠
[中图分类号] R282.740 [文献标识码] A [文章编号] 1673-7210(2019)07(a)-0025-04
Effects of allicin on inflammatory mediators, oxidative stress and organ function in rats with severe heat stroke
SHEN Dexin1 LI Qinghua2 SUN Rongqing3 WU Zixin4 WANG Haiwei2 DONG Guiyun2 WANG Nannan2 YAN Jin2
1.Department of Pediatrics, the 988th Hospital of PLA, He′nan Province, Zhengzhou 450042, China; 2.Department of Intensive Care Unit, the 990th Hospital of PLA, He′nan Province, Zhumadian 463008, China; 3.Department of Intensive Care Unit, the First Affiliated Hospital of Zhengzhou University, He′nan Province, Zhengzhou 450042, China; 4.Department of Education and Training Program for Excellent Doctors in Clinical Medicine, Xinxiang Medical College, He′nan Province, Xinxiang 453000, China
[Abstract] Objective To observe the effect of allicin on the levels of inflammatory factors, antioxidation and organ function in rats with severe heat stroke. Methods Sixty male SD rats were randomly divided into normal control group (n = 20) and heat shock group (n = 40). Forty rats in heat shock group were randomly divided into saline group and allicin group, with 20 rats in each group. All rats in the heat shock group received adaptive training of environmental simulation for 2 weeks before the start of the experiment. At the last 10 d of adaptive training, the allicin group was given 20 mg/kg of allicin orally at regular intervals every day, and the saline group was given saline with the same proportion of body weight. After adaptive training, rats in the heat shock group were placed in the simulated hot climate animal cabin for 90 minutes. Femoral artery blood was taken from all rats 24 h after cabin exit to detect serum interleukin-17 (IL-17), interleukin-1β (IL-1β), tumor necrosis factor-α (TNF-α), serum hs-CRP, malondialdehyde (MDA), superoxide dismutase (SOD), total antioxidant capacity (T-AOC), and advanced protein oxidant products (AOPPs). Serum creatinine (SCr), blood urea nitrogen (BUN), alanine aminotransferase (ALT) and aspartate aminotransferase (AST) were measured by automatic biochemical analyzer. Results Compared with the normal control group, the levels of IL-17, IL-1β, TNF-α and hs-CRP in serum of rats in allicin group and saline group were significantly increased after heat shock and exercise treatment, the lipid peroxide MDA and AOPPs increased significantly, while the antioxidant SOD and T-AOC decreased significantly, and the levels of liver and kidney biochemical indexes SCr, BUN, ALT and AST were significantly increased, the differences were statistically significant (P < 0.01). However, compared with the saline group, the levels of IL-17, IL-1β, TNF-α, hs-CRP, MDA and AOPPs in serum of rats in allicin group were significantly decreased, the SOD and T-AOC increased significantly, the levels of liver and kidney biochemical indexes SCr, BUN, ALT and AST were significantly decreased, the differences were statistically significant (P < 0.01). Conclusion After heat shock and exercise treatment, the production and release of inflammatory factors and the level of lipid peroxidation in serum of rats increased. Allicin can protect the organs by reducing the production and release of inflammatory factors and lipid peroxidation in the serum of rats with severe heat stroke.
[Key words] Allicin; Severe heat stroke; Oxidative stress; Inflammatory factors; Organ function; Rat
中暑是一种严重威胁生命的疾病,表现为核心体温超过40℃。重症中暑时机体循环血量减少,组织缺血缺氧以及高热对细胞的直接损伤,可造成大量炎症介质释放,炎症细胞异常活化,细胞内氧自由基大量堆积,氧化应激失衡,导致全身炎症及多器官功能障碍综合征(MODS)[1-2]。大蒜素可抑制炎症因子的分泌,同时具有较强的还原性,有清除氧自由基的能力,阻止细胞内氧自由基对细胞器、代谢酶、活性蛋白分子的损伤,稳定细胞的正常生理功能[3],为减轻重度中暑全身炎症及多器官功能障碍的发生提供了可能性。本文通过研究大蒜素对重症中暑大鼠炎性介质和氧化应激及脏器功能的影响,为重症中暑的预防提供实验依据。
1 对象与方法
1.1 实验动物
雄性SD大鼠60只,动物合格证号:20180011。按随机数字表法分为正常对照组(n = 20)和热打击组(n = 40)。将热打击组40只大鼠随机分为生理盐水组和大蒜素组,每组20只。热打击组均于热打击前2周接受环境模拟动物舱、小动物跑台和直肠热电偶的适应性训练,适应性训练最后10 d,大蒜素组每日定时经口腔灌胃大蒜素(20 mg/kg),生理盐水组以同样方式给予相同体重比例的生理盐水。正常对照组始终置于23~25℃,相对湿度为50%~70%环境中,不进行任何形式的训练。
1.2 仪器试剂
大蒜素注射液购自上海禾丰制药有限公司,酶联免疫吸附试验(ELISA)试剂盒购自武汉博士德生物有限公司,生化指标采用日立7600-P全自动生化分析仪及配套试剂,自制环境模拟动物舱。
1.3 热打击
热打击组于饲养和灌胃10 d进行热打击,热打击前将环境模拟动物舱预热到30℃,将热打击组大鼠置于30 ℃仿真热气候动物舱,于30 min内将舱内温度升至39℃,湿度65%。在舱内温度升至39℃,湿度65%时,大鼠给予跑台运动,跑步速度设置为15 m/min,坡度为0°,每次8 min,间隔2 min,热打击时间为90 min。正常对照组饲养于温度23~25℃,相对湿度为50%~70%环境中,禁食、水。本实验中动物处置方法均符合动物伦理学标准,并经医院伦理委员会审批(审批号:20150011)。
1.4 直肠温度监测
热打击组出舱后立即采用生理记录仪的热电偶测量大鼠直肠温度(Tc),然后饲养于温度23~25℃,相对湿度为50%~70%的环境中,自由进食、水。
1.5 测试样本的采集与检测
正常对照组于禁食、水24 h后及热打击组于出舱24 h后取股动脉血2 mL,采用ELISA法检测血清白细胞介素17(IL-17)、白细胞介素1β(IL-1β)、肿瘤坏死因子-α(TNF-α)、血清超敏-C反應蛋白(hs-CRP)、丙二醛(MDA)、超氧化物歧化酶(SOD)、总抗氧化能力(T-AOC)、晚期蛋白氧化产物(AOPPs)水平。应用日立7600-P全自动生化分析仪检测血清SCr、BUN、ALT、AST含量水平。所有实验操作均严格按照说明书进行。排除热打击及运动实验期间死亡及核心温度(Tc)<41℃的大鼠,热打击组最终纳入35只大鼠,其中生理盐水组17只、大蒜素组18只。
1.6 统计学方法
采用SPSS 21.0统计学软件进行数据分析,计量资料用均数±标准差(x±s)表示,两组间比较采用t检验;计数资料用率表示,组间比较采用χ2检验,以P < 0.05为差异有统计学意义。
2 结果
2.1 炎症因子
与正常对照组比较,热打击及运动处理后,大蒜素组及生理盐水组大鼠24 h血清炎性细胞因子IL-17、IL-1β、TNF-α、hs-CRP显著升高,差异有高度统计学意义(P < 0.01);大蒜素组低于生理盐水组,差异有高度统计学意义(P < 0.01)。见表1。
2.2 氧化应激
与正常对照组比较,运动及热打击处理后,大蒜素组及生理盐水组大鼠血清MDA、AOPPs含量水平显著升高,SOD、T-AOC显著降低,差异有高度统计学意义(P < 0.01);大蒜素组MDA、AOPPs低于生理盐水组,SOD、T-AOC高于生理盐水组,差异有高度统计学意义(P < 0.01)。见表2。
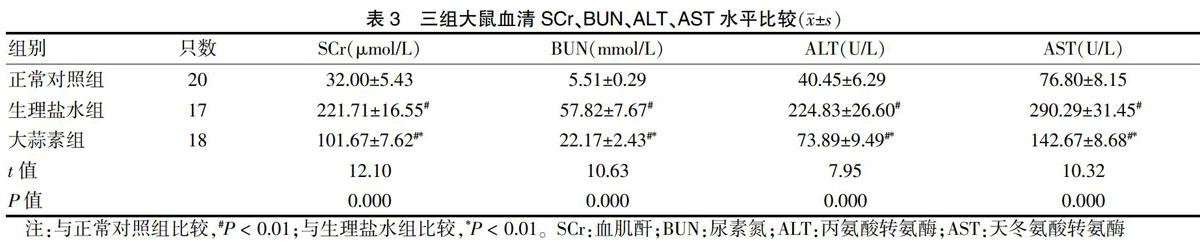
2.3 脏器功能
与正常对照组比较,热打击及运动处理后,大蒜素组及生盐理水组大鼠血清SCr、BUN、ALT、AST含量水平显著升高,差异有高度统计学意义(P < 0.01);大蒜素组各指标均低于生理盐水组,差异有高度统计学意义(P < 0.01)。见表3。
3 讨论
在高温、高湿环境下,大强度运动通常会抑制机体的免疫力,对机体的反应是一种病理性损伤,会造成短暂的疲劳积累和肌肉损伤,刺激机体促炎性因子IL-1β、TNF-α的释放[4]。TNF-α、IL-6、IL-17、hs-CRP是与热射病患者炎性反应激活密切相关的炎症细胞因子[5]。因此,运动及热打击后大鼠血清中hs-CRP、IL-17、IL-1β、TNF-α含量水平较正常对照组显著升高。hs-CRP其功能特点与机体的炎症和创伤反应密切相关,又被称为炎症标志物,一定程度上可反映体内炎症程度[6]。IL-17是由Th17分泌的细胞因子,能够造成组织发生炎症性损伤[7];TNF-α是炎性反应早期重要的促炎细胞因子,可激活细胞因子级联反应,诱导IL-lβ、IL-6、IL-8等其他炎症介质合成,若未进行干预可导致炎性反应失控,甚至爆发“细胞因子/炎症介质风暴”,最终引起组织损伤,器官功能受损,导致重症中暑的发生。由此可见,对IL-17、IL-1β、TNF-α释放过程进行干预,可有效降低重症中暑发生率。
在热打击过程中,机体通过汗液蒸发散热而丢失大量体液,使水、电解质代谢紊乱,加之高温环境下体内氧运输障碍,出现广泛的脂质过氧化反应,造成机体SOD活性降低,MDA含量升高[8]。剧烈运动使机体代谢异常,高代谢状态导致活性氧(ROS)合成增加并激发氧化应激反应,导致氧化代谢产物如AOPPs合成增多,抗氧化物质SOD、谷胱甘肽过氧化物酶(GSH-Px)消耗加剧,最终形成氧化/抗氧化失衡,SOD降低[9-10]。所以,运动及热打击处理后,大鼠血清MDA、AOPPs含量水平较正常对照组显著升高,而SOD显著降低。T-AOC主要是机体防御系统非酶促体系抗氧化物质和酶促体系小分子量抗氧化物质的总和[11],其可有力地清除机体的活性氧自由基,是抗氧化系统的综合性指标[12]。血清T-AOC含量水平降低,说明机體抗氧化能力降低。
高温、高湿可致体温调节功能的障碍,导致高热的产生,而足够的热暴露可以导致蛋白变性,细胞膜的完整性、细胞骨架及细胞核的损伤,最终导致细胞死亡[13]。人体在高体温的情况下,为了让体核温度保持稳定,机体就会通过出汗来散热,随着机体排汗量的增大和水分的丢失,某些电解质成分也会随之排出体外,使具有重要生理作用的金属离子如Na+、K+、Cl-等缺失,会使细胞中一系列生理活动如生物信号转导、能量代谢、细胞运动等严重紊乱,导致内环境急剧恶化,器官及组织不能正常代谢,从而导致机体内环境失衡,代谢产物堆积及酸中毒,进一步加重组织及内环境失衡,造成恶性循环,引起重症中暑,甚至并发MODS,导致大鼠血清中SCr、BUN、ALT、AST含量水平升高。所以,热打击及运动处理后,大鼠血清SCr、BUN、ALT、AST含量水平较正常对照组显著升高。
大蒜素是从蒜的球形鳞茎中提取的挥发性油状物,其中的三硫代烯丙醚类化合物,是大蒜发挥其药理学特性的主要有效成分[14]。研究表明,大蒜素具有多种生物学功能,可抑制炎性介质和细胞因子的释放,能有效增加细胞中谷胱甘肽水平达到抗氧化作用[15],可以抑制真菌、细菌生长,调节血压、血糖、血脂,具有抗肿瘤活性、抗血小板凝集,以及调节机体免疫活动作用[16-18],还可以通过增强体内超氧化物歧化酶的活性,阻碍心肌细胞的凋亡,从而达到抗心肌细胞的缺血性再灌注损伤的作用[19-21]。本研究结果提示,大蒜素通过抗炎作用达到降低重症中暑大鼠血清炎性因子水平;并通过机体自身调节增加SOD、T-AOC活力,降低过氧化脂质水平,减少MDA生产和释放。由此说明,大蒜素通过抗炎作用、抗氧化损伤等,达到降低重症中暑大鼠血清IL-17、IL-1β、TNF-α、hs-CRP、MDA、AOPPs和升高SOD、T-AOC的含量水平,减少或降低机体中暑导致的过度炎性及过氧化反应引起的细胞损伤,达到保护脏器功能的目的。
综上所述,热打击及运动处理后,大鼠血清炎性因子产生和释放增加和脂质过氧化水平提高。大蒜素可通过降低重症中暑大鼠血清炎性因子的产生和释放及脂质过氧化水平,达到保护脏器功能的作用。
[参考文献]
[1] 苏磊,童华生.重症中暑转化医学研究回顾与展望[J].解放军医学杂志,2017,42(2):103-108.
[2] 姜利勇.血必净注射液治疗重症中暑的效果分析[J].河南医学研究,2018,27(14):2630-2631.
[3] 胡铭,李明强.大蒜素药理作用及药用制剂研究进展[J].现代医药卫生,2017,33(18):2799-2801.
[4] 何晓玲,邹凌云,曹瑶,等.不同强度有氧运动对乳腺癌大鼠癌因性疲乏及血清IL-6、TNF-α、IL-1β水平的影响[J].中国康复医学杂志,2015,30(9):872-876.
[5] King MA,Leon LR,Morse DA,et al. Unique cytokine and chemokine responses to exerrtional heat stroke in mice [J]. J Appl Physiol,2017,122(2):296-306.
[6] 胡玉艳,姜华,张晓明,等.乌司他丁对劳力型热射病患者血清IL-17、hs-CRP、cTnI、β2-MG及MODS的影响[J].河南医学研究,2015,24(2):10-12.
[7] 刘健,顾叶华,龚健.血必净联合早期持续肾脏替代治疗对热射病患者全身炎性反应及肾能损害的影响[J].海南医学院学报,2017,23(18):2464-2467.
[8] 李亚洁,王影,翟惠敏,等.复合营养素干预对湿热复合创伤应激大鼠脂质过氧化反应的影响[J].中国危重病急救医学,2004,16(1):52-53.
[9] Vi?觡a J,Gomez-Cabrera MC,Lloret A,et al. Free radicals in exhaustive physical exercise:mechanism of production,and protection by antioxidants [J]. Iubmb Life,2000,50(4-5):271-277.
[10] McAllister MJ,Basham SA,Smith JW,et al. Effects of environmental heat and antioxidant ingestion on blood markers of oxidative stress in professional firefighters performing structural fire exercises [J]. J Occup Environ Med,2018,60(11):595-601.
[11] Gr?觡bner W,Walter SI. Treatment or hyperuricemia and gout [J]. Med Monatsschr Pharm,2005,28(5):159-164.
[12] Krishnan E. Hyperuricemia and incident heart failure [J]. Circ Heart Fail,2009,2(6):556-562.
[13] 榮鹏,孟建中,陈宇.热射病的发病机制及防治策略的研究新进展[J].生物医学工程研究,2001,29(4):287-292.
[14] 吕玉娟,车慧欣,于利,等.大蒜素对青光眼滤过术后兔眼滤过泡瘢痕化的抑制作用[J].眼科新进展,2018,38(7):625-629.
[15] 彭敏.大蒜素药理学作用机制及研究进展[J].现代中西医结合杂志,2018,27(14):1593-1596.
[16] 杨军岭,杨侠.大蒜素对6-羟多巴胺所致PCI2细胞损伤的保护作用及机制[J].中华神经外科疾病研究杂志, 2015,14(3):208-212.
[17] 曹成章,胡树桥,赖海银,等.大蒜素与化疗药物对食管癌细胞EC109疗效比较的实验研究[J].中国病理生理杂志,2017,33(10):1845-1851.
[18] 于亦鸣,钟斌诚,何茜,等.大蒜素对小细胞肺癌A549细胞增殖、迁移能力及凋亡的影响[J].临床和实验医学杂志,2017,16(18):1776-1779.
[19] 刘芳,乔蕾,陈文超,等.大蒜素后处理对大鼠心肌缺血-再灌注损伤的保护作用[J].山东大学学报:医学版, 2017,55(7):6-10.
[20] 李辉,赵锴,王磊.大蒜素抑制H2O2诱导的心肌细胞凋亡的实验研究[J].现代预防医学,2016,43(6):1097-1101.
[21] 乔蕾,武秋林,孔春艳,等.大蒜素后处理对大鼠心肌缺血-再灌注损伤的影响[J].郑州大学学报:医学版,2018,53(5):595-598.

