皂荚和美国肥皂荚多糖胶的制备及性质比较
琚斯怡, 郭常酉, 朱妙馨, 刘彦涛, 蒋建新*
(1.北京林业大学 材料科学与技术学院;林业生物质材料与能源教育部工程研究中心, 北京 100083;2.宁夏大学 化学化工学院, 宁夏 银川 750021)
皂荚(GleditsiasinensisLam.)为豆科多年生木本植物[1],主要分布在温带与亚热带,平原、丘陵和山区都能生长,具有复杂的多种多样的生态属性,且根系发达,具有耐旱、节水、耐寒、固氮和抗病虫害等优点,是营造水土保持林和防风固沙林的优良生态树种之一[2]。美国肥皂荚(Gymnocladusdioicus(L.) K.Koch)为豆科肥皂荚属落叶乔木,原产美国中部和东部,能适应广泛的土壤环境,耐寒抗旱,病虫害少,多作园林绿化和防护林树种栽植。皂荚和美国肥皂荚是理想的木本植物多糖胶原料资源,其种子中含有丰富的多糖,可以从种子胚乳分离提取得到多糖胶。皂荚多糖胶的1%水溶液在表观黏度、自然抗生物降解能力、稳定性等方面优于瓜尔胶,可作为增稠剂、黏合剂、稳定剂等应用于食品、石油、造纸、印染和选矿等多种工业中[3]。近年来,皂荚多糖胶资源的开发利用受到国内外学者的普遍关注和重视[4-6]。由于美国肥皂荚的种子相较于皂荚非常饱满,且有关美国肥皂荚多糖胶的研究较为少见,因此,本研究选择皂荚和美国肥皂荚2种皂荚作为原料,采用光波烘烤对原料进行预处理,机械分离法结合微水固相制备2种多糖胶,探究烘烤时间对多糖胶表观黏度和组分的影响,以期为皂荚多糖胶的应用研究提供基础数据。
1 实 验
1.1 材料与仪器
皂荚和美国肥皂荚,2017年11月摘自北京林业大学校园,将皂荚种子保存在阴凉干燥处,备用。皂荚种子含水率为10.66%,美国肥皂荚种子含水率为9.83%。D-(+)-半乳糖和D-(+)-甘露糖标准品,购于美国Sigma-Aldrich公司。无水乙醇、丙酮、无水乙醚、浓硫酸、无水碳酸钙,均为市售分析纯。
SKD-200型自动凯氏定氮仪、 SKD- 08S2型红外智能消化炉,上海沛欧分析仪器有限公司; L-550台式低速离心机;FW100高速万能粉碎机;格兰仕微波炉;电热鼓风干燥机;LVDV-III Ultra型流变仪(配备有一个小样本适配器SC13R,使用SC4-31号转子),美国Brookfield公司;Agilent 1260型高效液相色谱(HPLC)仪,美国Agilent公司。
1.2 皂荚多糖胶的制备及提纯
1.2.1光波烘烤法制多糖胶原胶粉 参考文献[7]制备方法,采用光波烘烤法对皂荚和美国肥皂荚进行预处理。具体操作如下:将100 g种子放入微波炉中,光波照射烘烤不同的时间(4、6或8 min)后,立即将其使用高速万能粉碎机迅速(时间不超过3 s)分离成种皮、胚乳和胚3部分,筛选得到胚乳片。烘烤4、6和8 min得皂荚多糖胶胚乳片得率分别为(35.54±0.16)%、(33.84±0.21)%和(33.74±0.19)%,烘烤4、6和8 min得到美国肥皂荚多糖胶的胚乳片得率分别为(41.21±0.42)%、(38.39±0.55)%和(38.65±0.75)%。将胚乳以微水固相[8]的方法按固液比1∶1(g∶mL)加入100 mL去离子水,40 ℃恒温水浴并适当搅拌至水合完全,此时胚乳吸水润胀后比表面积增大,便于对其用三辊机进行压片,破壁增黏。随后50 ℃下烘干,粉碎制粉,过筛,选取粒径≤0.154 mm样品在80 ℃下烘干5 h平衡水分得到多糖胶原胶粉,用于后续实验。
1.2.2多糖胶的纯化 参考文献中的方法[9-10],准确称取3.0 g多糖胶原胶粉于500 mL去离子水中,磁力搅拌3 h溶解得到多糖胶液。冷却至室温后离心,取上清液,向上清液中加入500 mL无水乙醇得到多糖沉淀,静置过夜。将其离心分离得到固体沉淀,沉淀依次用无水乙醇、丙酮和无水乙醚洗涤 3次,3 000 r/min下离心15 min,并回收溶剂。脱水后的固体沉淀进行真空干燥,研磨至粒径≤0.154 mm,得到纯化后的多糖胶粉,用于分析和表征。
1.3 产物分析与表征
1.3.1表观黏度测定 精确称取0.500 g多糖胶原胶粉,用1.5 mL乙醇分散,加入去离子水配成质量分数为1%的胶液,在80 ℃恒温水浴中磁力搅拌30 min,使胶液均匀分散,然后在室温下静置2.5 h使其冷却并充分水合。用流变仪在30 ℃条件下测定2种皂荚多糖胶液在不同剪切速率下的黏度。
为研究皂荚多糖胶的流变性能,采用Power-Law流体模型[11]对多糖胶液流变曲线进行拟合:
τ=k·Dn
(1)
式中:τ—剪切应力,Pa;k—稠度指数,Pa·sn;D—剪切速率,s-1;n—流动指数,无量纲。
1.3.2蛋白质含量的测定 根据Kjeldah[8]的方法,分别测定2种皂荚多糖胶粉中的蛋白质含量。
1.3.3水不溶物的测定 分别称取1.0 g多糖胶粉,用3 mL乙醇分散,然后加水至200 g配制成质量分数0.5%的胶液。30 ℃下磁力搅拌3 h,使胶液均匀分散。准确称取50 g分散后的胶液, 3 000 r/min转速下离心30 min,倒出上层清液,加水至50 g,洗涤、搅匀、离心15 min,重复操作2次。最后将水不溶性的残余物置于105 ℃烘箱中,直至质量恒定。
1.3.4半乳糖及甘露糖含量测定 采用硫酸水解法[12]对多糖胶粉进行水解,使用HPLC测定水解液中甘露糖和半乳糖的含量,从而得到多糖胶中半乳甘露聚糖的含量,根据式(2)计算甘露糖/半乳糖的质量比(M/G)值及半乳甘露聚糖的质量分数(y,%)。所有的测定至少进行3次,取平均值。
y= (ρ×V×0.9)/m× 100%
(2)
式中:ρ—液相测得水解液中半乳糖(甘露糖)的质量浓度,g/L;V—水解液体积,L; 0.9—脱水校正系数(162/180);m—原料绝干质量,g。
HPLC为Agilent 1260型系统,配备有Aminex HPX-87P柱子(300 mm×7.8 mm,Bio-Rad公司)和G4260型ELSD蒸发光散射检测器。色谱条件:柱温75 ℃,检测器蒸发温度50 ℃,雾化温度80 ℃,进样量5 μL,流动相为双蒸水,流速0.6 mL/min。
2 结果与讨论
2.1 流变特性
光波烘烤预处理不同时间后,2种皂荚多糖胶液的表观黏度随剪切速率的变化曲线如图1所示。应用Power-Law模型[11]计算得到的多糖胶的流变性能列于表1。

图1 皂荚(a)和美国肥皂荚(b)多糖胶水溶液的黏度变化曲线
由图1可知,随着剪切速率的增加,皂荚和美国肥皂荚多糖胶水溶液的表观黏度均呈下降趋势。对于皂荚,经过不同时长的光波烘烤预处理所得多糖胶液的表观黏度差异不大,烘烤6 min所得胶液的黏度稍高。而对于美国肥皂荚而言,烘烤6 min比4 min所得胶液的表观黏度大,但是烘烤8 min胶液的黏度没有继续增加,反而有所下降。这可能是因为短时间(4 min)烘烤预处理种子脱壳不完全,胚乳分离不彻底,胶粉纯度不够高,从而导致较低的表观黏度;而较长时间(8 min)的烘烤预处理会使胶片过度熟化,多糖结构受到一定程度的破坏,从而发生表观黏度的下降。
用稠度指数(k)来表征液体的表观黏度,k值越大,表观黏度越大。由表1中k值可知,随着光波烘烤时间的增长,皂荚和美国肥皂荚多糖胶的表观黏度均呈先增大后减小的趋势,这一规律与文献[7]中烘炒时间对皂荚多糖胶黏度的影响是类似的。另外,流动指数(n)可显示流体在一定流速范围内的非牛顿性程度,n<1时,即为假塑性流体。从表1数据看出,2种皂荚多糖胶的水溶液均为假塑性流体,溶液表观黏度随剪切速率的增加而降低(剪切稀释),这与其他研究[13-14]中观察到多糖胶的流变现象是一致的。对2种皂荚多糖胶来说,烘烤6 min预处理得到的多糖胶液的假塑性程度最强(n偏离1的程度最大)。6 min烘烤预处理的皂荚和美国肥皂荚多糖胶在剪切速率5.1 s-1下的表观黏度分别为461.90和703.85 mPa·s。
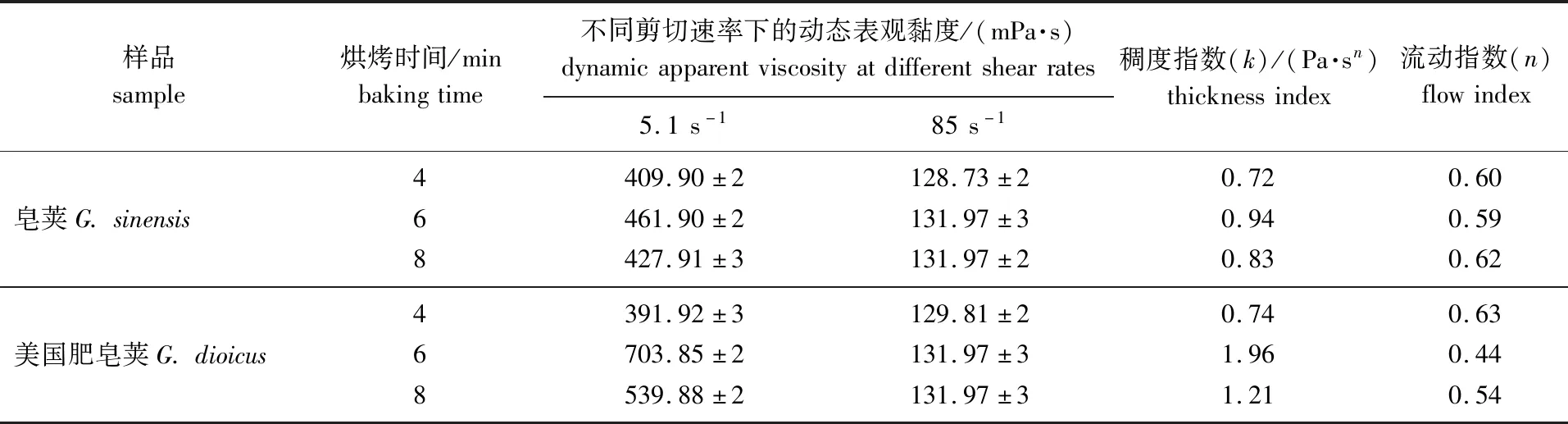
表1 不同皂荚多糖胶的流变参数
2.2 皂荚多糖胶的组分
2.2.1蛋白质 蛋白质是多糖胶重要的组成成分之一,其含量对多糖胶的各个方面都有重要影响,如在对多糖进行改性应用时,蛋白质会参与改性,导致产品的纯度降低而影响产品性能。皂荚属植物种子的胚主要由蛋白质组成,其占种子总蛋白质质量的70%[15],而种皮中几乎不含蛋白质。皂荚和美国肥皂荚多糖胶经过光波烘烤预处理4、6、8 min后所含蛋白质如表2所示。从表2可见,皂荚多糖胶的蛋白质含量随着预处理时间延长而增加,这是因为烘烤时间影响种皮的脱除,烘烤4 min后种皮有明显残留,因此导致了蛋白质测量值较低;而烘烤6和8 min,种皮只有极少量残留,因此测得蛋白质含量会较高且2者接近。而美国肥皂荚多糖胶,烘烤不同时间后蛋白质的含量基本不变且在烘烤时间6或8 min 时低于皂荚多糖胶,可能是由于美国肥皂荚胚乳片较薄,种皮残留也比皂荚少,容易受到高温的影响发生理化性质的变化,从而使测得的蛋白质含量降低。

表2 不同烘烤时间下2种皂荚多糖胶的组分
2.2.2水不溶物 多糖胶中的水不溶物主要包括灰分、未脱除完全的种壳中的纤维素以及水不溶性多糖等,这些水不溶物的存在会影响产品的颜色尤其是透明度,从而影响消费者对产品的接受程度。不同烘烤时间预处理得到的皂荚和美国肥皂荚多糖胶的水不溶物含量亦见表2。从表中可以看出,随烘烤时间的增加皂荚多糖胶的水不溶物含量先增加后减少,而美国肥皂荚多糖胶的趋势则相反,即水不溶物含量随烘烤时间延长先减少后增加;4和6 min预处理条件下的皂荚多糖胶的水不溶物含量均高于美国肥皂荚多糖胶,而8 min条件下却低于美国肥皂荚多糖胶。这是因为长时间高温烘烤时,多糖发生降解,相对分子质量小的水溶性多糖降解生成水不溶物,水不溶物含量相对升高;相对分子质量大的水不溶性多糖降解,除了水不溶物,部分成为水溶性多糖,从而使水不溶物含量相对降低。美国肥皂荚胶中,相对分子质量小的水溶性多糖降解表现更明显;而在皂荚胶中,相对分子质量大的水不溶性多糖降解表现更明显,导致了8 min预处理条件下皂荚多糖胶的水不溶物含量低于美国肥皂荚多糖胶。
2.2.3半乳甘露聚糖 烘烤不同时间预处理后得到的皂荚多糖胶和美国肥皂荚多糖胶的半乳甘露聚糖含量和M/G值如表3所示。
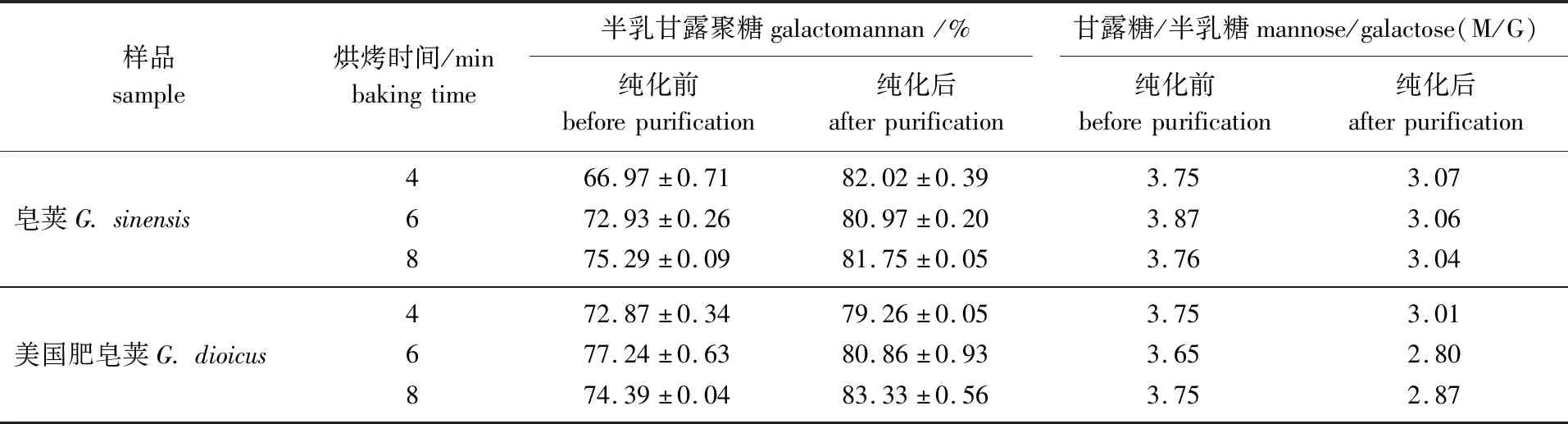
表3 不同烘烤时间下2种皂荚多糖胶中的糖
从表中可以看出,纯化前的皂荚多糖胶中,随着光波烘烤预处理时间的延长半乳甘露聚糖含量提高。这是因为4 min烘烤预处理后种子种壳不易脱除,杂质多;而6和8 min烘烤后种壳脱除更完全,杂质更少,因此得到的半乳甘露聚糖含量也更高。美国肥皂荚,烘烤8 min预处理得到的半乳甘露聚糖的含量低于6 min,这可能是美国肥皂荚对高温更敏感,分解程度更大,部分分解得到的相对分子质量小的半乳甘露聚糖胶未收集到。此外,从表中可以看出相较于纯化前,纯化后的半乳甘露聚糖质量分数明显提高,均在80%左右;纯化后的M/G值明显低于纯化前的,均在3.0左右,接近商用塔拉胶(M/G值为3)[16]。Jian等[17]对皂荚进行烘烤预处理及纯化后得到的多糖胶中半乳甘露聚糖质量分数为36.3%,M/G值为4.5,与本研究中得到的值相差较大,不同的多糖纯化方法以及植物的生长条件和经历的过程可能是出现这种差异的原因[17]。
3 结 论
3.1以皂荚和美国肥皂荚为原料,先经光波烘烤预处理,然后机械分离后通过微水固相法制皂荚多糖胶,结果显示:随着光波烘烤时间的增长,2种多糖胶的表现黏度均先增大后减,烘烤6 min后,2种皂荚多糖胶的表观黏度均为最高值,在剪切速率5.1 s-1条件下分别为461.90和703.85 mPa·s;光波烘烤4、6和8 min的2种多糖胶水溶液的表观黏度均随着剪切速率的增加而降低,且流动指数均小于1,表明它们具有假塑性。
3.2随烘烤时间增加,皂荚多糖胶中的蛋白质质量分数变大,烘烤8 min时可达4.66%,而美国肥皂荚多糖胶中的蛋白质几乎不变,均在4.08%;多糖胶中水不溶物含量有所变化,8 min烘烤皂荚多糖胶中含水不溶物最低,约32.30%,而美国肥皂荚6 min烘烤后制得的多糖胶中水不溶物最低,约32.50%。纯化前的原多糖胶中,皂荚随着光波烘烤预处理时间的延长,半乳甘露聚糖含量也提高;而对美国肥皂荚,8 min烘烤预处理时半乳甘露聚糖的含量低于6 min。纯化后的多糖胶中半乳甘露聚糖质量分数(79%~83%)普遍明显高于原多糖胶中半乳甘露聚糖质量分数(67%~77%),纯化后的多糖胶中甘露糖/半乳糖(M/G)值在3.0左右,明显低于原多糖胶中M/G值(3.7左右)。

