高油酸花生新品种宇花91的选育
潘雷雷,姜亚男,周文杰,姜平平,吴兰荣,陈傲,朱虹,隋炯明,王晶珊,乔利仙
高油酸花生新品种宇花91的选育
潘雷雷1,2,姜亚男1,周文杰1,姜平平1,2,吴兰荣3,陈傲4,朱虹1,隋炯明1,王晶珊1,乔利仙1
1 青岛农业大学 农学院 山东省旱作农业技术重点实验室,山东 青岛 266109 2 青岛农业大学 生命科学学院山东省高校植物生物技术重点实验室,山东 青岛 266109 3 青岛市种子站,山东 青岛 266071 4 湛江市农业科学研究院,广东 湛江 524094
宇花91是青岛农业大学选育的高油酸花生新品种。以普通油酸含量品种鲁花11号为母本,F435型高油酸花生品种开农1715为父本配置杂交组合。利用PCR产物测序法筛选获得F1代真杂种,对F2代单株提取叶片基因组DNA,利用PCR产物测序法筛选基因型纯合的单株个体。对当代收获的单株籽粒利用近红外法多粒模型测定油酸、亚油酸含量,筛选油酸含量在80%以上且油酸亚油酸比值在10.0以上的单株种植成株行,随后利用系谱法进行选择育种。宇花91荚果为普通型小果,网纹较细、较明显,百果重148.06 g,百仁重63.31 g,果皮薄,出米率75.15%。籽仁长椭圆形,种皮粉红色、无裂纹,内种皮白色。籽仁蛋白质含量26.57%,脂肪含量52.72%,油酸含量80.40%,亚油酸含量2.50%,棕榈酸含量5.57%,油酸亚油酸比值32.16。苗期生长旺盛,封垄早,结果集中,中抗叶斑病和青枯病。2017年参加山东省夏播多点试验,平均荚果产量215.79 kg/667 m2,比对照花育20号增产15.27%;平均籽仁产量157.33 kg/667 m2,比对照花育20号增产21.64%。2018年通过国家花生品种登记,登记号:GPD花生 (2018) 370210,适于在山东花生产区种植。
花生,高油酸,宇花91,F435,标记辅助选择
花生是重要的食用植物油和蛋白质来源,普通花生籽仁主要含有8种脂肪酸,油酸含量一般为40%–50%,亚油酸含量30%–40%,棕榈酸含量10%–12%[1-2],这3种脂肪酸约占到总脂肪酸含量的92%[3]。
高油酸花生则是指油酸含量在70%以上,亚油酸含量低于7.7%,油酸亚油酸比值大于等于10[4-6],同时棕榈酸含量可降至5%–7%。油酸含量高低是评价植物油品质的重要指标,油酸含量越高,抗氧化能力越强,不易变质而利于储存,可延长货架寿命[1-2,4]。同时高油酸可以有选择性地降低对人体健康有害的低密度胆固醇 (Low-density lipoprotein,LDL),同时不破坏对人体有利的高密度胆固醇 (High-density lipoprotein,HDL),从而减缓动脉粥样硬化,有效预防冠心病等心脑血管疾病的发生,具有非常重要的保健功能与价值[1-2,4]。高油酸花生已成为国际社会花生生产国的主要育种目标[7-8],我国的高油酸花生育种起步较晚,目前总体数量有限,而且产量潜力和综合抗性水平有待进一步提升[9]。因此尽快选育高油酸花生新品种已经成为目前我国花生品质改良育种的重要目标。
目前,在花生中广泛应用的高油酸突变材料为F435型突变体[10],包含ahFAD2A的ORF-448 bp G/A替换和ahFAD2B的ORF-441_442的“A”插入,结果导致FAD2酶部分或全部失活,阻碍了油酸向亚油酸的转化过程而产生了高油酸性状[10-11]。徐平丽等[12]将RNAi干扰载体转入花生,发现转基因植株种子中FAD2基因转录水平下调,花生籽粒油酸含量显著提高,亚油酸含量显著下降。刘华等[13]研究发现在高油酸花生突变体种子中FAD2B的表达量显著低于FAD2A,推测花生中FAD2B表达量降低利于提高油酸含量。开农1715为河南省开封市农林科学研究院选育的F435型高油酸花生品种,同时含有AhFAD2a、AhFAD2b基因位点,油酸含量75.60%,亚油酸含量7.55%,油酸亚油酸O/L比值为10.88[14]。鲁花11号为山东省主要栽培的大花生品种,油酸含量55%,油酸亚油酸O/L比值大于2.0[15]。本研究以鲁花11号为母本,开农1715为父本配置杂交组合,利用PCR产物测序法检测筛选F1代真杂种及F2代基因型纯合的单株个体。随后利用系谱法进行选育,并利用近红外扫描分析法及气相色谱法测定油酸含量筛选表型,最终选育到小果型高油酸花生新品种宇花91。
1 材料与方法
1.1 试验材料
1.1.1 植物材料
普通花生品种鲁花11号,油酸含量55%,由青岛农业大学农学院花生研究中心保存。高油酸花生品种开农1715,油酸含量75.60%,由河南省农业科学院经济作物研究所黄冰艳博士提供。
1.1.2 PCR扩增引物
使用引物对F0.7/R3同时对FAD2A/2a和FAD2B/2b位点进行扩增[16],扩增产物测序后可通过读测序峰图得知在这两个位点的碱基序列,进而判断基因型,用于对两个杂交亲本的基因型检测。使用引物bF19/1056R对FAD2B/2b位点进行PCR扩增[17],对杂交后代B位点进行鉴定和选择。引物序列及相应扩增产物大小列于表1。
1.2 试验方法
1.2.1 亲本基因型鉴定
由于FAD2A/2a位点中“A”和“a”普遍存在于非高油酸含量的栽培种花生中,而且有时以杂合状态存在,故在杂交之前需要首先鉴定亲本的基因型。采用SDS法提取亲本鲁花11号及开农1715基因组DNA,利用F0.7/R3 引物对进行扩增[16]。反应体系及扩增条件参照于明洋的方法[1]。总反应体积25 μL,包括DNA模板20 ng,10×PCR缓冲液2.5 μL,dNTPs (10 mmol/L) 2 μL,正反向引物(10 μmol/L)各1 μL,DNA polymerase (5 U/L) 0.5 μL。扩增程序为:94 ℃ 5 min;94 ℃ 30 s,61 ℃ 40 s,72 ℃ 50 s,33个循环;72 ℃ 10 min。扩增产物送生工生物工程 (上海) 股份有限公司进行测序检测变异位点的碱基序列,确定亲本基因型。
1.2.2 杂交及F1、F2分子标记辅助选择
2013年5月播种父母本材料于花生杂交池,以鲁花11号为母本、开农1715为父本杂交;9月收获F1杂交种,切取远胚端小片子叶 (约10 mg) 提取基因组DNA[18],利用bF19/1056R引物进行PCR扩增[17]。反应总体积20 μL,含模板DNA 2 μL,10×PCR缓冲液2 μL、dNTPs (各4 pmol)、引物(各50 ng)、酶1 U。PCR循环参数为:94 ℃ 1.5 min,30个循环(94 ℃ 30 s,56 ℃ 30 s,72 ℃ 60 s),72 ℃ 5 min。扩增产物送生工生物工程 (上海) 股份有限公司进行测序,选择基因型为Bb的F1真杂种;2013年冬季播种F1于海南省三亚市繁殖,得到F2,2014年3月收获后,按同样方法进行测序验证基因型,筛选基因型为bb的F2籽粒。

表1 用于扩增FAD2A/2B及FAD2B/2b位点的引物及其序列
1.2.3 F3代表型选择
2014年5月将筛选获得的基因型为bb的F2籽粒播种于青岛农业大学试验农场,单株收获得到F3。利用BRUKER Matrlx-1近红外光谱仪扫描测定光谱[19],并用多粒混合模型分析确定每一单株油酸含量、亚油酸含量,计算油酸/亚油酸比值。筛选油酸含量在80%以上且油酸/亚油酸比值大于10的单株。
1.2.4 系谱法选育
2014年冬季海南种植F3,选择优良单株收获得到F4;2015年青岛种植F4,除继续选择优良单株外,对农艺性状表现较好的株行淘汰不良单株及差异较大单株后混收成F5株系;2015年海南冬季繁殖加代获得F6;2016年青岛进行DUS测试及产量鉴定,筛选到1个高产株系,命名为宇花91。
1.2.5 DUS测试及产量比较
2017年委托农业部植物新品种测试 (济南)分中心进行DUS测试,并送山东省花生新品种登记试验组进行多点比较试验。当年收获后送农业部油料及制品质量监督检验测试中心 (武汉) 进行脂肪酸含量的精确测定。
2 结果与分析
2.1 亲本基因型鉴定
FAD2A/2a以及FAD2B/2b基因序列见表2。对亲本鲁花11号及开农1715测序结果表明,鲁花11号在FAD2B/2b位点未检测到插入的AA位点,为FAD2B/2B纯合型BB;在FAD2A/2a位点检测到纯合的AA突变位点[16],为FAD2a/2a纯合型aa (图1A)。开农1715在FAD2B/2b位点检测到纯合的插入位点AA,在FAD2A/2a位点检测到纯合的AA突变位点 (图1B),其基因型为纯合aabb位点。
2.2 杂交种F1代及自交F2代基因型检测
由于两个杂交亲本在FAD2A/2a位点均为纯合,故只需对FAD2B/2b位点进行检测鉴定。以杂交种F1基因组DNA为模板,利用bF19/1056R 引物对进行PCR扩增[17]。假杂种基因型与母本鲁花11号相同,FAD2B/2b位点显性纯合BB;真杂种基因型为Bb,测序峰图显示结果如图2所示。自交F2代应分离出BB,Bb以及bb基因型。

图1 杂交亲本鲁花11号和开农1715在FAD2位点的测序结果

表2 FAD2A/2a以及FAD2B/2b基因序列
Note: Mutant base was displayed in underline.
2.3 F3代单株表型选择
由于PCR扩增存在一定比例的假阳性,所以并不能保证F2代个体的基因型检测准确无误。因此对F2代单株所收获的F3代单株籽粒进行了近红外扫描,测定了油酸、亚油酸含量,并筛选出油酸含量在80%以上的单株。如表3所示,来源于F2代单株Q3-F2-1、Q3-F2-2、Q3-F2-3、Q3-F2-4、Q3-F2-6、Q3-F2-8的后代F3代单株,油酸含量均在75%以上,油酸/亚油酸比值均在7.0以上。说明F2代单株基因型检测均正确无误,如果F2代单株基因型检测有误,则F3代会出现明显的分离,不同单株之间的油酸含量应该会表现高油酸含量与低油酸含量的明显分离。

图2 F1真杂种测序结果
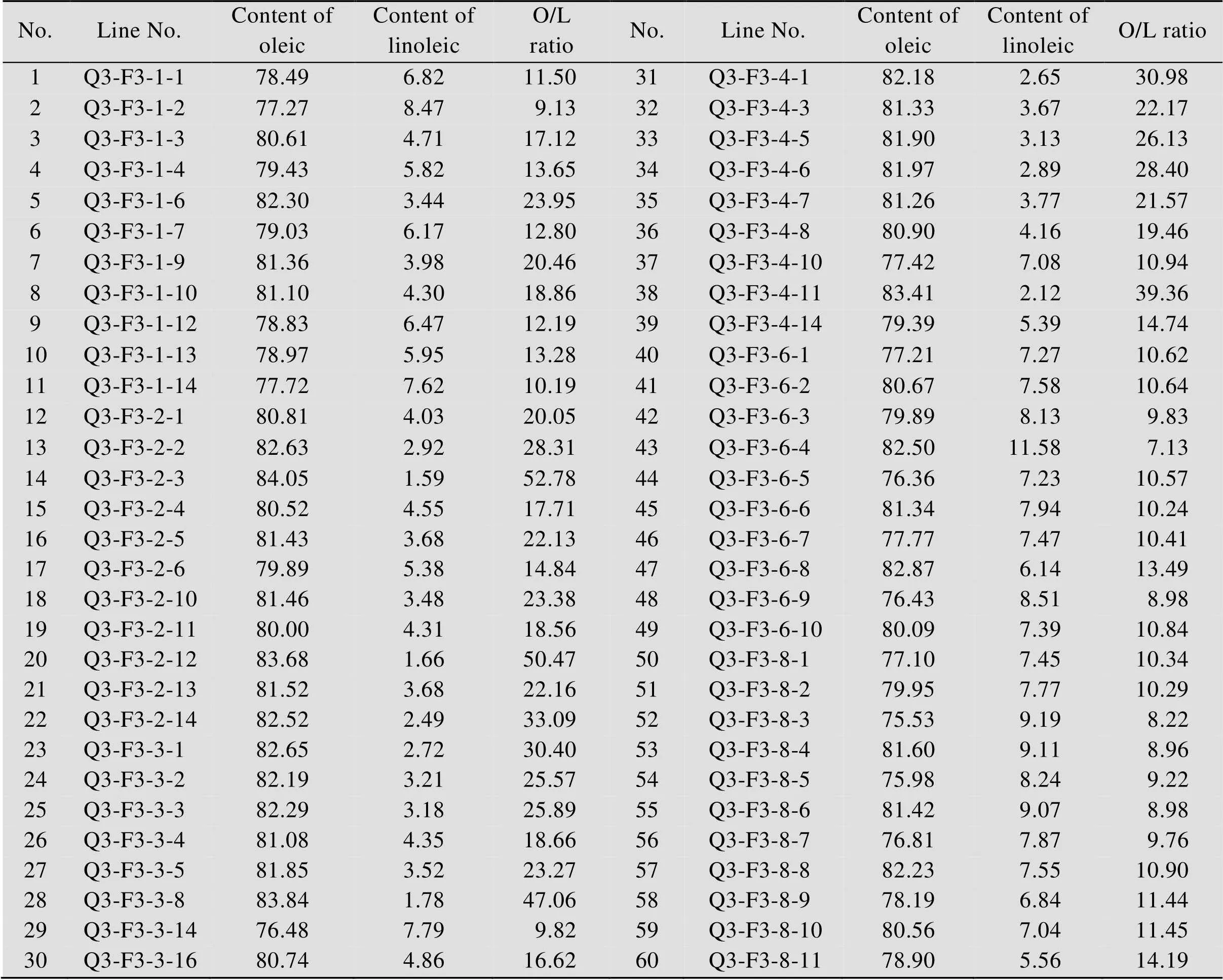
表3 F3代单株油酸、亚油酸含量的近红外分析结果
Note: in order to save space, the acid in this table has been omitted.
2.4 初选获得宇花91
宇花91最初来源于F4代筛选获得一个小果单株,在F5代株行基本稳定无明显分离,即混收成株系 (图3)。2016年青岛鉴定及2017年农业部植物新品种测试 (济南) 分中心DUS测试结果表明该材料具有新品种所具有的特异性、一致性和稳定性 (测试编号JN17HS0005A,测试标准NY/T 2237-2012花生)。经农业部油料及制品质量监督检测测试中心 (武汉) 检测(表4),油酸含量80.40%,亚油酸含量2.50%,油酸/亚油酸比值32.16。完全符合国际上高油酸花生标准 (油酸≥75%以上,油酸/亚油酸为比值≥10.00)[4]。棕榈酸含量5.57%,远低于普通花生品种中棕榈酸含量约为9%–10%的范围。
2.5 宇花91品种特点
宇花91荚果为普通型小果,网纹较细、较明显 (图3),百果重148.06 g,百仁重63.31 g,果皮薄,出米率75.15%。籽仁长椭圆形,种皮粉红色、无裂纹,内种皮白色。籽仁蛋白质含量26.57%,脂肪含量52.72%,油酸含量80.40%,亚油酸含量2.50%,棕榈酸含量5.57%,油酸亚油酸比值32.16。苗期生长旺盛,封垄早,结果集中,中抗叶斑病和青枯病。2017年参加山东省夏播多点试验,平均荚果产量215.79 kg/667 m2,比对照花育20号增产15.12%;平均籽仁产量157.33 kg/667 m2,比对照花育20号增产21.66 % (表5)。2018年通过国家花生品种登记,登记号为GPD花生 (2018) 370210,适于在山东花生产区种植。2018在平度繁种试验田实收358.85 kg/667 m2。
3 讨论
高油酸花生因其具有较强的抗氧化性,以及对心脑血管疾病的延缓和预防作用而备受关注和青睐,成为目前国内外花生育种的重要目标和方向[20]。我国高油酸花生虽然起步较晚,但是发展较快,目前已登记品种约80多个,大部分为F435型位点突变。目前针对F435型开发的分子标记检测方法有基于特异引物扩增的AS-PCR法[21-22]、基于酶切片段差异的CAPS检测法[23]、基于RT-PCR技术的Man探针法[24]、基于PCR扩增产物测序法[2,25]以及基于高通量分析的竞争特异性等位基因PCR (KASP) 检测法[26]。如此多样而有效的分子标记辅助选择为高油酸育种的快速选育提供了有效的方法和技术,尤其KASP技术因其具有低成本和高通量的优势特点,适于在育种上广泛使用。基于近红外技术的表型分析实现了在育种过程中快速高效的无损伤选择,气相色谱分析法为高油酸材料的精确鉴定提供了保证。

表4 高油酸花生品种宇花91不同脂肪酸含量检测结果
Note: the detection limit of fatty acid is 0.050%, and the detection result of fatty acid is relative content.

表5 宇花91夏播产量比较结果 (2017)

图3 宇花91单株、荚果及籽仁照片
F435型花生高油酸性状受FAD2A/2a和FAD2B/2b两对基因控制。第一对基因FAD2A用“A”表示,在ORF-448 bp 处存在碱基“G”,“G”突变为“A”后,变成为等位基因FAD2a形式,用“a” 表示。第二对基因FAD2B用“B”表示,在ORF-441_442处插入碱基“A”后,突变为等位基因FAD2b形式,用“b”表示。A/a位于栽培花生的A染色体组,B/b位于栽培花生的B染色体组,A/a 与B/b具有较高的同源性。对高油酸有贡献的为隐性基因“a”和“b”,而且“b”的贡献率远大于“a”[12-13]。在普通油酸含量的栽培种花生中自然存在FAD2A和FAD2a等位基因[27]。有的材料以纯合状态存在 (AA或aa),有的材料以杂合状态存在 (Aa)。而ahFAD2B/2b在普通油酸含量的栽培种花生中只存在FAD2B (BB),而不存在FAD2b (bb)。FAD2A/2a位点纯合的普通油酸花生 (AABB和aaBB) 与高油酸突变体杂交 (aabb),F2代会分别出现15∶1和3∶1的分离比例。如果 FAD2A/2a以杂合状态存在,由于在长期的种植过程中该位点未经选择纯化,在该品种群体中会出现AA、aa和Aa 3种基因型。因此在选择杂交亲本之前需要纯化亲本,筛选出基因型为aa的个体,提高杂交后代材料中高油酸个体出现的频率,提高选择效果。因此在选择杂交亲本时,应尽可能地优先选择aa基因型的材料,以提高杂交后代的选择效率。目前国内普通花生主要推广品种的油酸含量普遍在55%以下,鲁花11号油酸含量达到55%,且油酸亚油酸比值大于2.0。经PCR产物测序鉴定在FAD2A/2a位点为突变纯合体aa,所以在杂交选育过程中只需要选择FAD2b一个位点即可,大大提高了选择几率和选择效果。
高油酸花生除了F435突变型外,还存在M2-225和C458两种化学诱变产生的突变体,分别是在FAD2B基因起始密码子后997 bp和665 bp处存在205 bp微型反向重复转座元件 (Miniature inverted-repeat transposable element,MITE)[28]。Kolikonda等使用引物对bF19/R1进行扩增测序对该插入突变进行鉴定[29]。张新友等开发了针对C458型FAD2B MITE突变的功能标记,并对两个杂交组合“远杂9102 × wt09-0023”和“阜花12号 × wt09-0023”后代个体进行基因型检测和表型鉴定,结果表明BB、Bb、bb 3种不同基因型油酸含量呈逐渐升高的趋势[30]。另外还有GA-T2636M、FR596型等不同突变类型[4]。为了尽可能保持高油酸花生的遗传多样性,在育种过程中要注意选择不同突变类型来源的亲本作杂交亲本,避免遗传单一性对高油酸花生造成的不利影响,最大程度地保持我国高油酸花生的竞争能力。
致谢:感谢玛氏北京温若愚博士、玛氏北美Victor Nwosu博士、美国农业部农业研究中心Guo Baozhu教授在项目执行过程中所提供的帮助,在此表示感谢。
[1] Yu MY, Sun MM, Guo Y, et al. Breeding new peanut line with high oleic acid content using backcross method. Acta Agron Sin, 2017, 43(6): 855–861 (in Chinese). 于明洋, 孙明明, 郭悦, 等. 利用回交法快速选育高油酸花生新品系. 作物学报, 2017, 43(6): 855–861.
[2] Zhang ZH, Wang ZH, Huai DX, et al. Fast development of high oleate peanut cultivars by using marker-assisted backcrossing and their evaluation. Sci Agric Sin, 2018, 51(9): 1641–1652 (in Chinese). 张照华, 王志慧, 淮东欣, 等. 利用回交和标记辅助选择快速培育高油酸花生品种及其评价. 中国农业科学, 2018, 51(9): 1641–1652.
[3] Janila P, Pandey MK, Shasidhar Y, et al. Molecular breeding for introgression of fatty acid desaturase mutant alleles (and) enhances oil quality in high and low oil containing peanut genotypes. Plant Sci, 2016, 242: 203–213.
[4] Wang CT, Zhu LG. High Oleic Acid Peanut. Shanghai: Shanghai Scientific and Technical Publishers, 2017: 25–27 (in Chinese). 王传堂, 朱立贵. 高油酸花生. 上海: 上海科学技术出版社, 2017: 25–27.
[5] Wang CT, Tang YY, Wang XZ, et al. Effect of FAD2A/FAD2B genes on fatty acid profiles in peanut seeds. Res Crop, 2013, 14(4): 1110–1113.
[6] Silva L. Oleic Acid: Dietary Sources, Functions and Health Benefits: Oleic Acid: Natural Variation and Potential Enhancement in Oilseed Crops. Hauppauge: Nova Science Publishers Inc, 2013: 29–44.
[7] Meng S, Li L, He MJ, et al. Molecular marker assisted selection ofgene in high oleate peanut (L.) hybrids. J Plant Genet Resour, 2015, 16(1): 142–146 (in Chinese). 孟硕, 李丽, 何美敬, 等. 高油酸花生(L.)杂交后代基因的分子标记辅助选择. 植物遗传资源学报, 2015, 16(1): 142–146.
[8] Wang CT, Wang XZ, Tang YY, et al. High-oleic peanut germplasm enhancement and cultivar releases in China: main achievements and suggestions. J Peanut Sci, 2015, 44(2): 49–53 (in Chinese). 王传堂, 王秀珍, 唐月异, 等. 中国高油酸花生种质创制、品种选育进展与建议. 花生学报, 2015, 44(2): 49–53.
[9] Huang BY, Qi FY, Sun ZQ, et al. Improvement of oleic acid content in peanut (L.) by marker assisted successive backcross and agronomic evaluation of derived lines[EB/OL]. Acta Agron Sin, 2019, 45(4): 546–555 (in Chinese).黄冰艳, 齐飞艳, 孙子淇, 等. 以分子标记辅助连续回交快速提高花生品种油酸含量及对其后代农艺性状的评价[EB/OL]. 作物学报, 2019, 45(4): 546–555.
[10] Norden AJ, Gorbet DW, Knauft DA, et al. Variability in oil quality among peanut genotypes in the Florida breeding program. Peanut Sci, 1987, 14(1): 7–11.
[11] Jung S, Swift D, Sengoku E, et al. The high oleate trait in the cultivated peanut [L.]. I. Isolation and characterization of two genes encoding microsomal oleoyl-PC desaturases. Mol Genet Genet, 2000, 263(5): 796–805.
[12] Xu PL, Tang GY, Bi YP, et al. Analysis of the peanut transgenic offspring with depressinggene. Chin J Biotech, 2018, 34(9): 1469–1477 (in Chinese). 徐平丽, 唐桂英,毕玉平, 等. 花生基因抑制表达的转基因后代分析. 生物工程学报, 2018, 34(9): 1469–1477.
[13] Liu H, Xue JM, Xu QY, et al. Spatio-temporal expression of fatty acid desaturase genesandin peanuts. J Zhejiang A&F Univ, 2019, 36(1): 14–20 (in Chinese). 刘华, 薛金嫚, 徐倩玉, 等. 花生油酸脱氢酶基因和的时空表达特征. 浙江农林大学学报, 2019, 36(1): 14–20.
[14] Li Y, Yao Q, Ren L, et al. Breeding of a new peanut variety Kainong 1715 and the analysis of its high and stable yield trait. Bull Agric Sci Technol, 2017(6): 280–281 (in Chinese). 李阳, 姚潜, 任丽, 等. 花生新品种开农1715选育及丰产性稳产性分析. 农业科技通讯, 2017(6): 280–281.
[15] Song ZH, Chen YZ, Lv YZ, et al. High-yielding characters and production development of Luhua 11. Peanut Sci Technol, 2000(4): 26–28 (in Chinese). 宋再华, 陈玉珍, 吕永臻, 等. 鲁花11号丰产性状与高产开发. 花生科技, 2000(4): 26–28.
[16] Lei Y, Jiang HF, Wen QG, et al. Frequencies ofalleles in Chinese peanut mini core collection and its correlation with oleic acid content. Acta Agron Sin, 2010, 36(11): 1864−1869 (in Chinese). 雷永, 姜慧芳, 文奇根, 等.等位基因在中国花生小核心种质中的分布及其与种子油酸含量的相关性分析. 作物学报, 2010, 36(11): 1864−1869.
[17] Huang BY, Zhang XY, Miao LJ, et al. Allelic expression variation ofand its relationship with oleic acid accumulation in peanut. Acta Agron Sin, 2012, 38(10): 1752–1759 (in Chinese). 黄冰艳, 张新友, 苗丽娟, 等. 花生等位基因表达变异与种子油酸积累关系. 作物学报, 2012, 38(10): 1752–1759.
[18] Wang CT, Wang XZ, Tang YY, et al. Convenient and rapid DNA extracting method of peanut health tissues and diseased tissues: CN, 200910255786.0. 2009-12-28 (in Chinese).王传堂, 王秀贞, 唐月异, 等. 花生健康组织和病组织简便快速DNA提取方法. 中国, 200910255786.0. 2009-12-28.
[19] Fang CQ, Wang CT, Wang PW, et al. Identification of a novel mutation infrom a peanut EMS mutant with elevated oleate content. J Oleo Sci, 2012, 61(3): 143–148.
[20] Wang CT, Zhang JC, Tang YY, et al. Current situation and future directions of high oleic peanut breeding in China. Shandong Agric Sci, 2018, 50(6): 171–176 (in Chinese). 王传堂, 张建成, 唐月异, 等. 中国高油酸花生育种现状与展望. 山东农业科学, 2018, 50(6): 171–176.
[21] Yu HT, Yang WQ, Tang YY, et al. An AS-PCR assay for accurate genotyping of/genes in peanuts (L.). Grasas Aceites, 2013, 64(4): 395–399.
[22] Chen ZB, Wang ML, Barkley NA, et al. A simple allele-specific PCR assay for detectingalleles in both A and B genomes of the cultivated peanut for high-oleate trait selection. Plant Mol Biol Rep, 2010, 28(3): 542–548.
[23] Chu Y, Wu CL, Holbrook CC, et al. Marker-assisted selection to pyramid nematode resistance and the high oleic trait in peanut. Plant Genome, 2011, 4(2): 110–117.
[24] Barkley NA, Isleib TG, Wang ML, et al. Genotypic effect ofon fatty acid profiles in six segregating peanut (L.) populations. BMC Genet, 2013, 14: 62.
[25] Wang CT, Yu SL, Zhang SW, et al. Novel protocol to identify true hybrids in normal oleate × high oleate crosses in peanut. Electron J Biotechnol, 2010, 13(5): 6442–6447.
[26] Zhao SZ, Li AQ, Li CS, et al. Development and application of KASP marker for high throughput detection ofmutation in peanut. Electron J Biotechnol, 2012, 5: 9–12.
[27] Wang ML, Chen CY, Tonnis B, et al. Changes of seed weight, fatty acid composition, and oil and protein contents from different peanutgenotypes at different seed developmental and maturation stages. J Agric Food Chem, 2018, 66(14): 3658–3665.
[28] Patel M, Jung S, Moore K, et al. High-oleate peanut mutants result from a MITE insertion into thegene. Theor Appl Genet, 2004, 108(8): 1492–1502.
[29] Varshney RK, Tuberosa R. Translational Genomics for Crop Breeding: Abiotic Stress, Yield and Quality, Volume 2. Hoboken: Wiley-Blackwell, 2013: 31–46.
[30] Zhang XY, Qi FY, Huang BY, et al. Primer for detecting mutant genotypes of FAD2A and FAD2B genetic loci of high oleic acid peanuts and PCR detection method of primer: CN, 201410642798. 2015-02-04(in Chinese).张新友, 齐飞艳, 黄冰艳, 等. 检测高油酸花生FAD2A和FAD2B基因位点突变基因型的引物及其PCR检测方法:中国, 201410642798. 2015-02-04.
Breeding on a new peanut variety Yuhua91 with high oleic acid content
Leilei Pan1,2, Yanan Jiang1, Wenjie Zhou1, Pingping Jiang1,2, Lanrong Wu3, Ao Chen4, Hong Zhu1, Jiongming Sui1, Jingshan Wang1, and Lixian Qiao1
1 Dry-land Farming Technology Laboratory, College of Agronomy, Qingdao Agricultural University, Qingdao 266109, Shandong, China 2 Key Laboratory of Plant Biotechnology in Universities of Shandong Province, College of Life Sciences, Qingdao Agricultural University, Qingdao 266109, Shandong, China 3 Qingdao Seed Station, Qingdao 266071, Shandong, China 4 Zhanjiang Institute of Agricultural Sciences, Zhanjiang 524094, Guangdong, China
Yuhua91 is a new peanutvariety with high oleic acid content bred by Qingdao Agricultural University. The crossing was conducted with Luhua11 as female parent and with Kainong1715, an F435-type variety with high oleic acid content as male parent. The real F1hybrids were screened by sequencing on PCR amplification products, and those homozygotes with bb genotype in F2populations were screened by the same sequencing method as above. The content of oleic and linoleic acid was measured on the kernels harvested from F2single plants by near infrared ray method, and those kernels whose content of oleic was above 80%, oleic and linoleic acid ratio was above 10.0 were obtained and planted into a row, with pedigree method for subsequent selection breeding. Yuhua91 has some characters of small pod, light and obvious pod texture, 148.06 g per 100 pods, 63.31 g per 100 kernels, 75.15% shelling percentage, long elliptic seed kernel, pink seed coat, without crack, white endotesta. Its content of protein, oil, oleic acid, linoleic acid and palmitic acid was 26.57%, 52.72%, 80.40%, 2.50% and 5.57% respectively. Yuhua91 has other characters of strong seedlings, compact pod areas, and moderate resistance to leaf spot disease and bacterial wilt. Average pod yield is 215.79 kg per Mu, 15.27% higher than the control variety Huayu20. Average seed kernels yield is 157.33 kg per Mu, 21.64% higher than the control variety Huayu20. Yuhua 91 has been registered on department of agriculture in 2018, and the registration No. is GPD peanut (2018) 370210, fit for growing in Shandong Province.
peanut (L.), high oleic acid, Yuhua91, F435, marker assisted selection (MAS)
January 23, 2019;
March 20, 2019
Shandong Province Science and Technology Development Plan Project (No. 2018GNC111014), Key Laboratory of Biology and Genetic Improvement of Oil Crops, Ministry of Agriculture, Open Project Fund (No. KF2018008), the Mars-China High Oleic Acid Peanut Breeding Project.
Lixian Qiao. Tel: +86-32-86080447; Fax: +86-32-86080447; E-mail: lxqiao73@163.com
山东省重点研发计划 (No. 2018GNC111014),农业部油料作物生物学与遗传育种重点实验室开放课题基金 (No. KF2018008),“玛氏-中国花生高油酸育种计划”项目资助。
2019-03-28
http://kns.cnki.net/kcms/detail/11.1998.Q.20190327.1030.003.html
潘雷雷, 姜亚男, 周文杰, 等. 高油酸花生新品种宇花91的选育.生物工程学报, 2019, 35(9): 1698–1706.
Pan LL, Jiang YN, Zhou WJ, et al. Breeding on a new peanut variety Yuhua91 with high oleic acid content. Chin J Biotech, 2019, 35(9): 1698–1706.
(本文责编 陈宏宇)

