基于风味和产酶性能的霉菌M2的筛选及制曲工艺优化
韩 英,赵恒山,田宇敏,3,王晓勇,刘 帅,蔚慧欣,贾丽艳,,3
(1.山西杏花村汾酒厂股份有限公司技术中心,山西汾阳 032205;2.山西农业大学食品科学与工程学院,山西太谷 030801;3.山西白酒生物工程研究生创新中心,山西太谷 030801)
霉菌是白酒发酵过程中重要的一类微生物[1]。霉菌产生的糖化酶、液化酶、酯化酶,可以使淀粉分解,促进酯类物质形成[2-3];霉菌在代谢过程中也会产生代谢产物,赋予白酒一定的风味[4-5]。目前,关于霉菌在白酒发酵中的应用主要集中于霉菌的产酶能力和霉菌对大曲及大曲风味物质形成的影响方面的研究和应用[6-7],关于霉菌对白酒风味物质形成及风格影响的研究及应用较少。笔者认为,白酒发酵过程中,霉菌产生酶类物质的性能不容忽视,霉菌对白酒风格的影响也同样重要。为此,课题组以风味和产酶性能,从传统清香型白酒的酒醅中分离霉菌,研究不同霉菌对清香型白酒的发酵和风格的影响并研究霉菌的制曲工艺,以期为清香型及其他白酒的可调控、机械化、智能化的发展提供菌种资源及理论和应用基础。
1 材料与方法
1.1 材料、仪器
菌株:M0为黑曲霉AS3.4309,购买于中国普通微生物菌种保藏中心。
样品:某清香型白酒厂的新鲜酒醅。
原料:新鲜、干燥、无虫、无污染、无霉变或潮湿酸败的麸皮。
马铃薯培养基(PDA)[8]:马铃薯(去皮)200 g、葡萄糖20 g、琼脂20 g、水1000 mL、pH 值为自然,121 ℃下灭菌20 min后使用。
产孢子培养基[8]:麸皮∶水=1∶1,121 ℃下灭菌20 min。
仪器设备:FA1004B 型电子天平,上海越平科学仪器有限公司;双列六孔型仪表恒温水浴锅,上海树立仪器仪表有限公司;DH-600 型电热恒温培养箱,北京科伟永兴仪器有限公司;DL-1 型电子万用炉,天津市大港区红杉试验设备厂;SGD-Ⅳ 型全自动还原糖测定仪;YXQ-50S11 型立式压力蒸汽灭菌器,上海博讯实业有限公司医疗设备厂;PB-10 型pH 仪;HZ85-Z 型磁力搅拌机,北京中兴伟业仪器有限公司。
1.2 试验方法
1.2.1 霉菌的分离、培养
采用孟加拉红选择培养基分离菌株。对分离菌株进行麸皮培养:取麸皮15 g 置于250 mL 的三角瓶中,再加15 mL 水,用棉塞和报纸包好,以121 ℃灭菌20 min,待高压蒸汽灭菌锅压强降至大气压时,取出三角瓶,趁热将三角瓶中的麸皮打散,再将三角瓶放置于无菌室,待温度冷却至室温时分别接种霉菌3 mL 菌液,在无菌条件下搅拌均匀置于不同温度下培养84 h,并且每隔24 h 进行无菌搅拌1次。
1.2.2 霉菌的复筛
通过菌株强化发酵生产清香型白酒。经品评和气相色谱技术筛选获取对清香型白酒品质具有影响的功能性霉菌。具体方法如下:将初筛获得的霉菌制备成麸曲,测定其糖化力和液化力,通过强化发酵的方式,加入酒醅中,添加比例为5%麸曲和5%的大曲,采用“清蒸二次清,固态地缸发酵,甑桶蒸馏”的工艺获取白酒。以传统大曲清香型白酒生产工艺做对照。对蒸馏获得的白酒进行品评,测定其理化指标、风味物质。由国家级品评酒师10名对蒸馏白酒进行感官品评。
采用气相色谱技术测定风味物质,具体参考GB/T 10345—2007。
1.2.3 霉菌的鉴定
通过菌落、菌体形态观察和分子生物学技术手段,对菌株进行鉴定。
1.2.4 制曲工艺的优化
1.2.4.1 单因素试验
(1)培养时间对麸曲糖化酶活力及液化酶活力的影响。将3 mL 孢子数为107~108cfu/mL 的霉菌孢子菌悬液接种于水分含量为50%的15 g 无菌麸皮中,混匀,35 ℃恒温培养24 h、36 h、48 h、60 h、72 h、84 h、96 h、108 h和120 h,制备成麸曲,测定麸曲糖化酶活力,每组做3个平行。
(2)培养温度对麸曲糖化酶活力及液化酶活力的影响。将3 mL 孢子数为107~108cfu/mL 的霉菌孢子菌悬液接种于水分含量为50%的15 g 无菌麸皮中,混匀,25 ℃、30 ℃、35 ℃、40 ℃和45 ℃恒温培养72 h,测定麸曲糖化酶活力,每组做3个平行。
(3)水分含量对麸曲糖化酶活力及液化酶活力的影响。将3 mL 孢子数为107~108cfu/mL 的霉菌孢子菌悬液接种于水分含量分别为41%、44%、47%、50%、53%、55%的15 g 无菌麸皮中,混匀,35 ℃恒温培养72 h,测定麸曲糖化酶活力,每组做3个平行。
(4)孢子接种量对麸曲糖化酶活力及液化酶活力的影响。将1 mL、2 mL、3 mL、4 mL 和5 mL 孢子数为107~108cfu/mL 的霉菌孢子菌悬液接种于水分含量为50%的15 g 无菌麸皮中,混匀,35 ℃恒温培养72 h,测定麸曲糖化酶活力,每组做3 个平行。
1.2.4.2 响应面试验
在单因素试验的基础上,以制曲温度、孢子接种量、培养时间和水分含量为响应变量,糖化酶活力为响应值,采用Box-Behnken 试验设计,对霉菌所制麸曲进行响应面优化组合,确定麸曲的最佳制作工艺条件。
1.2.5 麸曲理化指标的测定
(1)糖化酶活力的测定
糖化酶活力测定参照《酿酒分析与检测》斐林试剂法[9]。
(2)液化酶活力的测定
液化酶活力测定参照《酿酒分析与检测》碘化滴定法[9]。
(3)水分的测定
水分测定按照GB 5009.3—2010 执行直接干燥法[10]。
(4)酸度的测定
酸度的测定参照GB/T 13662—2008 中和法,以乳酸的质量分数计[11]。
(5)孢子数的测定
孢子数的测定参照GB 4789.15—2010 霉菌和酵母计数法测定[12]。
2 结果与分析
2.1 霉菌的分离和初筛(图1)
从酒醅中分离到5 株霉菌,分别为M1、M2、M3、M4和M5,并对这些菌株的产糖化酶活力进行了测定。由图1 可知,M1、M2相比M3、M4和M5的糖化酶活力高,但相比对照菌株M0,M1、M2的糖化酶活力较低,糖化力在200~700 U/g;M3、M4均没有明显的糖化酶活力,M5糖化酶活力也较低。为此,后期以M1、M2为研究对象,进行复筛。
2.2 霉菌的复筛
将初筛获得的霉菌M1、M2麸曲强化发酵酒醅,生产清香型白酒。由国家级品酒师对菌种强化发酵蒸馏白酒进行品评。由表1 可知,M1强化发酵组的白酒为清香型风格,但香气较淡,带腥腻,略有异味,酒体较绵柔,醇甜,尾子略苦涩,风味较差;M2强化发酵组的白酒属清香型风格,香带粮腥味,较醇厚,略杂,略显酱味,酒体较绵柔,风味较好。由表2 可知,霉菌M1、M2强化发酵生产清香型白酒属于清香型风格,但强化发酵对白酒的理化指标和主体骨架成分产生及含量和比例具有一定的影响。由于M2强化发酵白酒的品评结果优于M1,为此,后期主要以菌株M2为对象开展研究。

图1 不同菌株的糖化酶活力

表1 不同菌株强化发酵对白酒的感官影响
2.3 霉菌M2的鉴定
霉菌M2在PDA 培养基上培养,菌落圆形,边缘整齐,致密绒毛状;菌丝发达,生长快,生长初期呈疏松、白色,匍匐菌丝透明发达,后稠密,颜色变为灰色(图2);菌丝无隔,菌体产黑色孢子囊,孢子较小,呈椭圆形或圆形。孢囊梗由生假根处的匍匐菌丝长出,多数成丛生、少数单生,囊轴呈圆形,无囊基、囊领,菌丝体无横隔(图3),M2的孢子色泽为黑色、椭圆形(图4)。初步鉴定为根霉(Rhizopus)。
通过对菌株M2的ITS1-5.8SrDNA-ITS2 区域序列进行测序,与Genbank DNA 序列库同源性序列比对发现,菌株M2与米根霉(R.oryzae)序列相似性为100%(表3)。

表2 菌株强化发酵酒醅对白酒理化指标及骨架风味物质的影响
综合菌落、菌体特征和分子生物学鉴定,确定菌株M2为米根霉,将其命名为米根霉(Rhizopus oryzae)M2。见图2、图3、图4。
2.4 霉菌M2麸曲工艺的优化
2.4.1 单因素试验结果
(1)培养时间对糖化酶活力的影响。由图5 可知,随着培养时间的延长,菌株M2糖化酶活力呈先升高后下降的变化趋势。菌株M2在培养时间24~72 h,糖化酶活力有所增加但变化幅度不大,;当培养时间达到84 h 时,糖化酶活力显著增大,最大值为728 U/g;在培养时间84 h 之后,菌株M2的糖化酶活力又逐渐降低,但变化幅度不大。

图2 菌株M2培养2d的菌落特征图和培养4 d的菌落特征图
图3 M2菌体特征图(10×40)
(2)培养温度对糖化酶活力的影响。由图6 可知,培养温度在25~40 ℃之间时,随着培养温度的升高,M2糖化酶活力逐渐升高;当培养温度为40 ℃时,M2的糖化酶活力达到最高值,为813 U/g;培养温度为35~45 ℃时,菌株M2的糖化酶活力逐渐下降。
(3)水分含量对糖化酶活力的影响。由图7 可知,随着水分含量的增加,菌株M2的糖化酶活力在水分含量为50%~60%时,呈急速上升趋势,当水分含量为60%时,M2的糖化酶活力达到最高值,为915 U/g;水分含量达到60%~70%时,菌株M2的糖化酶活力缓慢下降。

表3 霉菌M2ITS1-5.8Sr DNA-ITS2同源性序列比对结果

图4 菌株M2的孢子(10×40)

图5 培养时间对菌株M2糖化酶活力的影响

图6 培养温度对M2糖化酶活力的影响
(4)孢子接种量对糖化酶活力的影响。由图8可知,随着孢子接种量的增加,菌株M2的糖化酶活力呈先上升后下降趋势,接种的菌液为1~3 mL时,糖化酶活力急剧上升;当孢子接种量为3 mL时,糖化酶活力达到最高值,为815 U/g;当接种量增加为3~5 mL时,糖化酶活力呈下降趋势。

图7 水分含量对菌株M2糖化酶活力的影响

图8 孢子接种量对菌株M2糖化酶活力的影响
2.4.2 响应面试验结果分析
在上述4 组单因素试验的基础上,根据Box-Behnken 的中心组合设计原理,选择培养时间、培养温度、水分含量和孢子接种量作为响应面优化考察因素,以糖化酶活力为响应面Y 值,设计4 因素3水平试验。试验因素水平见表4,结果见表5,各因素的效应评价及系数估计见表6。
利用Design-Expert 8.0.6 软件对表2 中试验数据进行二次线性回归拟合,得到数学模型方程为:

对该模型进行方差分析,结果见表6。由表6可以看出D作用显著,AC、BC、A2、B2、C2、D2作用极显著。
由表7 回归方程误差统计分析可知,P 值<0.01,表明该模型极显著,且失拟项P=0.18>0.05,表明不显著,该模型在被研究的整个回归区域内拟合性较好;R-Squared=0.9462,表明该方程相关性很好;该试验C.V.%=2.23<10,表明该试验的可信度和精确度高;精确度Adeq Precision=12.516>4,表明该模型是合理的。因此,该模型可以使用,适应性良好。

表4 Box-Behnken试验因素表

表5 Box-Behnken试验设计与结果

表6 回归统计分析结果
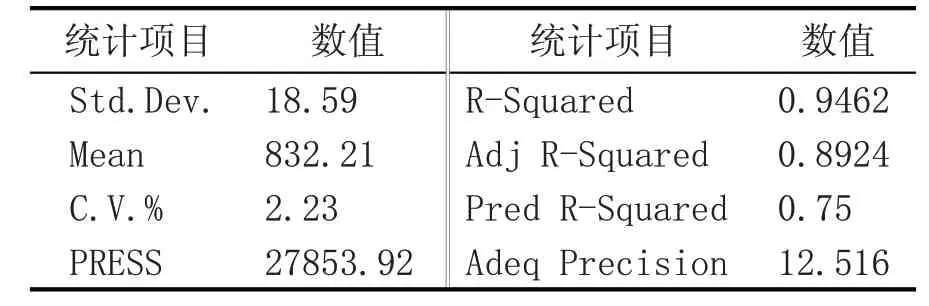
表7 回归方程误差统计分析表
从图9 等高线可以直观地看出,A(时间)与C(水分)交互作用显著。从图9 三维立体可以看出,纯种M2曲的糖化酶活力在合适的反应A(时间)和C(水分)下,具有最大值,该最大值出现在反应A(时间)值(84~90 h),C(水分)值(59%~61%)。

图9 时间(A)和水分(C)交互作用对糖化力影响的响应面与等高线图
从图10 等高线可以直观地看出,B(温度)与C(水分)交互作用显著。从图10 三维立体中可以看出,菌株M2曲的糖化酶活力在合适的反应B(温度)和C(水分)下,具有最大值,该最大值出现在反应B(温度)值(40~41 ℃),C(水分)值(59%~61%)。

图10 水分(C)和温度(B)交互作用对糖化力影响的响应面与等高线图
综上所述,确定最佳试验条件:培养时间为84.35 h,培养温度为40.12 ℃,水分含量为59.86%,孢子接种量为2.78 mL,此时的预测糖化力为938.058 U/g。
2.5 验证试验结果
考虑到实际操作的可行性,将制曲条件修正为:培养时间为84 h,培养温度为40 ℃,水分含量为60%,孢子接种量为3×107~108cfu/mL。该条件下实际生产的麸曲糖化力为917 U/g,符合预测值误差范围。
2.6 菌株M2麸曲的感官及理化指标分析
由图11 可以看出,M2麸曲呈棕色,有光泽,疏松不易结块。此时,麸曲的理化指标为:糖化力917 U/g,液化力0.72 U/g,水分含量8.34%,酸度0.84 g/L。
3 结论

图11 菌株M2麸曲
本研究从传统清香型白酒酒醅中分离筛选获得1 株能赋予清香型白酒具有酱感的菌株M2;经过菌落、菌体特征和分子生物学鉴定,确定该菌株为米根霉(R.oryzae),该菌株具有产糖化酶和液化酶的能力。
以糖化酶活力为测定指标,在单因素试验的基础上,利用Box-Behnken 试验设计,通过响应面法优化菌株M2制曲工艺,获得最佳制曲工艺条件为:培养时间84 h,培养温度40 ℃,水分含量60%,孢子接种数3×107~108cfu/mL,此时,菌株M2麸曲糖化力达到最大值,为917 U/g。
利用菌株M2所制备麸曲的理化指标为:糖化力917 U/g,液化力0.72 U/g,水分含量8.34%,酸度0.84 g/L。
以上研究为该菌株强化发酵应用于清香型白酒生产中,奠定了理论和应用基础,也为白酒的可调控化、机械化和智能化的发展提供了菌种资源。后期应继续基于风味导向技术,研究该菌株赋予白酒的特征物质,并对其形成机制作进一步研究。

