骨质疏松症合并膝骨性关节炎患者骨密度及血清骨代谢指标、炎症因子水平研究
尹伟 杨斌辉 张波 周娟 卫永鲲
西安交通大学附属汉中三二○一医院,陕西 汉中 723000
衰老是一个渐进的过程,其特征是随着时间的推移,功能的退变会进一步加速。这是一个复杂的现象,已知受到各种因素的影响,如饮食、生活方式、环境、遗传和疾病。骨关节炎(osteoarthritis, OA)、骨质疏松症(osteoporosis, OP)、阿尔茨海默症和帕金森病等疾病均与衰老有关。与健康的老年人相比,这类患者的生活充满了严重的挑战,运动和日常活动均受到较大干扰,且发病率随着年龄的增长而增加。骨质疏松症和骨关节炎是绝经后妇女的常见疾病。骨质疏松症是一种全身性骨骼疾病,其特征是低骨密度(bone mineral density, BMD)和骨组织的微结构破坏,从而增加骨脆性和骨折风险。相反,骨关节炎是由遗传、代谢、生化和机械因素与炎症的复杂相互作用引起的关节软骨损伤的结果。这两种疾病都是主要的公共卫生问题,影响老年人的整体健康和生活质量、功能和身体健康[1]。临床经验表明,骨质疏松症和骨关节炎可能并存。它们之间的关系仍不清楚,尽管遗传研究确定了共同遗传关联的存在[1]。年龄的增加是OA的风险因素之一,然而,现在人们认识到衰老和OA是独立的过程,因此年龄是许多促成因素之一[2]。因为OA历来被描述为软骨疾病,所以关于OA老化的大多数研究都集中在软骨组织上[3]。最近,已经提出OA作为整个关节的疾病,提出了对软骨下骨的严重改变以及低度全身和局部炎症关注[4]。OA的病理变化导致整个关节的生理平衡中断,骨异常包括软骨下板硬化、骨髓病变和骨赘的形成,这些都是间歇性软骨下骨重建的结果,其将OA的这一方面与OP联系起来[5]。尽管如此,较高的BMD并不能降低骨质疏松性骨折的风险,因为骨关节炎患者骨骼中骨小梁分离减少和骨小梁数量增加的结构优势与骨关节炎相关因素如姿势不稳和肌肉减弱相抵消。本研究就绝经后骨质疏松症合并膝关节骨性关节炎患者骨密度、血清代谢指标以及炎症因子进行研究分析,进一步了解两者之间的关系。
1 材料和方法
1.1 研究对象
这项前瞻性研究随机选择了2017年3月至2018年2月在西安交通大学附属汉中三二○一医院就诊且患有骨质减少或骨质疏松症合并有症状的中度膝关节骨性关节炎的绝经后妇女。年龄超过55岁的绝经后女性患者接受了DXA骨密度仪在髋关节或腰椎处进行的骨密度检查,且BMD检测结果符合骨质疏松症诊断标准(T≤-2.5 SD)。排除新骨折或腕骨骨折以及患有肌肉骨骼系统的炎性疾病或骨关节炎急性发作的患者、短期内接受非甾体类抗炎药物的患者、轻度和重度骨性关节炎或严重影响活动的患者以及已经接受骨质疏松症治疗或可能对骨量有不利影响的其他疾病(炎性肠病)的患者。所有参与者均签署了知情同意书。
1.2 方法
使用DXA骨密度仪(Discovery-W; Hologic Inc.,USA)在受试者左髋和腰椎(L1~4)部位测量BMD(g/cm2)。DXA由专业的技术人员操作,受试者处于仰卧位。对于左髋和腰椎,研究中允许的最大百分比变异系数分别为2.5%和1.8%。在预测试中满足该目标的技术人员可以进行DXA扫描。采集受试者早晨空腹静脉血10 mL,离心取血清,置-20 ℃冰箱保存待测。使用罗氏自动电化学发光系统(Roche Diagnostics Gmbh,Germany)快速测量骨代谢相关因子,包括骨钙素(BGP)、血清抗酒石酸酸性磷酸酶异体(TRACP-5b)、骨碱性磷酸酶(BAP)及I型胶原交联C末端肽(CTX-1)和炎症因子白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)、转化生长因子-β1 (TGF-β1)及白细胞介素-10(IL-10)。BGP测定中和测定间变异系数(CV)分别为5.6%和8.0%,TRACP-5b为2.9%和4.0%,BAP为2.3%和2.8%,CTX-1分别为2.5%和3.5%,IL-6分别为2.9%和3.8%,TNF-α分别为2.3%和3.6%,TGF-β1分别为2.4%和3.7%,IL-10分别为2.1%和3.8%。试剂盒由美国R&D Systems公司提供,具体操作步骤按照厂家说明书进行。
1.3 统计学处理
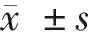
2 结果
根据T值,参与者被分为非骨质疏松症(T >-2.5 SD)和骨质疏松症(T≤-2.5 SD)。共有78例绝经后骨质疏松症患者、75例绝经后骨质疏松症合并膝骨性关节炎患者及76例膝骨性关节炎患者纳入本研究。将上述患者分为骨质疏松症组(OP组)、膝骨性关节炎组(KOA组)及骨质疏松症合并膝骨性关节炎组(OPA组)。OP组患者年龄为(61.3±5.0)岁,绝经时间为(11.6±3.2)年;KOA组患者年龄为(61.2±5.1)岁,绝经时间为(11.5 ±3.2)年;OPA组患者年龄为(61.3±4.9)岁,绝经时间为(11.4±3.4)年;3组患者一般基线资料比较具有可比性(P>0.05)。
受试者的腰椎(L1~4)及左髋部的BMD检测结果如表1所示。双能X线骨密度仪的检测结果显示KOA组的骨密度总体均较高,显著高于OP组和OPA组(P<0.05);而OPA组的骨密度在3组中最低,显著低于OP组和KOA组(P<0.05)。这表明OP合并OA时患者的骨密度会进一步降低。
血清骨代谢指标检测结果如表2所示。3组中,OPA组的女性骨转换速度最快,合并最高的BAP、BGP、CTX-1及TRACP-5b水平;而KOA组的骨代谢指标的水平较OP组显著降低(P<0.05);这表明OP合并OA时患者的骨转换会进一步加快。
血清炎症因子检测结果如表3所示。三组中OPA组的IL-6、TNF-α、IL-10水平最高,而TGF-β1水平最低;和OP组,KOA组比较差异显著(P<0.05);OP组也具有较高的IL-6、TNF-α、IL-10水平和较低的TGF-β1水平。
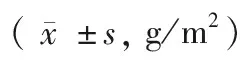
表1 三组患者骨密度比较Table 1 Comparison of BMD among the
注:与OP组比较,*P<0.05;与KOA组比较,#P<0.05。
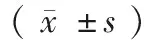
表2 三组患者骨代谢指标比较Table 2 Comparison of bone metabolic indexes among
注:与OP组比较,*P<0.05;与KOA组比较,#P<0.05。
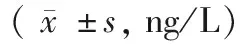
表3 三组患者细胞因子水平比较Table 3 Comparison of cytokine levels among the
注:与OP组比较,*P<0.05;与KOA组比较,#P<0.05。
3 讨论
骨质疏松症(OP)和骨关节炎(OA)是两种对老年人生活质量具有严重影响的常见疾病。骨质疏松症为骨质流失和骨微结构退化导致的骨质脆性和骨折风险的增加,是全身性疾病。骨关节炎是一种疾病,其表现出关节软骨的退行性改变以及骨和其他结缔组织的增生。虽然OP和OA与骨骼、软骨代谢和身体老化过程密切相关,但它们通常被认为是两种完全不同的疾病。以往的研究发现,老年股骨头切除患者可保持良好的股骨头关节软骨质量,而OA患者可保持较好的股骨的骨量[6]。随后的研究还发现,患有髋关节或膝关节骨性关节炎的患者比正常人和OP患者的骨质量和周围骨质量更高[6]。近年来,不断有学者提出两者关系密切,有一定的联系,骨质疏松状态会影响膝骨性关节炎的进展,骨质疏松是膝骨性关节炎重要的危险因素[7-8]。研究表明OA与较高的BMD相关,而其他研究表明高BMD可降低OA的进展风险[9]。因此,OA与BMD之间的关系是复杂的,骨代谢在两者的病理生理学中起作用。
骨质疏松症的特征是低骨量和持续增加的骨折风险,通过双能X射线吸收测定法(DXA)检测到的低BMD来诊断骨质疏松症。传统上可以通过标准关节X线片观察骨赘、骨硬化、关节间隙狭窄和有或没有临床症状的囊肿存在进行OA诊断[10]。用于诊断OA的方法对变化相对不敏感,并且没有描述哪些患者具有更加明显且加重的疾病。目前已知OA是一种全关节疾病,其在关节周围和内部的不同组织之间相互作用[11]。骨转换的生化标志物可以作为比射线照片更有利于观察OA进展且具有特异性和敏感性的标志物或治疗疗效的评价。已有研究描述了OA动物模型和人体中发现与关节密切相关的几种生化标志物[12]。潜在的标志物是在骨重塑过程中产生或在骨重吸收或形成过程中释放的标志物,以及对骨代谢很重要的因子如维生素D、PTH、磷酸盐、钙、性激素、细胞因子[9]。此次研究显示OP及KOA患者血清骨代谢指标BAP、BGP、CTX-1及TRACP5b的水平都有不同程度减低,而OP合并KOA患者BAP、BGP、CTX-1及TRACP5b的水平显著低于OP、KOA患者,这表明OP及KOA患者的骨代谢都有不同程度减低,而OP合并KOA患者骨转换进一步减低,这对这类患者骨密度减低有进一步补充。
细胞因子是参与OA发病机制的最重要的因素之一。它们通过促进分解代谢和参与关节的破坏,最大程度上对关节的自身和周围组织的代谢进行干扰。它们在OA的发病机制中发挥的关键作用是这些炎症因子直接对大多数关节内细胞的代谢影响以及通过细胞内信号转导的途径对细胞因子、酶以及其他炎症化合物的产生影响。在这类细胞因子有的许多代表,最重要的是IL-10,TNF-α,IL-6,也是三种常见的细胞因子,它们在OA患者的软骨和滑膜中升高,导致软骨细胞凋亡的刺激因子[13]。转化生长因子β1(TGF-β1)是超级细胞因子家族的成员,调节许多重要的骨骼过程。TGF-β1信号传导已在骨骼中进行广泛研究,TGF-β1涉及骨形成的各个阶段,例如成骨细胞的募集和刺激;目前,TGF-β1被认为在OA的发病机理中起作用,OA动物模型中的TGF-β1可以抑制了关节软骨的退化;而且,发现TGF-β1在破骨细胞活性增加期间被激活[13]。OP合并KOA患者各种炎性细胞因子高水平表达,刺激破骨细胞增殖及分化,同时提高成骨细胞活性,增加了破骨作用,进一步加重病情[14]。此次研究发现在OA合并绝经后OP时,患者血清中的IL-6、TNF-α、IL-10水平最高,而TGF-β1水平最低,可能的原因是OA和OP都与免疫有关,这些炎症因子均会加重OA和OP,因此关注这类病人免疫异常也是非常重要的。
总的来说, OP合并KOA患者的骨密度、骨代谢指标以及细胞因子水平较OP及KOA患者有所不同,其中细胞因子水平显著升高。因此关注这类患者的治疗时要注意其免疫的调节、了解它们的特征,对进一步治疗OP合并KOA患者有一定的指导意义。

