基于网络药理学探讨骨碎补抗骨质疏松的分子作用机制
张罡瑜 朱璐璐 林瑞婷 李泽云 李敏瑶 王海彬 陈鹏*
1.广州中医药大学,广东 广州 510405 2.广州中医药大学岭南医学研究中心中医骨伤科实验室,广东 广州 510405 3.广州中医药大学第一附属医院关节骨科,广东 广州 510405 4.广州中医药大学第一附属医院全国中医髋关节病重点专科,广东 广州 510405
骨质疏松症(osteoporosis,OP)是一种常见的代谢性疾病,其特点是骨密度降低,骨微观结构退化,最终导致骨骼脆性增加,骨折危险性增高[1]。其中,髋部骨折最为严重,约21%~30%的髋部骨折患者在1年内死亡[2]。随着人口老龄化进程的逐步加快,OP已成为全球面临的重要公共健康问题。到2020年,美国50岁以上人群将有大约1 230万OP患者[3]。我国OP总患病率为 6.6%~19.3%[4],预计到2050年,我国骨质疏松性骨折患者将达599万,医疗花费高达254.3亿美元[5]。大量研究表明[6-9],补肾中药可以提高OP患者的骨密度,改善其疼痛症状,在防治OP方面具有独特的优势。
骨碎补(rhizoma drynariae)[10]为水龙骨科植物槲蕨的干燥根茎,其性温味苦,入肝、肾经,具有补肾强骨、疗伤止痛之功,用于跌扑闪挫、筋骨折伤、肾虚腰痛、筋骨痿软等症。研究表明[11-12],骨碎补提取物可诱导成骨细胞分化促进骨的合成代谢,防止骨量减少和骨小梁微结构的恶化,临床上可用于治疗OP等代谢性骨病,但其药效物质基础和分子机制尚不明确。因此,分析骨碎补的有效成分、作用靶点及潜在机制,从微观角度展开科学论证阐述,将有利于其临床推广应用。
2007年,Hopkins提出“网络药理学”(network pharmacology)一词[13]。其基于“疾病-基因-靶点-药物”作用网络,系统观察药物对疾病网络的干预与影响,为研究中药及复方提供了有效的策略,其整体性、系统性与中医学“天人合一”的整体观和辩证论治等理论特色与中药及复方多成分、多系统、多靶点协同作用的原理殊途同归。
本文将采用网络药理学方法探讨骨碎补抗OP的作用机制, 为深入研究骨碎补的抗OP作用提供参考依据。
1 资料与方法
1.1 资料
1.1.1骨碎补化学成分的收集:利用中药系统药理学数据库(traditional chinese medicine system pharmacology, TCMSP)和分析平台(http://lsp.nwu.edu.cn/tcmsp.php)搜索骨碎补的化学成分,通过PubChem数据库(http://pubchem.ncbi.nlm.nih.gov/)获取其分子结构,保存为SMILES格式。
1.1.2活性成分筛选:ADME指机体对外源化合物的吸收(absorption)、分布(distribution)、代谢(metabolism)及排泄(excretion)过程,ADME评价是对药物发现和开发的关键步骤。绝大部分中草药含多达50种甚至上千种化合物,但仅有少数化合物表现出具有潜在生物学效应的ADME特性[14],因此,迫切需要评估中草药成分对人体的影响和风险。口服生物利用度(oral bioavailability,OB)是指药物有效成分被机体吸收并发挥作用的速率和程度,是对药物筛选中最常见的药物动力学参数之一[15]。类药性(drug-likeness,DL)是指化合物与已知药物在官能团以及物理性质上的相似性[16],DL越大则认为该化合物与已知药物的相似性越高,通常以DL≥0.18为筛选标准[17]。本研究以OB≥30%、DL≥0.18作为筛选条件。
1.2 方法
1.2.1骨碎补作用靶点预测:Swiss数据库(http://www.swisstargetprediction.ch/)可基于分子的2D和3D结构与已知配体的相似度准确预测活性成分的靶点[18]。将SMILES依次输入Swiss,以“人类”为研究物种,整合去重得到骨碎补的作用靶点。
1.2.2疾病靶点获取:通过Disgenet数据库(http://www.disgenet.org/)检索“Osteoporosis”得到OP的相关基因及靶点蛋白。与上述作用靶点相映射,得到骨碎补治疗OP的潜在靶点。
1.2.3构建“骨碎补-活性化合物-潜在作用靶点”网络:将上述活性化合物和潜在靶点导入Cytoscape,绘制“骨碎补-活性化合物-潜在作用靶点”网络。节点(note)代表骨碎补、活性化合物和潜在靶点,边(edge)展现了三者的联系。通过“Network Analyzer”插件对网络进行拓扑分析,根据节点连接度(degree)和介数中心性(betweenness centrality)设置网络样式,节点大小反映degree大小,边的粗细反映betweenness centrality大小。
1.2.4构建蛋白质相互作用网络:String数据库 (search tool for the retrieval of interacting genes,http://string-db.org/)收集了大量通过实验检测和生物信息学方法得到的蛋白相互作用关系,共涉及9 643 763个蛋白和1 380 838 440个相互作用[19]。将骨碎补治疗OP的潜在靶点导入String,物种选“人类”,获取蛋白相互作用信息,把note1、note2和Combine score信息导入Cytoscape绘制蛋白相互作用网。
1.2.5靶点的生物功能及通路富集分析:DAVID数据库 (database for annotation,visualization and integrated discovery,https://david.ncifcrf.gov/)是一个高通量生物学信息注释数据库,能为大规模的基因或蛋白提供系统全面的生物学功能注释信息,进而挖掘其生物学意义[20]。将骨碎补的潜在靶点导入David数据库,物种限定“人类”,进行GO生物过程(gene ontology - biological process)和KEGG Pathway富集分析,筛选P<0.01的生物过程及P<0.05的信号通路,用Origin 2018绘图。
2 结果
2.1 骨碎补的活性成分及其分子结构
共收集到骨碎补的化合物71个,根据OB≥30%,DL≥0.18筛选得到18个活性成分(表1)。
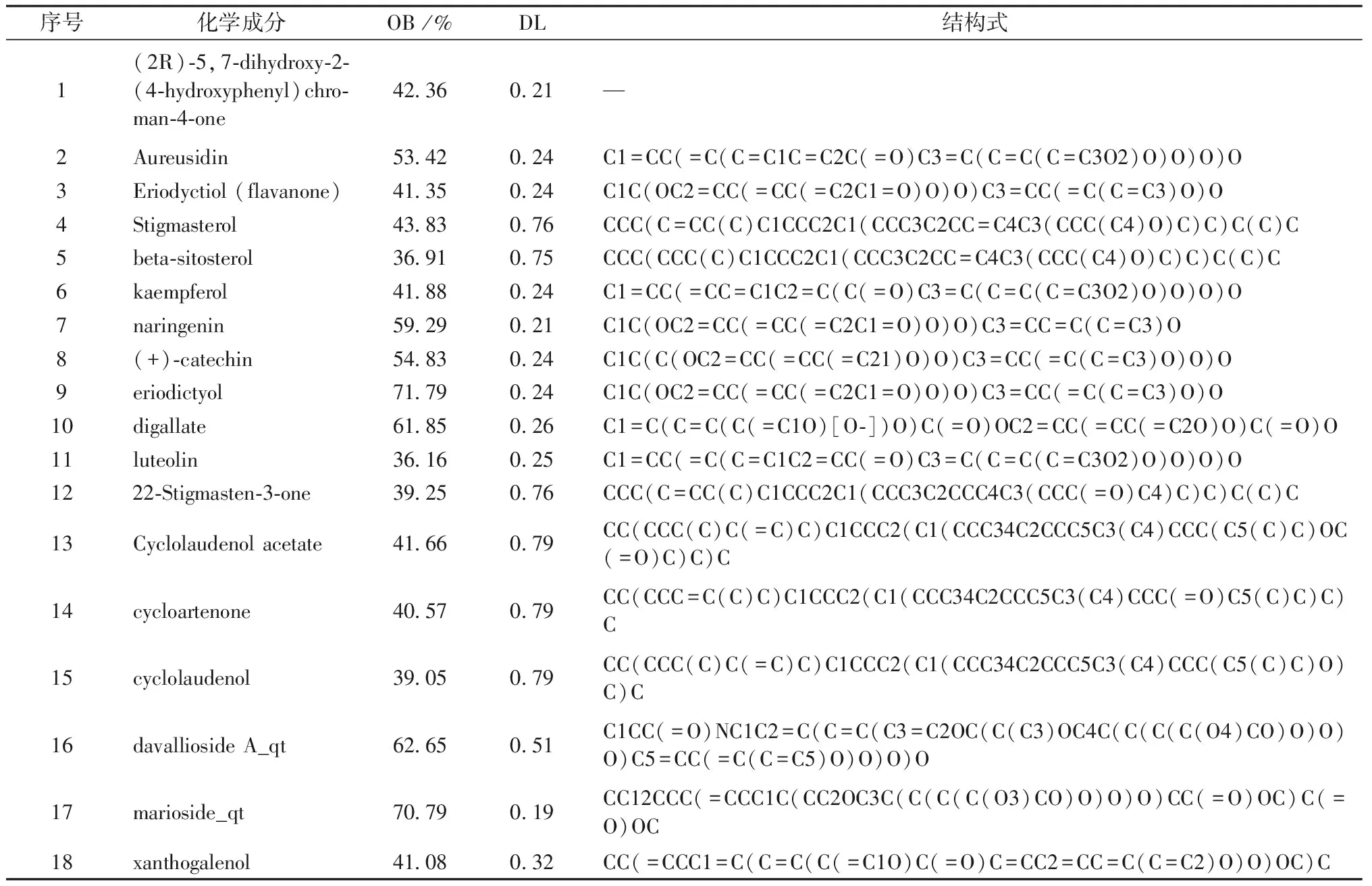
表1 骨碎补的潜在活性成分及其OB、DL值和分子结构式Table 1 Potential active compounds in Drynariae Rhizoma with OB and DL parameters and Canonical SMILES
2.2 骨碎补抗OP的潜在靶点
将Swiss数据库得到的预测靶点合并去重共得到141个预测靶点;检索Disgenet数据库得到OP疾病靶点464个;相映射得到骨碎补抗OP的潜在靶点24个(MMP1、CA2、ESR2、HSD17B1、ALOX12、NR3C1、CYP17A1、CYP1B1、HSD11B1、UGT2B17、ALOX15、AR、NOS3、ESR1、MMP13、LDLR、ERBB2、ABCB1、CYP19A1、CYP1A1、MMP2、STAT1、TRPV4、TRPV1)。见表2。
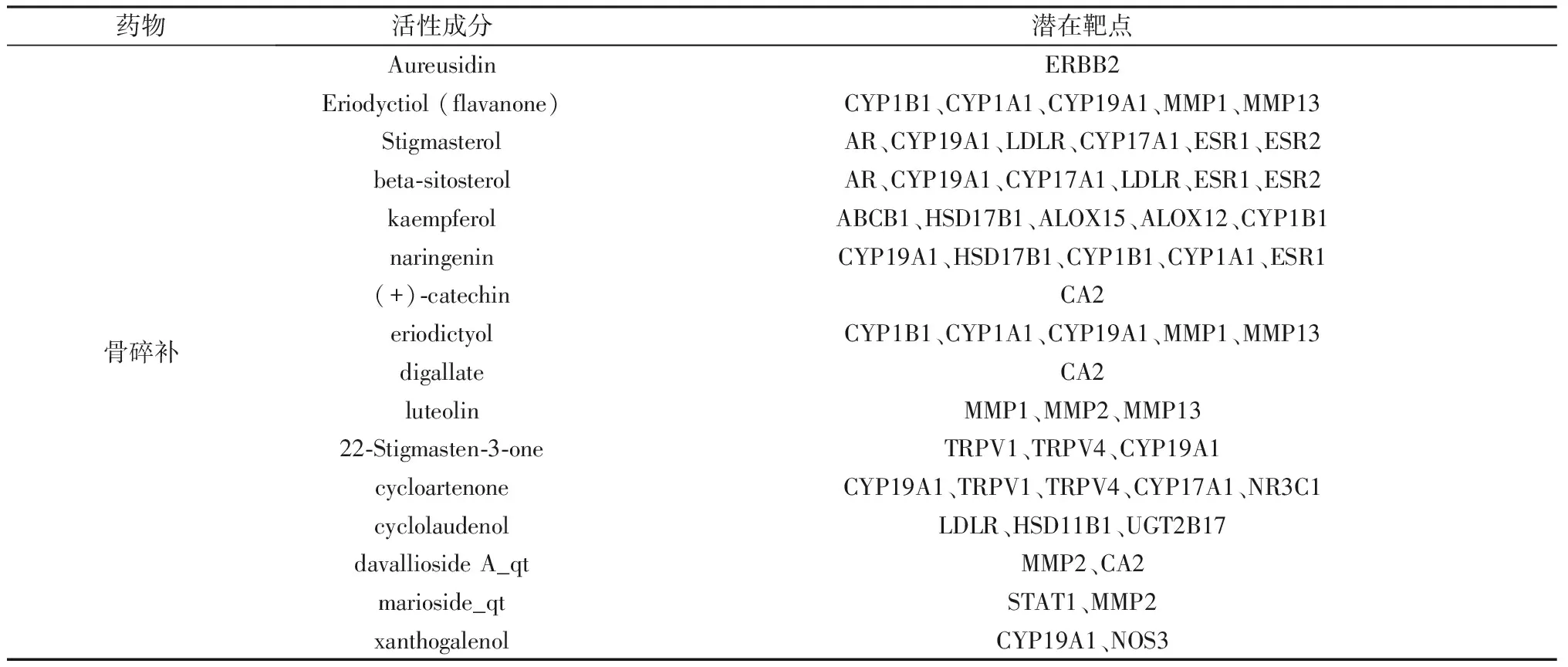
表2 骨碎补治疗OP的活性成分及潜在作用靶点Table 2 Active ingredients and key targets of Rhizoma Drynariae in treating OP
2.3 “骨碎补-活性化合物-潜在作用靶点”网络
将活性化合物和潜在靶点导入Cytoscape,得到“骨碎补-活性化合物-潜在作用靶点”网络,见图1。结果表明,成分豆甾醇(stigmasterol)、β-谷甾醇(beta-sitosterol)、黄烷酮(Eriodyctiol (flavanone))、山奈酚(kaempferol)、柚皮素(naringenin)、圣草酚(eriodictyol)和环木菠萝烷醇(cycloartenone)能与5个以上靶点连接,是骨碎补抗OP的主要成分;靶点CYP19A1与成分连接次数为8次,对骨碎补抗OP具有重要意义; CYP1B1为4次,MMP1、CA2、CYP17A1、ESR1、MMP13、LDLR、CYP1A1、MMP2均为3次,对骨碎补抗OP有较大意义。
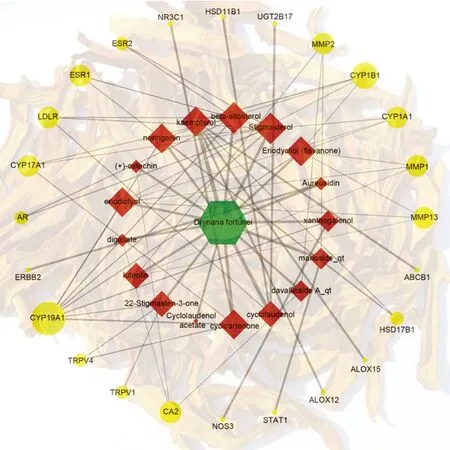
图1 “骨碎补-活性化合物-潜在作用靶点”网络(六边形节点:骨碎补;菱形节点:活性化合物;圆形节点:潜在靶点。节点大小代表其degree值大小,线条粗细代表betweenness centrality的大小)Fig.1 Active components- potential targets network of Drynariae Rhizoma (Hexagon node: Drynariae Rhizoma; rhomboid node: active compound; circular node: potential target. Node size represents its degree value size, and line thickness represents the size of betweenness centrality)
2.4 蛋白相互作用网络分析
将String数据库得到的蛋白相互作用信息(note1、note2和Combine score)导入Cytocape绘制蛋白相互作用网(图2)。图中包含23个节点和136条边(其中TRPV4与其他蛋白没有边连接,故不在蛋白相互作用网中体现),拓扑结构分析结果(表4)显示: 蛋白ESR1、CYP19A1、CYP1A1、ERBB2、AR、NR3C1、NOS3、CYP17A1、HSD17B1、MMP2的degree值均大于中位数6,认为其在骨碎补抗OP中起重要作用,其中靶点ESR1的degree值在中位数的2倍以上,可能为骨碎补抗OP的关键靶点。
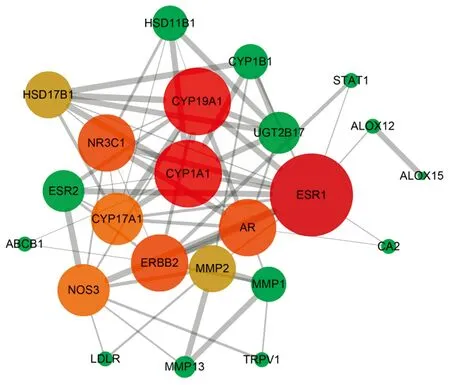
图2 蛋白相互作用网(节点大小代表degree的大小,边的粗细反映combine score的大小)Fig.2 Protein interaction network (node size represents the size of the degree, and the thickness of the lines reflects the size of the combine score)
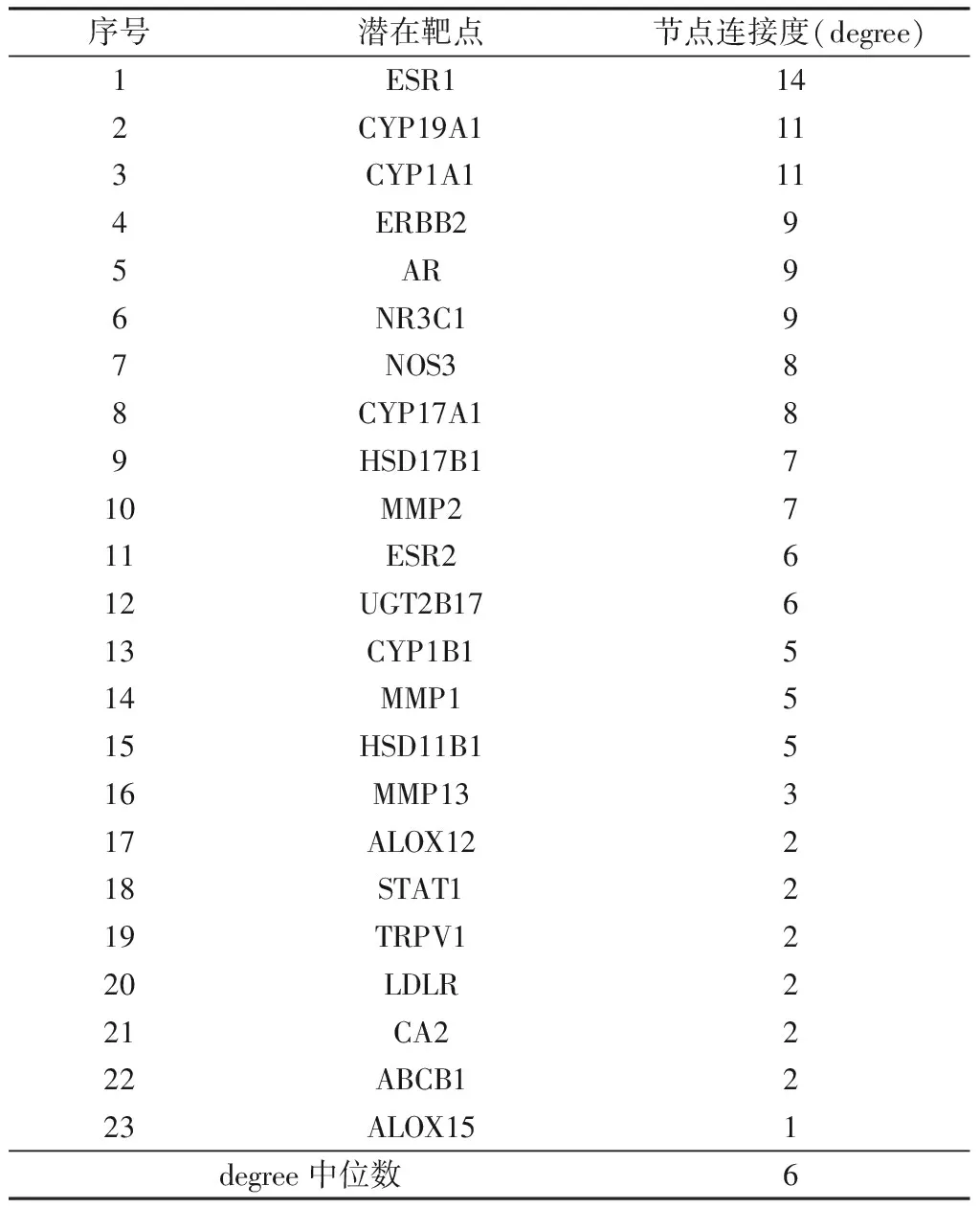
序号潜在靶点节点连接度(degree)1ESR1142CYP19A1113CYP1A1114ERBB295AR96NR3C197NOS388CYP17A189HSD17B1710MMP2711ESR2612UGT2B17613CYP1B1514MMP1515HSD11B1516MMP13317ALOX12218STAT1219TRPV1220LDLR221CA2222ABCB1223ALOX151degree中位数6
2.5 GO生物过程分析和KEGG通路富集分析
GO富集结果显示(图3),24个潜在靶点主要参与了oxidation-reduction process(氧化还原过程,8个靶点)、positive regulation of gene expression(基因表达正调控,5个靶点)、steroid metabolic process(类固醇代谢,4个靶点)、transcription initiation from RNA polymerase II promoter(RNA聚合酶Ⅱ启动子的转录起始,4个靶点)等生物学过程,表明骨碎补可通过多个生物学过程治疗OP;KEGG富集结果显示(见图4),骨碎补治疗OP主要涉及Metabolic pathways(代谢通路,9个靶点)、Steroid hormone biosynthesis(类固醇激素生物合成,7个靶点)、Ovarian steroidogenesis(卵巢类固醇生成,6个靶点)、Pathways in cancer(癌症通路,5个靶点)等通路,表明骨碎补可通过各通路协同发挥作用。
3 讨论
随着人口老龄化社会的快速发展,OP已在全球蔓延并成为重要的公共卫生疾病。抗OP药物的长期使用,尤其是双膦酸盐产生的胃肠道反应、肌肉骨骼、下颌骨坏死等不良反应逐渐被重视[21],治疗OP的新药仍在不断探索与研发中[22]。肾藏精主骨,肾精的盛衰决定骨的生长发育及衰弱。OP属中医学“骨痿”范畴,治当补肾为先。骨碎补长于补肾强骨,是治疗骨病的要药。文献[23-25]报道骨碎补在临床实践中具有抗OP作用。
本研究筛选出骨碎补的活性成分18个、潜在靶点24个和相互关系55个,涉及4条主要通路以及4个主要生物过程。“骨碎补-活性化合物-潜在靶点”网络显示,豆甾醇、β-谷甾醇、山柰酚、柚皮苷、圣草酚等有效成分能协同作用于多个靶点,显示了骨碎补抗OP具有多成分、多靶点的特点。Song等[27]研究表明柚皮素可降低骨转换标志物的水平、增加股骨强度和预防骨小梁微结构恶化。Pang等[28]发现柚皮素在促进成骨细胞增殖分化的同时可影响骨保护素(osteoprotegerin, OPG)的分泌,抑制破骨细胞的形成。另有研究[29]表明,柚皮素可改善血管内皮因子和VEGFR-2的表达,促进骨骼血管的生成。Chiou等[30]发现山奈酚能通过增强碱性磷酸酶(alkaline phosphatase, ALP)的活性,上调骨钙素、骨桥蛋白、Ⅰ型胶原蛋白mRNA表达,诱导骨结节形成,以此促进成骨细胞的分化增殖。
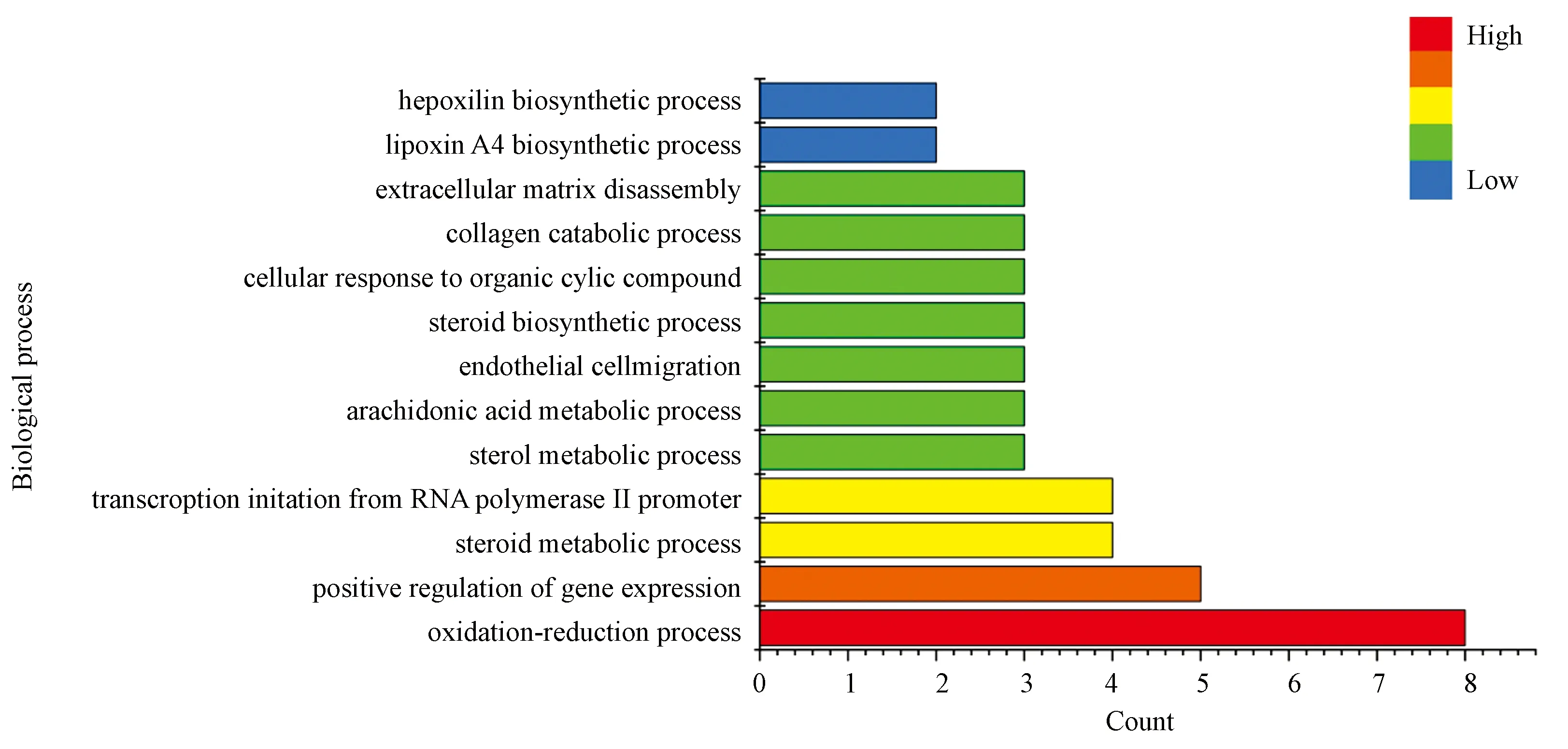
图3 骨碎补治疗骨质疏松潜在靶点的GO生物学过程富集分析Fig.3 Enriched gene ontology terms for GO biological processes of key targets from active ingredients of Drynariae Rhizoma
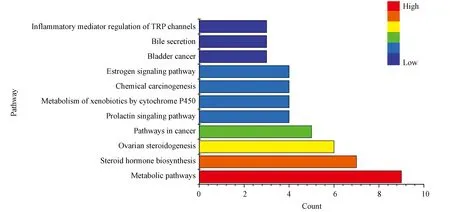
图4 骨碎补治疗骨质疏松潜在靶点的KEGG信号通路富集分析Fig.4 Enriched KEGG pathways of key targets from the main active ingredients of Drynariae Rhizoma
蛋白质相互作用网络表明骨碎补的靶蛋白之间并非单独发挥作用,而是一个复杂交错的网络。这些靶点的共同作用、共同调节可能是骨碎补治疗OP的机制。其中ESR1编码雌激素受体(estrogen receptor, ER)蛋白。临床上,作用于ER的选择性雌激素受体调节剂(selective estrogen receptor modulator, SERMs)被广泛地应用于绝经后骨质疏松症并取得良好疗效[31]。 Pang等[28]证实了柚皮素通过雌激素受体(ER)-依赖途径,激活在UMR 106成骨样细胞中ERα磷酸化,从而发挥成骨作用。这些文献报道与本文中预测的ESR1靶点一致,说明了本文的预测靶点具有可靠性。另有文献[32]在雌激素相关的基因多态性与绝经后妇女骨密度之间的潜在联系的研究中,提示CYP1A1细胞的CG单倍型可能在OP的发病机制中起到重要作用,但其分子机制仍有待探究。同时表4中CYP1A1的degree值为11,暗示其可能为骨碎补发挥作用的主要靶点。另外,CYP19A1、ERBB2、AR、NR3C1这4个靶点的degree值大于9,这为骨碎补治疗OP的分子作用基础给出了新的预测,为进一步研究提供了新线索。
KEGG富集分析表明,骨碎补治疗OP主要涉及的通路有代谢通路、类固醇激素生物合成、卵巢类固醇生成、癌症通路等。有研究[33]表明,23.5%的男性和18.2%的女性患有骨质疏松性非椎体骨折,在代谢综合征患者中的发生率显著升高。肥胖、血脂异常、高血糖和高血压等代谢异常状态是与OP发生有关的因素[34]。实验[35-38]表明,上述状态下的小鼠皮质骨骨密度、骨骼强度、骨钙素和骨镁含量均出现下降。慢性低度炎症是肥胖的一个标志,其特点是在全身循环中大量分泌各种炎症标志物。高水平的促炎细胞因子通过激活NF-κβ受体激活因子配体(receptor activator of NF-κβ ligand, RANKL)/ NF-κβ受体激活因子(receptor activator of NF-κβ, RANK)/OPG途径刺激破骨细胞分化和骨吸收[39-40]。研究表明[41],糖尿病小鼠肿瘤坏死因子α (tumor necrosis factor - α, TNF-α)、巨噬细胞集落刺激因子和RANKL的mRNA表达显著升高,导致骨形成和骨强度下降。糖尿病晚期的糖基化终产物(advanced glycation end products, AGEs)的积累也会导致骨质量和强度低下[42]。高血压和OP都与钙代谢异常相关,高血压与高氯化钠摄入量有关[43],由于肾近端钙离子与钠离子的竞争,导致尿钙排泄增加[44]。
代谢通路和OP的联系与循环的“葡萄糖-矿物质-皮质激素”相关[45],这就涉及另外两条通路:类固醇激素生物合成和卵巢类固醇生成。研究[46]发现,雌激素水平降低是绝经后骨质疏松症的最强风险因素之一。雌激素缺乏会增加血清RANKL水平,使得许多抗酒石酸酸性磷酸酶 (tartrate-resistant acid phosphatase, TRAP) 阳性破骨细胞在股骨组织中形成和活化[47]。黄体期缺陷和孕酮水平的降低亦会导致骨丢失[48]。研究[49]表明,雄激素水平在绝经期过渡期间会降低,并可能导致骨质流失。国外一项对于老年男性的研究[50]表明,雌激素主要调节骨吸收,而雌激素和睾酮均可维持骨形成。GO富集结果显示,骨碎补对OP的影响主要通过氧化还原过程(8个靶点),基因表达的正调节(5个靶点),类固醇代谢过程(4个靶点),RNA聚合酶II启动子的转录起始(4个靶点)等发挥作用,在上述阐释中亦有体现。
综上,网络药理学结果显示骨碎补的18个活性成分作用于24个潜在靶点,涉及多种过程、分子和通路,体现了骨碎补多成分、多靶点、多途径的作用特点。基于网络药理学分析药物与疾病靶点的相互网络关系能有效地揭示骨碎补抗OP的可能机制,其多成分、多靶点、多途径的特点也体现了中医学“天人合一”的整体观念和辩证论治等理论特色,对中医药的推广运用有一定参考价值。

