哈维氏弧菌PspF基因的克隆及原核表达分析
马少鸿,黄郁葱,简纪常,蔡双虎
哈维氏弧菌基因的克隆及原核表达分析
马少鸿,黄郁葱,简纪常,蔡双虎
(广东海洋大学水产学院 // 广东省水产经济动物病原生物学及流行病学重点实验室,广东 湛江 524088)
【】对哈维氏弧菌()ZJ0603的基因进行克隆与原核表达分析,优化表达条件。克隆哈维氏弧菌菌株ZJ0603的基因,对其编码蛋白进行理化性质、信号肽、亚细胞定位、二级结构及三级结构分析,构建表达载体pET28a-,经HI和I双酶切和测序鉴定正确后转入表达菌株大肠杆菌BL21,对表达重组菌株进行表达条件优化及Western Blot鉴定。基因的开放阅读框(ORF)全长为1 179 bp,编码336个氨基酸,分子质量为38.04 ku,理论等电点5.27,不稳定系数41.97,总平均亲水性-0.382,PspF蛋白整体表现为亲水性蛋白。成功构建含pET28a-的表达菌株,其最佳诱导条件为37 ℃下异丙基---硫代半乳糖苷(IPTG) 0.2 mmol/L诱导6 h,其表达蛋白为38 ku。Western Blot结果表明PspF重组蛋白成功获得,蛋白同源性高,具有作为抗弧菌病疫苗的潜力。
哈维氏弧菌;基因;原核表达;表达优化
哈维氏弧菌()是一种主要分布于海洋的革兰阴性菌,兼性厌氧,嗜盐,是多种海水动物的常见致病菌[1],其在适宜温度下可快速生长繁殖为优势菌种,通过口、鳃及体表等途径侵染养殖动物[2],致使养殖动物大批量死亡,在大西洋棘白鲳()[3]、对虾()[4]、石斑鱼(sp)[5]、大黄鱼()[6]和线纹海马()[7]等多种养殖经济动物都爆发过大规模弧菌病,严重危害海水养殖业的发展。
PspF蛋白为噬菌体休克蛋白(Phage shock protein)操纵子转录激活因子,其能激活噬菌体休克蛋白系统表达[8]。噬菌体休克蛋白系统是一种应激反应途径,能够感知和响应细胞膜的损伤,由PspABCD操纵子和PspG基因组成[8],在大肠杆菌中的转录是由含有替代因子σ54的DNA依赖性RNA聚合酶驱动[9],广泛存在于临床相关的如大肠杆菌()、耶尔森氏菌()和霍乱弧菌()[10-12]等革兰阴性细菌中。的表达是组成型表达,且可自我负调控,在细胞内低浓度表达,控制着操作子和的表达[13-16]。在大肠杆菌中,PspA与PspF蛋白相互结合形成抑制复合物,Psp系统处于沉默状态,当细胞膜受到刺激,会导致PspA重新定位到细胞质膜,与PspBC复合,也可能通过直接的膜接触,PspF诱导PspA表达,导致PspA、-B和-C浓度增加,PspA和PspD控制ArcB/ArcA系统的活性水平从而感知细胞的氧化还原/代谢状态[17],在细菌应激缓解中发挥作用。
目前,对Psp系统的研究报道主要集中在大肠杆菌、小肠结肠炎耶尔森氏菌和霍乱弧菌()等革兰阴细菌[9-11]的结构功能及作用机理方面,对于哈维氏弧菌噬菌体休克蛋白系统中PspF蛋白的研究尚处于空白阶段。本研究拟首次从哈维氏弧菌基因组扩增出基因,利用生物信息学分析初步分析其PspF蛋白表征,构建表达质粒菌株,优化表达菌株的表达条件,以期为哈维氏弧菌PspF蛋白作为亚单位疫苗的可能性研究提供基础。
1 材料与方法
1.1 材料
1.1.1 菌株和载体 哈维氏弧菌菌株ZJ0603分离自患病斜带石斑鱼()并保存于广东省水产经济动物病原生物学及流行病学重点实验室。实验中所用克隆载体为Takara pMD18-T,感受态细胞为北京全式金生物公司生产的大肠杆菌()Transα和BL21(DE3),表达载体pET-28a由本实验室保存。
1.1.2 主要试剂 细菌基因组DNA提取试剂盒、Easy Pure PCR Purification Kit试剂盒和质粒提取试剂盒(Easy Pure Plasmid MiniPrep Kit)购自赛默飞世尔科技(Thermo Fisher Scientific)公司;Premix RxTaq DNA聚合酶、T4 DNA连接酶和QuickCut限制酶购自Takara公司;卡那霉素、氨苄青霉素、IPTG和TTBS购自海生工生物工程公司。
1.2 方法
1.2.1基因的克隆 参考细菌基因组DNA提取试剂盒说明书提取哈维氏弧菌ZJ0603的基因组。根据GenBank上已公布的弧菌基因序列,分别设计含HI和I酶切位点的上下游引物,上游引物F:5′-CGGGATCCATGAAGCAAAACC TCATCGGT-3′(HI),下游引物R: 5′-CCCTCG AGTTATCCT TGACCAACTAAGCCAT -3′(I)。以哈维氏弧菌的全基因组为模板链扩增基因,PCR反应体系为50 μL,反应条件为 95 ℃ 5 min;94 ℃ 30 s,53.2 ℃ 40 s,72 ℃ 1 min,34 个循环;72 ℃延伸10 min。扩增的目的片段用纯化试剂盒纯化,再将纯化产物与载体pMD18-T连接,16 ℃连接2 h后转化至感受态细胞transα,经无抗性的LB液体培养1 h后涂布于添加了质量浓度为100 μg/mL卡那霉素的LB平板上,37 ℃倒置培养12 h,挑取单菌落进行菌落PCR鉴定,序列鉴定由广州生工生物公司完成。
1.2.2生物信息学分析 在线网站NCBI ORF finder获得目的基因的开放阅读框和蛋白的氨基酸序列, ExPASy PASy-Prot分析PspF蛋白的理论等电点、疏/亲水性情况、相对分子质量等理化性质;Signal P 4.1 Server测序预测PspF蛋白的信号肽的存在情况;Psort.hgc预测PspF蛋白的亚细胞定位;SOPMA和SWISS-MODEL分别分析其二级结构和三级空间结构,对氨基酸序列进行蛋白序列BLAST比对,ClustalW软件分析其同源性。
1.2.3 表达载体pET28a-的构建 参照质粒提取试剂盒说明书对测序正确的pMD18T-和 pET-28a载体分别提取质粒用HI和I酶切后经T4连接酶连接后转入大肠杆菌BL21(DE3)感受态中。经扩大培养后涂布平板,挑取单菌落进行菌落PCR鉴定,鉴定为阳性的菌落扩大培养后送广州生工生物公司测序,保证新构建表达载体pET28a-在表达中不会发生移码。
1.2.4 重组蛋白的诱导表达 将含pET28a-重组质粒的大肠杆菌BL21(DE3)以体积分数1.0%接种量接种于LB液体培养基(含100 μg/mL kan+),37 ℃、200 r/min培养,每隔1 h测一次(600 nm)值。当(600 nm)达0.4~0.6时,向培养基中加1 mmol/L 诱导剂IPTG进行诱导表达,以不诱导的含pET28a-的 BL21(DE3)为对照组。37 ℃再次震荡培养4 h后离心收集菌液,PBS洗净后水煮法提取细菌蛋白进行十二烷基硫酸钠聚丙烯酰胺凝胶(SDS-PAGE)电泳分析。
1.2.5 表达条件优化 采用控制变量法,分别在不同温度、时间、异丙基---硫代半乳糖苷IPTG浓度条件下对重组菌株pET28a-的表达条件进行优化。
温度:当(600 nm)值达到0.4~0.6,在20 ℃、37 ℃,IPTG浓度为1 mmol/L条件下诱导4 h后,4 ℃低温离心收集15 mL菌液,并用磷酸盐缓冲液(PBS)清洗并悬浮菌液,置于冰上超声破碎细菌,超声破碎程序设置为:功率300 W,超声开时间4 s,超声关时间8 s,超声破碎约 20 min至菌液澄清透亮时即停止。4 ℃低温离心后分装上清和沉淀,用8 mol/L的尿素在4 ℃条件下溶解沉淀12 h,SDS-PAGE电泳后考马斯亮蓝染色并用Gel-pro Analyzer分析结果。。
时间:其他处理条件不变情况下,分别在诱导0、2、4、6、8和12 h时收集菌液,水煮法破碎蛋白后,离心取上清进行SDS-PAGE电泳后考马斯亮蓝染色并用Gel-pro Analyzer分析结果。
IPTG诱导浓度:其他处理条件不变情况下,IPTG诱导剂终浓度梯度设置为0、0.2、0.4、0.6、0.8和1.0 mmol/L 进行诱导,水煮法破碎蛋白后,离心取上清进行SDS-PAGE电泳后考马斯亮蓝染色并用Gel-pro Analyzer分析结果。
1.2.6 Western blot分析 在最佳表达条件下诱导处理重组菌株,取上清进行His标签纯化融合蛋白,SDS-PAGE电泳后以低温、200 mA、150 min条件转移至聚偏氟乙烯PVDF膜,用塑料制的镊子取出PVDF膜浸泡在含质量分数5%脱脂奶粉的封闭液中,浸泡条件为4 ℃、12 h,TTBS溶液清洗4次(10 min/次,后面步骤同)加鼠抗His-Tag单克隆抗体(体积比1∶1000稀释)室温摇晃孵育2 h,TTBS清洗加HRP-Tag山羊抗鼠IgG室温摇晃孵育2 h,TTBS清洗后使用BAD显色液在避光条件下显色5 min,ddH2O终止反应并拍照观察结果。
2 结果
2.1 PspF基因扩增及生物信息学分析
PCR扩增获得特异条带(图1),条带大小与预测的开放阅读框大小一致。对该片段测序结果进行序列比对分析,发现其与其它弧菌的相似性较高,其中与欧文氏弧菌()同源性高达96.13%,表明克隆得到的基因为基因。
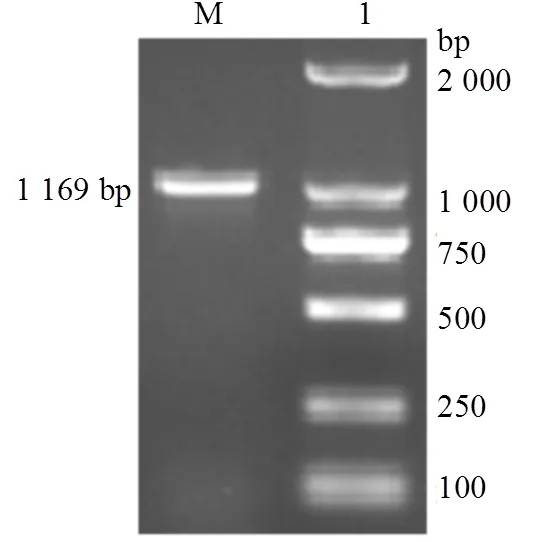
M:DL2000 DNA 分子标准;1:PspF基因克隆产物
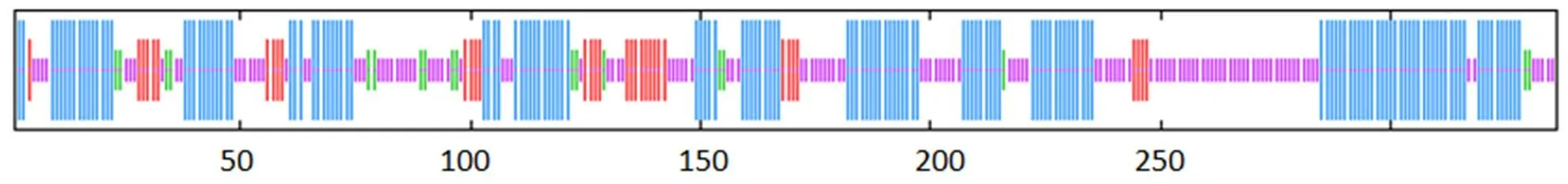
生物信息学分析发现哈维氏弧菌基因开放阅读框ORF为981 bp,共编码326个氨基酸,编码的PspF蛋白理论分子质量为38.04 ku,理论等电点5.27,不稳定系数41.97,脂肪系数95.86,总平均亲水性-0.382,表明该蛋白整体表现为亲水性。该蛋白N端无明显的信号肽切割位点,氨基酸序列含有2个蛋白激酶C磷酸化位点,7个酪蛋白激酶II 磷酸化位点,2个酪氨酸激酶磷酸化位,3个N端酰基化位点,3个微体C末端靶信号位点(第57 ~ 59位氨基酸),1个SIGMA-54相互作用结构域B特征ATP结合区和Sigma-54交互域C端标记部件,具体位置如图2所示。

酪蛋白激酶 II 磷酸化位点为下划线标记,蛋白激酶 C磷酸化位点为阴影标志,酪氨酸激酶磷酸化位点为下标波浪线,N端酰基化位点为方框标志,加粗代表微体C-末端靶信号位,首端ATG为启动子,尾端* TAA为终止子
将PspF氨基酸序列分别使用SOPMA和SWISS-MODEL分析其二级结构和三级结构,其结果表明PspF蛋白中α-螺旋占45.24%,无规卷曲所占比38.99%,延伸链占比10.42%,β-转角占比5.36%(图3、4)。
蓝色:α-螺旋;绿色:β-折叠;紫色:无规则卷曲;红色:延伸链
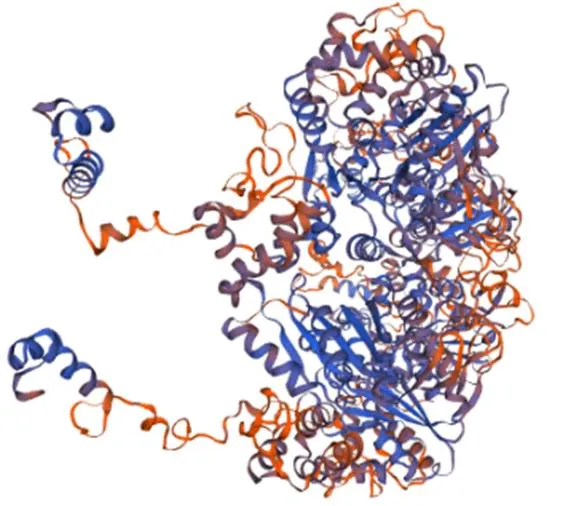
图4 PspF蛋白预测三级结构
2.2 重组表达载体pET28a-PspF的诱导表达
将基因与pET-28a连接后转入表达菌株BL21(DE),测序后比对序列,结果发现构建的pET28a-没有发生移码,表明表达载体pET28a-成功构建。用1 mmol/L IPTG 37 ℃诱导4 h后提取菌体蛋白,SDS-PAGE电泳分析结果表明,未诱导的质粒pET28a和pET28a-诱导前后没有出现预期的表达蛋白条段,而用IPTG诱导的重组载体pET28a-表达得到一条约38 ku的蛋白条带(图5),证明基因在表达载体中成功表达。
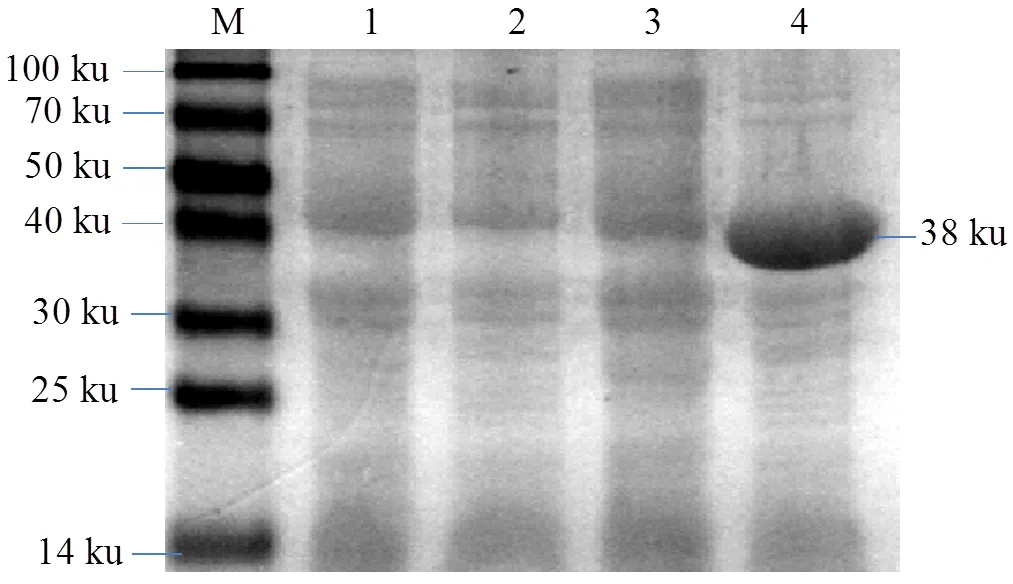
M:100 ku蛋白分子标准;1、2:空载pET28a诱导前、后的全菌蛋白;3、4:pET28a-PspF重组质粒诱导前后的全菌蛋白
2.3 pET28a-PspF表达条件的优化
2.3.1 温度对重组蛋白表达的影响 温度优化结果表明表达载体pET28a-在20 ℃和 37 ℃条件下上清和包涵体中均有表达,且包涵体的表达均高于上清,在37 ℃条件下上清和包涵体蛋白表达量略高于20℃。
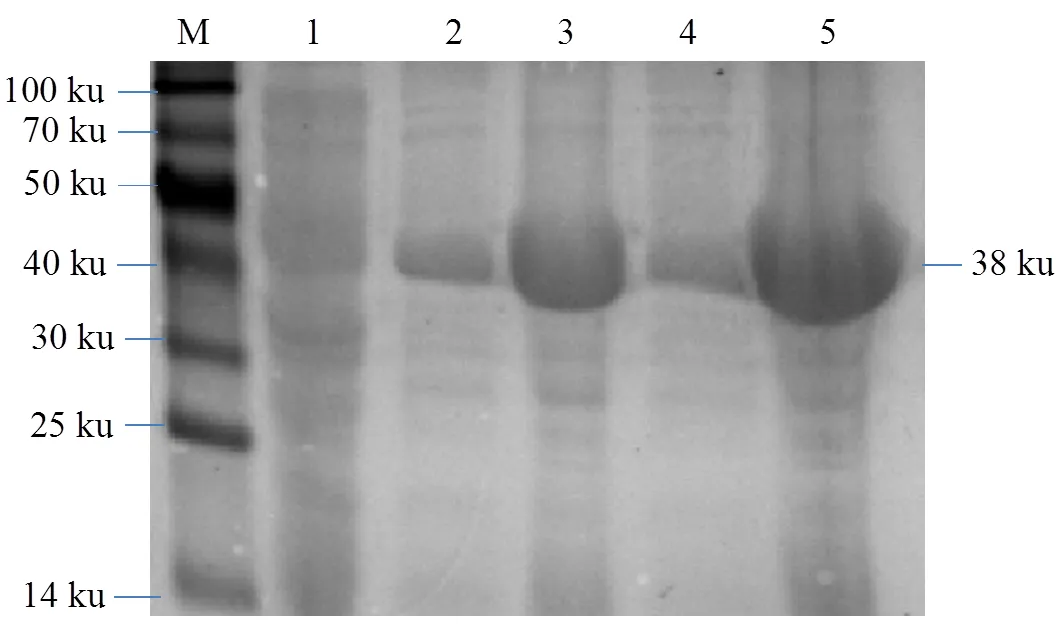
M:100 ku蛋白质分子标准;1:未诱导的全菌蛋白;2、3:温度20 ℃诱导的可溶性蛋白和包涵体蛋白;4、5:温度37 ℃下诱导的可溶性和包涵体蛋白
2.3.2 IPTG诱导时间对重组蛋白表达的影响 优化诱导时间结果表明,融合蛋白表达量随诱导时间先增加后稳定,6 h时表达量达到最大后表达量不再升高,故选诱导时间为6 h。

M:100 ku蛋白质分子标准;1:未诱导的全菌蛋白;2―8:诱导0、2、4、6、8、10、12 h后融合蛋白的表达
2.3.3 IPTG诱导剂诱导浓度对重组蛋白表达的影响 PspF重组蛋白IPTG诱导浓度优化结果(图8)表明,未诱导的全菌蛋白(泳道1)没有发现融合蛋白的表达条带,0.2~1.0 mmol/L IPTG诱导后均有目的蛋白条出现,且0.2 mmol/L时有较高的蛋白表达量,故最佳诱导浓度为0.2 mmol/L IPTG。

M:100 ku蛋白质分子标准;1:未诱导全菌蛋白;2―6:IPTG诱导浓度分别为 0.2、0.4、0.6、0.8、1.0 mmol/L
综合上述结果,pET28a-表达的最佳条件为37 ℃下IPTG浓度为0.2 mmol/L时诱导6 h。
2.4 Western blot分析
在37 ℃,0.2 mmol/L IPTG浓度的条件下对重组菌株和诱导6 h,将细胞破碎后取上清进行纯化,Western blot结果如图9,纯化后诱导的重组菌株全菌蛋白出现单一目的条带,且大小符合预测值,而未诱导重组菌株无条带出现,说明而未诱导重组菌株无条带出现,说明表达蛋白与His-Tag单克隆抗体结合,PspF蛋白表达成功。

M:蛋白质分子标准;1:纯化后的上清蛋白;2:未诱导的全菌蛋白
3 讨论
细菌通过监测自身的内部和外部环境,辅助以基因调控而大量繁殖。细胞内外部环境的唯一障碍是细胞膜和周质空间,其决定了细胞形态、能量产生、提供保护、同时保持对营养物质的渗透性,是许多其他重要细胞过程的场所[18-20]。在细菌侵入宿主体内后,面临温度、渗透压和酸碱度的变化,从而导致细菌细胞包膜蛋白错配和误导,改变膜的性质,甚至破坏膜的渗透屏障。宿主会分泌胆汁盐、其他表面活性剂和抗菌肽等物质攻击细菌的细胞包膜。为了防止对细胞包膜的损伤,细菌有一种称为胞质外应激反应(ESR)的信号转导系统,用来监测膜室的完整性。ESR反应的研究大多为革兰阴性细菌[19-20],一旦启动了ESR,细菌体内蛋白质就能恢复细胞内稳态的功能[21]。革兰阴性菌具有许多特征性的ESR,包括σe、Cpx、Bae、Rcs和噬菌体休克蛋白反应(Psp)。Psp系统由操纵子和基因组成,在弧菌对抗宿主的免疫反应攻击及适应宿主体内环境中发挥重要的作用。一般情况下,PspA与PspF蛋白相互结合形成抑制复合物,Psp系统处于沉默状态,当膜破裂发生时,PspA重新定位到细胞质膜,与PspBC复合。也可能通过直接的膜接触,PspF诱导PspA表达,由PspB和PspC感知,然后PspA释放PspF,PspABC转录发生,产生保护反应[9-10, 21-22]。Psp反应最初是从F1丝状噬菌体感染大肠杆菌时被发现[10],随后这种蛋白命名被为噬菌体休克蛋白A(PspA),并确定其产生是由噬菌体基因产物PIV诱导的[22]。随着研究的深入,这种反应不仅限于噬菌体感染,许多其他应激源,如乙醇、热、渗透性休克和固定相生长也是诱导物[22-25]。
本研究通过克隆哈维氏弧菌基因全长序列,该基因编码的PspF氨基酸序列与其它弧菌的PspF相似性较高,其中与欧文氏弧菌()同源性高达96.13%,三级结构预测显示PspF蛋白和其他弧菌的PspF蛋白构型相似,因此推测哈维氏弧菌PspF蛋白具有抗弧菌共同抗原的潜力,但需要进一步进行原核表达、免疫原性和免疫保护性的验证。本研究对原核表达进行条件优化,实验结果表明,重组蛋白的表达和诱导条件有关,且包涵体表达的量比较大,其原因可能是新PspF多肽浓度较高,未及时在胞内进行折叠导致非结晶、无定形的蛋白质聚集形成包涵体[26],表达量在低浓度的IPTG诱导下即可获得较高表达,在诱导时间方面,表达量随时间先上升后稳定,其可能因胞内某种酶的活性受到限制[27]。Western-blotting表明PspF 融合表达的蛋白与标签蛋白His单克隆抗体相互结合,说明其成功表达。
目前,弧菌是海水经济动物的常见致病菌之一,其对种类多、繁殖快,严重危害海水养殖业的发展。对于弧菌的治疗主要采用抗生素的手段,但在长期大量使用抗生素会引发一系列问题,如耐药菌株的产生[28],破坏养殖微生态平衡[29],残留鱼体的药物会影响食用鱼的安全等,因此,寻找代替途径显得尤为重要,而其中之一就是制备针对弧菌病的疫苗。
4 结论
本实验克隆了哈维氏弧菌基因,得到1 179 bp碱基序列,与pET-28a(+)连接后,转化入BL21(DE3)中构建了重组菌株。确定最优表达条件为37 ℃下,0.2 mmol/L 的 IPTG诱导6 h,表达蛋白为38 ku,通过生物信息分析后,其蛋白的同源性高,具有作为抗弧菌病疫苗的潜力。
[1] AUSTIN B, ZHANG X.: a significant pathogen of marine vertebrates and invertebrates[J]. Letters in Applied Microbiology, 2010, 43(2): 119-124.
[2] 李洋, 李强, 张显昱. 哈维弧菌及其主要致病因子的研究进展[J]. 中国农业科技导报, 2014, 16(4): 159-166.
[3] ALVAREZ, AUSTIN, ALVAREZ, et al.: a pathogen of penaeid shrimps and fish in Venezuela[J]. Journal of Fish Diseases, 2010, 21(4): 313-316.
[4] HUANG H H, LIU X L, XIANG J H, et al. Selection of-resistantvia a three-round challenge selection with a pathogenic strain of[J]. Fish & Shellfish Immunology, 2013, 35(2): 328-333.
[5] TALPUR, DAD A, IKHWANUDD.(neem) leaf dietary effects on the immunity response and disease resistance of Asian seabass,challenged; with[J]. Fish & Shellfish Immunology, 2013, 34(1): 254-264.
[6] 吴立婷, 廖金轩, 庞茂达, 等. 大黄鱼中哈维氏弧菌毒力及耐药特性分析[J].食品安全质量检测学报, 2019, 10(8): 2111-2119.
[7] 李营, 王波, 张培玉, 等. 哈维氏弧菌引起的条纹海马表皮溃疡综合征的研究[J].水产学报, 2019, 43(5): 1-17.
[8] MODEL P, JOVANOVIC G, DWORKIN J. Thephage shock protein operon[J]. Molecular Microbiology, 1997, 24(2): 255-261.
[9] DARWIN A. The phage-shock-protein response[J]. Molecular Microbiology, 2010, 57(3): 621-628.
[10] JOVANOVIC G, LLOYD L J, STUMPF M P, et al. Induction and function of the phage shock protein extracytoplasmic stress response in.[J]. Journal of Biological Chemistry, 2006, 281(30): 21147-21161.
[11] DEANGELIS C M, NAG D, WITHEY J H, et al. Characterization of thephage shock protein response[J]. Journal of Bacteriology, 2019, 201(14): 1-46
[12] WEINER L, BRLSSETTE J L, RAMANL N, et al. Analysis of the proteins and cis-acting elements regulating the stress-induced phage shock protein operon[J]. Nucleic Acids Research, 1995, 23(11): 2030-2036
[13] JOVANOVIC G, DWORKIN J, MODEL P. Autogenous control of, a constitutively active enhancer-binding protein of[J]. Journal of Bacteriology, 1997, 179(16): 5232-5237.
[14] JOVANOVIC G, MODEL P. PspF and IHF bind co-operatively in thepromoter-regulatory region of[J]. Molecular Microbiology, 2010, 25(3): 473-481.
[15] DWORKIN J, JOVANOVIC G, Model P. Role of upstream activation sequences and integration host factor in transcriptional activation by the constitutively active prokaryotic enhancer-binding protein[J]. Journal of Molecular Biology, 1997, 273(2): 377-388.
[16] LLOYD L J, JONES S E, JOVANOVIC G, et al. Identification of a new member of the phage shock protein response in, the phage shock protein G () [J]. Journal of Biological Chemistry, 2004, 279(53): 55707-55714.
[17] SILHAVY T J, KAHNE D, WALKER S. The bacterial cell envelope[J]. Cold Spring Harbor Perspectives in Biology, 2010, 2(5):1-17
[18] ROWLEY G, SPECTOR M, KORMANEC J, et al. Pushing the envelope: extracytoplasmic stress responses in bacterial pathogens.[J]. Nature Reviews Microbiology, 2006, 4(5): 383-394.
[19] 尹清干, 程俊茗, 刘腾飞, 等. 环境因子对鳗弧菌生物膜形成的影响[J]. 微生物学通报, 2018, 45(1): 138-145.
[20] 吴同垒, 王洪彬, 张志强, 等. 几个理化因素对哈维氏弧菌生物被膜形成的影响[J]. 水产学杂志, 2019, 32(1): 35-39.
[21] YAMAGUCHI S, REID D A, ROTHENBERG E, et al. Changes in Psp protein binding partners, localization and behavior upon activation of thephage shock protein response[J]. Molecular Microbiology, 2013, 87(3): 656-671.
[22] ROWLEY G, SPECTOR M, KORMANEC J, et al. Pushing the envelope: extracytoplasmic stress responses in bacterial pathogens[J]. Nature Reviews Microbiology, 2006, 4(5): 383-394.
[23] BRISSETTE J L, RUSSEL M, WEINER L, et al. Phage shock protein, a stress protein of[J]. Proceedings of the National Academy of Sciences of the United States of America, 1990, 87(3): 862-866.
[24] WEINER L, MODEL P. Role of anstress-response operon in stationary-phase survival[J]. Proceedings of the National Academy of Sciences of the United States of America, 1994, 91(6): 2191-2195.
[25] DARWIN A. The phage-shock-protein response[J]. Molecular Microbiology, 2010, 57(3): 621-628.
[26] 冯小黎. 重组包涵体蛋白质的折叠复性[J]. 生物化学与生物物理进展, 2001, 28(4): 482-485.
[27] PATNAIK P R . Investigation of induction effect on the steady state performance of a continuous fermentation for recombinant β-ga1actosidase[J]. Process Biochemistry, 2001, 36(11): 1069-1074.
[28] 海水养殖源弧菌耐药性调查及基因在弧菌中的流行情况研究[D]. 上海:上海海洋大学, 2016.
[29] 党宏月, 宋林生, 张志南. 海水养殖环境细菌耐药性的危害[J]. 海洋科学集刊, 2006, 47(1): 29-40.
Cloning and Prokaryotic Expression ofGene from
MA Shao-hong, HUANG Yu-chong, JIAN Ji-chang, CAI Shuang-hu
(,//,524088,)
【】Thegene ofZJ0603 was cloned and expressed in prokaryotic, and the expression conditions were optimized. 【】Thegene instrain ZJ0603 was cloned, and its physical and chemical properties, signal peptide, subcellular localization, secondary structure and tertiary structure were analyzed. The expression vector pET28a and the PCR product of the amplified FspF gene were digested withHI andI. The pET28a-expression construct was produced after ligation of the digested vector and insert with T4 DNA ligase. The recombinant plasmid was transformed intoBL21(DE3), and the expression conditions of the recombinant strain were optimized and identified by Western Blot. 【】The open reading frame ofgene was 1179 bp in length, encoding 336 amino acids, the relative molecular weight and the theoretical isoelectric point was 38.04 ku and 5.27 respectively. The instability coefficient of the deduced protein were 41.97, and the total average hydrophilicity was -0.382. The optimal induction conditions for the expression of pET28a-were adding 0.2 mmol/L IPTG at 37 ℃ for 6 h, and the expressed protein was 38 ku in size. Western Blot results showed thatrecombinant protein was successfully obtained. The protein has high homology and potential as an anti-Vibrio vaccine.
;gene; prokaryotic expression; expression optimization
S941.4;Q786
A
1673-9159(2019)05-0001-07
10.3969/j.issn.1673-9159.2019.05.001
2019-05-10
广东省科技计划(2016A020209010);广东省自然科学基金(2017A0303030975)
马少鸿(1994-),男,硕士研究生,研究方向为水生动物病害防控。E-mail:937025291@qq.com
蔡双虎(1979—),男,教授,研究方向为水生动物病害防控研究。E-mail:cshcai@163.com
马少鸿,黄郁葱,简纪常,等. 哈维氏弧菌基因的克隆及原核表达分析[J]. 广东海洋大学学报,2019,39(5):1-7.
(责任编辑:刘朏)

