波纹龙虾蜕壳周期的呼吸排泄和血淋巴生理学
卓宏标,郑秋耀,梁华芳,廖永岩,潘海洋,罗嘉俊,温崇庆
波纹龙虾蜕壳周期的呼吸排泄和血淋巴生理学
卓宏标1,郑秋耀1,梁华芳1,廖永岩2,潘海洋1,罗嘉俊1,温崇庆1
(1. 广东海洋大学水产学院,广东 湛江 524088;2. 广西北部湾海洋生物多样性养护重点实验室,北部湾大学,广西 钦州 5350091)
【】研究波纹龙虾()蜕壳周期内呼吸排泄、血淋巴生化指标和免疫酶活力的变化。选取蜕壳后期(A期和B期)、蜕壳间期(C期)和蜕壳前期(D0,D1,D2,D3期)的波纹龙虾测定耗氧率和排氨率,并测定血淋巴中的离子含量、总蛋白含量和血细胞数量及免疫酶活力。波纹龙虾的耗氧率和排氨率从蜕壳后期到蜕壳间期均显著降低。耗氧率在D0期显著上升,而排氨率在蜕壳前期逐渐减少,在D3期达到最低水平。血清Ca2+含量在D1期最高,并显著高于A期(< 0.05)。K+含量在D1期则最低,在蜕壳周期中整体变化不显著(> 0.05)。Mg2+和无机磷(Phos) 含量在蜕壳周期中也无显著变化(> 0.05)。血淋巴总蛋白含量在蜕壳后大幅减少,至蜕壳间期又显著提升(<0.05),但与蜕壳前期相比差异不显著(> 0.05)。血细胞数量在D2期最高,而 B期最低,分别为4.22×107和2.40×107mL-1。酚氧化酶活力在蜕壳周期中呈先下降后上升的变化趋势,而一氧化氮合酶活力在A期最低,在其他时期之间未发现显著性差异(>0.05)。波纹龙虾的呼吸排泄、血淋巴生化指标和免疫酶活力与蜕壳周期密切相关。
波纹龙虾;蜕壳周期;呼吸排泄;血淋巴生化指标;免疫酶活力
周期性蜕壳是甲壳类动物健康生长、发育和繁殖的重要保证,是影响甲壳类存活的重要因素。广义的蜕壳是一个连续的变化过程[1],最初由Drach[2]将其划分为蜕壳期、蜕壳后期、蜕壳间期和蜕壳前期等4个时期。国外对甲壳类蜕壳周期的研究起步较早,在组织学和生理学等方面有大量报道[3-4],研究发现,蜕壳由内源激素信号通路网络所调控,受多种外源生态因子影响,生理过程复杂[5]。近年来,我国在甲壳类蜕壳生理方面已取得不少进展。但当前的养殖生产过程存在许多不稳定因素,诸如蜕壳成活率波动较大、同步化蜕壳水平偏低、性早熟等问题影响着产业的发展,迫切需要开展更深入研究以指导和解决实际生产问题[5]。波纹龙虾()是富有市场潜力和经济价值的物种,迄今鲜见关于其蜕壳周期生理生化变化的报道。基于梁华芳、黄东科等[6-8]对波纹龙虾的养殖生物学研究,为深入探究其蜕壳周期生理变化特征,本研究分析波纹龙虾不同蜕壳时期的呼吸代谢、血淋巴生化指标和免疫酶活力的变化,为波纹龙虾和其他甲壳类的蜕壳生理研究提供参考。
1 材料与方法
1.1 实验动物
波纹龙虾为捕自自然海区体质量2 ~ 5 g的幼龙虾,养殖于20 m3的水泥池中,用黑幕布遮光,24 h 连续充气。实验海水为经沉淀、砂滤自然海区海水,盐度26 ~ 30,pH 8.1 ~ 8.3。每日投喂菲律宾蛤仔()和杂色蛤仔() 等鲜活饵料2 ~ 3次,投喂量占体质量的5% ~ 8%;每天换水、吸污1次,保持水质良好。待生长至体质量达到70 ~ 80 g时,开始正式实验。
1.2 蜕壳时期判定和样品采集
参照Radhakrishnan[9]的方法,将波纹龙虾的蜕壳周期划分为:蜕壳后期(A期和B期)、蜕壳间期(C期)和蜕壳前期(D0,D1,D2,D3期),波纹龙虾 [体质量(73.49±2.12)g] 不同蜕壳时期通过显微镜(OLYMPUS, 10×) 观察其尾扇内肢的刚毛形态来判断。确定蜕壳时期后,每一蜕壳时期随机取龙虾10尾,停饲1 d,测定龙虾的耗氧率和排氨率。用吸水纸擦干体表水分,用2 mL无菌注射器从第4步足基部取血,每尾取血淋巴2 mL,分装成两管,一管用于血细胞计数,另一管置于4℃冰箱12 h后,离心,取血清,用于测定生化指标和免疫酶活力。耗氧率和排氨率测定及血样采集在分别16: 00和19: 00进行。
1.3 指标测定
1.3.1 耗氧率和排氨率测定 采用静水密闭式呼吸实验方法[6],将不同蜕壳时期的波纹龙虾移入条件一致的4 L呼吸室内避光处理2 h,用虹吸法取各呼吸室内的水样于溶解氧瓶和50 mL比色管,随后封闭呼吸室。封闭后2 h用同种方法采集不同蜕壳时期实验组和空白对照组水样,溶解氧测定采用Winkler法[10],氨氮测定采用靛酚蓝法[11],氨氮测定前水样须经0.45 μm滤膜处理。实验水温27.8℃,盐度28.0。
1.3.2 血淋巴生化指标 血清中Ca2+、Mg2+和K+含量使用通过原子吸收光谱仪(Thermo ICE3500)测定,无机磷(Phos)含量测定按照血清无机磷检测试剂盒(北京雷根生物技术有限公司)说明书进行。血淋巴总蛋白测定使用考马斯亮蓝蛋白测定试剂盒(南京建成生物工程研究所生产),以牛血清白蛋白作标准,540 nm处测光密度,绘制标准曲线,样品蛋白含量由标准曲线求得。
采用血球计数板(25×16),结合Olympus相差显微镜进行血细胞计数,仅计总血细胞数,取2个样品的平均数,按照以下公式计算血细胞密度。
总血细胞密度/mL-1= 每小格平均细胞数×4 000 000×稀释倍数
血涂片的制作与染色参考杨景山[12]的方法,血细胞分类则参考黄翔鹄[13]的方法。每尾波纹龙虾观察3块血涂片,在显微镜(Olympus,100×)下随机选取30个血细胞进行分类计数,最终统计不同类型血细胞的比例。
1.3.3 一氧化氮合酶活力 一氧化氮合酶活力(NOS)测定按照检测试剂盒(南京建成生物工程研究所)说明书进行。根据NOS催化-Arg 和分子氧反应生成NO,NO与亲核性物质生成有色化合物,用紫外分光光度计(METASH UV-6100A)测定在530 nm波长下样品光密度值,推算出NOS活力(U×mL-1)。
1.3.3 酚氧化酶活力 酚氧化酶活力(PO) 测定参照李贺水等[14]的方法,分别在96孔酶标板中加入样品10 μL,0.1 mg/mL胰蛋白酶90 μL,100 μL 磷酸盐缓冲液(PBS)和0.01 mol/L-Dopa溶液100 μL。在酶标仪(680,Bio-Rad)中震荡4次,于20 ℃下孵育,每2 min读取490 nm波长下的光密度值(490 nm)。将实验条件下(490 nm) 每分钟增加0.001定义为1个酶活力单位。
1.4 数据处理与分析
数据处理使用Excel 2010软件进行;用统计软件SPSS 17.0进行单因素方差分析,各处理平均值用Duncan方法进行多重比较,以< 0.05为差异显著水平,< 0.01为差异极显著水平。
2 结果与分析
2.1 波纹龙虾在不同蜕壳时期的耗氧率和排氨率
由图1可见,波纹龙虾在蜕壳周期中的耗氧率呈先降后升的变化趋势。波纹龙虾在C期时耗氧率最低,平均0.14 mg×g-1×h-1,与其他各期差异显著(< 0.05),蜕壳后期(D期)和前期(A、B期)间耗氧率无明显变化(> 0.05)。波纹龙虾在蜕壳周期中的排氨率呈下降趋势。A期排氨率平均值最高,至C期时出现大幅度下降,至D3期时最低,为
5.89 μg×g-1×h-1。
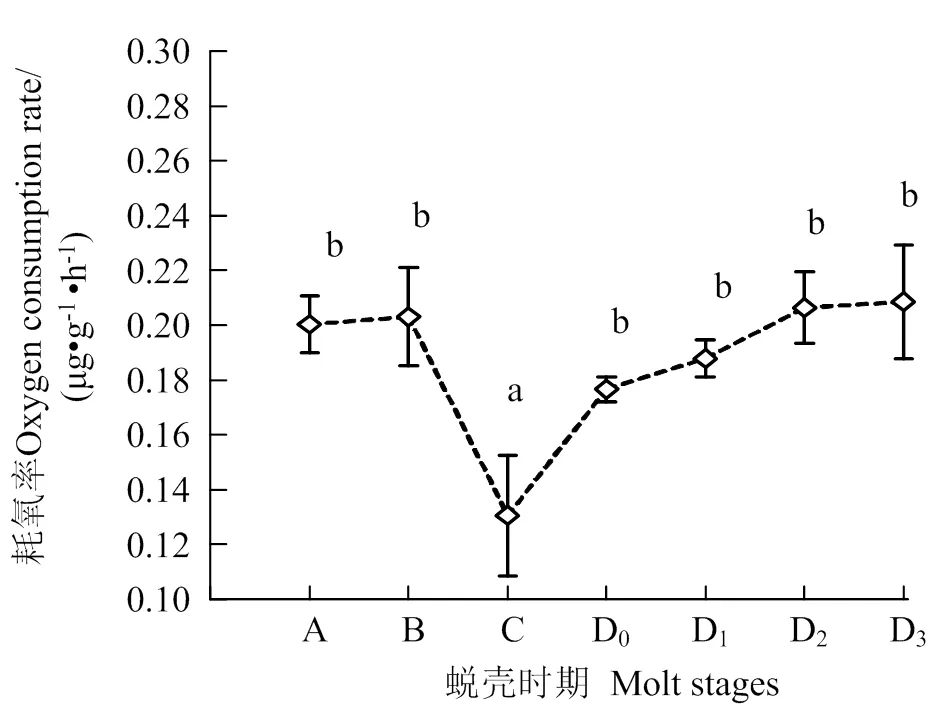
凡含一个相同字母者表示不同处理组间差异无统计学意义(P > 0.05)
2.2 波纹龙虾在不同蜕壳时期的血清离子含量
波纹龙虾在不同蜕壳时期的血清Ca2+、Mg2+、K+和Phos含量见图2。Ca2+含量在D1期平均值最高(15.71 mmol×L-1),且显著高于A期(< 0.05)。K+浓度为(9.39±0.54) ~ (12.68±0.45) mmol×L-1,从D1期到D2期显著提升(< 0.05),但整个蜕壳周期整体上差异无统计学意义(> 0.05)。Mg2+和Phos含量在蜕壳周期中变化均无统计学意义(> 0.05)。
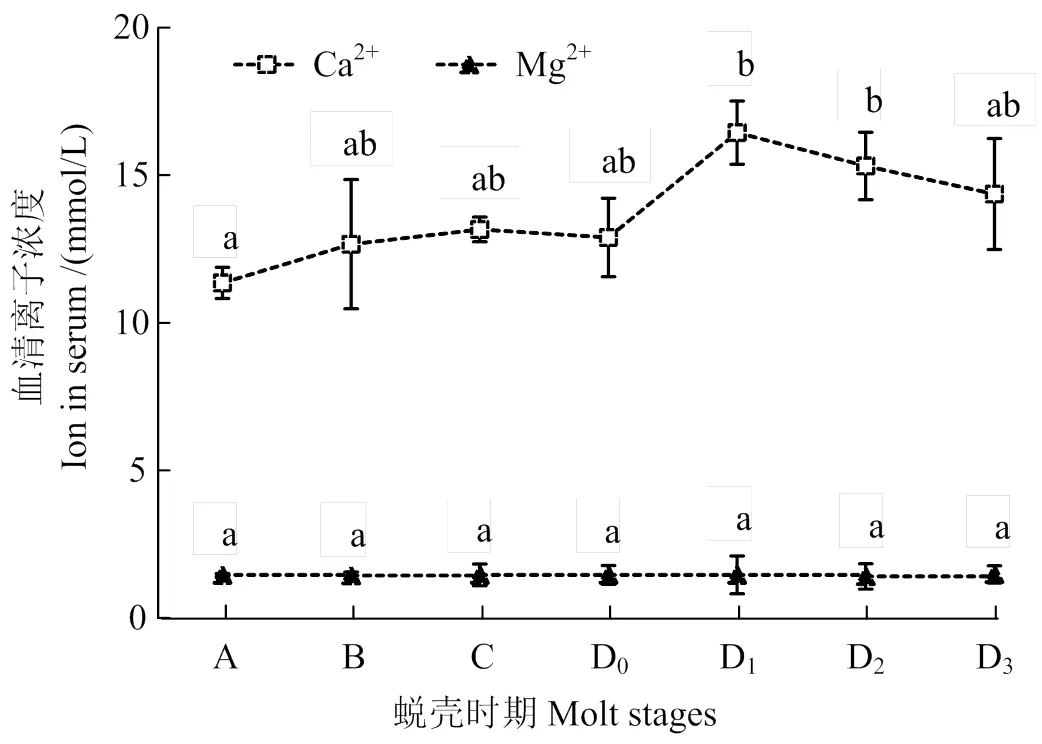
凡含一个相同字母者表示不同处理组间差异无统计学意义 (> 0.05)
The data with a same letter mean no significant difference between them (> 0.05)
图2 波纹龙虾血淋巴在不同蜕壳期的Ca2+、Mg2+、K+和Phos浓度
Fig. 2 Contents of K+, Ca2+, Mg2+and Phos in hemolymph ofin relation to molt stages
2.3 波纹龙虾在不同蜕壳时期的血淋巴总蛋白含量
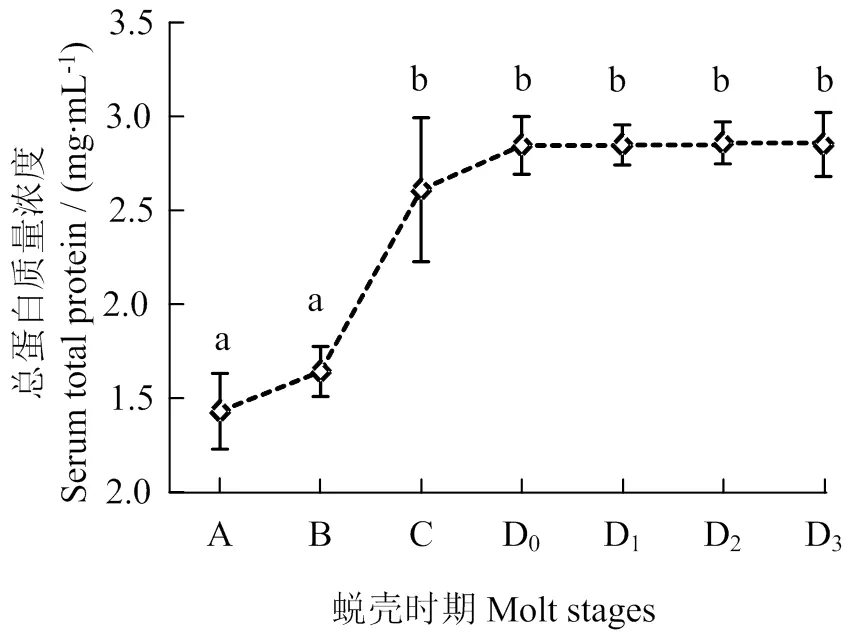
由图3可见,血淋巴总蛋白含量在蜕壳后期无显著性差异,C期时显著提升(< 0.05)。C期血淋巴总蛋白含量与蜕壳前期(D0– D3期)无显著性差异,但蜕壳后期(A、B期)显著下降(< 0.05)。
2.4 波纹龙虾在不同蜕壳时期的血细胞数量
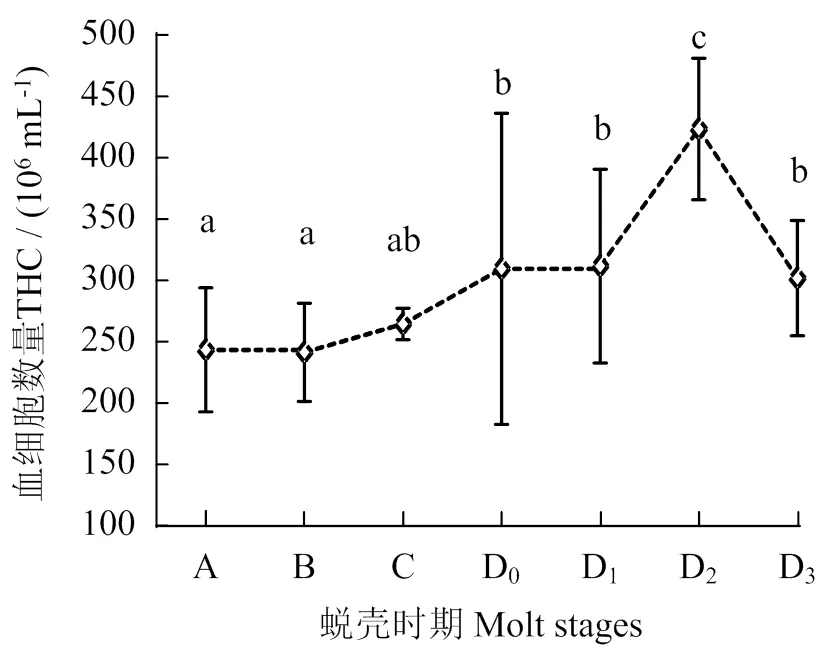
波纹龙虾不同蜕壳时期的血细胞数量见图4。由图4可知,蜕壳前期的血细胞数量显著高于蜕壳后期(< 0.05),其中,D2期的血细胞数量最多,为42.15×106mL-1。蜕壳后期血细胞数量与C期的差异无统计学意义(> 0.05)。
凡含一个相同字母者表示不同处理组间差异无统计学意义 (P > 0.05)
2.5 波纹龙虾血淋巴在不同蜕壳时期的酚氧化酶和一氧化氮合酶活力
波纹龙虾血淋巴不同蜕壳时期的酚氧化酶和一氧化氮合酶活力变化见图5。从图5可见,酚氧化酶活力在蜕壳后期和C期无显著差异(> 0.05),从D0至D1期时显著升高(< 0.05),酶活力平均值达到最高(40.78 U×mg-1)。A期一氧化氮合酶活力平均值最低,为20.97 U×mL-1,B期时急剧上升,在C期和蜕壳前期的一氧化氮合酶活力差异无统计学意义(> 0.05)。
凡含一个相同字母者表示不同处理组间差异无统计学意义 (P > 0.05)
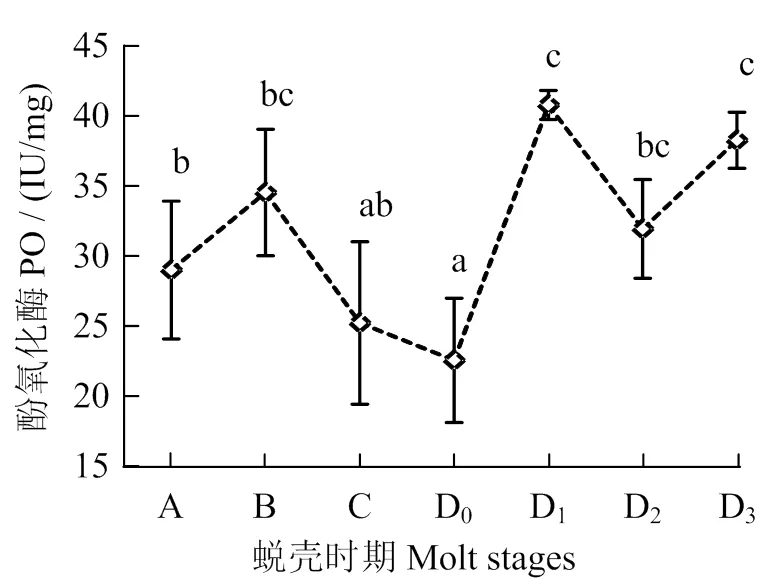
凡含一个相同字母者表示不同处理组间差异无统计学意义 (P > 0.05)
3 讨论
3.1 波纹龙虾蜕壳周期内的耗氧率和排氨率变化
甲壳动物的新陈代谢与耗氧量、排氨量密切相关[15],其耗氧率和排氨率可直接或间接反映其生理状态。但甲壳动物耗氧率和排氨率不仅受温度、盐度[16]、氨氮浓度[17]以及照度[18]等多种外源因子影响,还与其体质量有关。研究发现,波纹龙虾耗氧率和排氨率随个体质量的增加而降低[6],这与美洲管对虾()[19]和褐虾()[20]等研究结果较为一致。
波纹龙虾在蜕壳前期与后期的耗氧率显著高于蜕壳间期,其原因在于蜕壳前后需进行形态和生理上的准备,包括蜕壳前旧壳的吸收与新表皮的分泌,以及蜕壳后新壳的硬化与蛋白质的快速合成[19]等,机体代谢活动旺盛,消耗大量能量,耗氧量也随之增加[21]。有研究指出,罗氏沼虾()蜕壳后期和蜕壳期的能量消耗是蜕壳间期的两倍以上[22]。蜕壳也影响氮代谢物排泄,是导致蜕壳后的排氨率大幅增加的重要内源因素[19],Regnault[23]认为主要与体内蛋白质的分解有关,这与本研究中蜕壳前后血淋巴蛋白含量的骤减结果相符。而蜕壳前期排氨率下降可能与蜕壳前波纹龙虾摄食减少甚至停止摄食有关。
3.2 波纹龙虾蜕壳周期内的血淋巴生化指标变化
血淋巴蛋白是血淋巴的主要成分,参与各项生理活动,也可作为短期的能量储备[24]。在蜕壳后期,摄食尚未开始,血淋巴蛋白水平的显著降低与其作为重要能量来源被消耗有一定关联。对锯缘青蟹()[25]的报道指出,蜕壳后大量吸水导致血淋巴蛋白含量被稀释2 ~ 3倍。蜕壳间期是物质积累期,波纹龙虾需大量摄食,以完成组织生长,故其血淋巴蛋白含量相比蜕壳后期显著升高。
血淋巴中包含Ca2+、Mg2+和K+等多种重要离子,这些离子不仅是外骨骼的重要组成成分,也对维持机体渗透压平衡和生理功能有重大意义[26]。在甲壳动物周期性蜕壳中,外骨骼的矿化离不开一些重要离子的重吸收。研究[27-31]表明,在蜕壳周期内,美洲鳌虾()和印度对虾()血淋巴渗透压发生变化,钙、钾、镁、磷等离子在角质层与血淋巴间双向运动,但本研究中,波纹龙虾血淋巴钾、镁和磷离子含量在蜕壳周期中变化不显著。在外骨骼矿化中发挥作用的主要是Ca2+,甲壳类在蜕壳前从旧壳中重吸收Ca2+,经血淋巴转运至肝胰脏贮藏[30],这可能是导致本研究中D1和D2期Ca2+含量显著高于A期的原因。
本研究中,血细胞数量在蜕壳后期最低,至蜕壳间期时升高,与凡纳滨对虾(),日本对虾()和斑节对虾()等的研究结果一致[32-33]。波纹龙虾在蜕壳后期的血细胞数量较低主要是由于身体吸收大量水分,降低了血细胞的密度。
3.3 波纹龙虾蜕壳周期内的免疫酶活力变化
酚氧化酶主要分布于血淋巴,是甲壳动物先天免疫防御系统的重要成员[35],被视为波纹龙虾及其他甲壳类应对环境胁迫的免疫敏感指标[36-37]。蜕壳过程往往是机体十分脆弱的时期,易受敌害侵袭和病菌感染。因此,蜕壳后期的酚氧化酶活力显著高于蜕壳间期。研究还表明,酚氧化酶参与了蜕壳后角质层的形成[38-39],这可能是导致其蜕壳后期的活性显著低于蜕壳前期的重要原因。然而,在凡纳滨对虾的研究中发现,在蜕壳间期的酚氧化酶活力较高[40],与本研究结果存在差异,可归因于物种差异、蜕壳分期标准或不同蜕壳时期的持续时间长短等。
据报道,一氧化氮合酶参与了蜕壳抑制激素调控蜕壳激素的信号通路网络,且Y器官中蜕壳激素浓度与一氧化氮合酶的表达呈正相关[41-42]。结合血淋巴中蜕壳激素和蜕壳抑制激素在蜕壳周期中的变化情况[43-44],推测波纹龙虾血淋巴的一氧化氮合酶活力在蜕壳后的显著下降是其参与蜕壳活动的结果。但在蜕壳间期保持的较高活力,也说明一氧化氮合酶在机体中参与其他重要的生理过程[45-46]。
[1] 王克行, 吴琴瑟, 纪成林, 等. 虾蟹类增养殖学[M]. 北京: 中国农业出版社, 1997: 28-30.
[2] DRACH P. Mue et cycle d'intermue chez les Crustacés Décapodes[J]. Ann Inst Oceanogr Monaco, 1939, 19: 103-391.
[3] PRATOOMCHAT B, SAWANGWONG P, PAKKONG P , et al. Organic and inorganic compound variations in haemolymph, epidermal tissue and cuticle over the molt cycle in(Decapoda)[J]. Comparative Biochemistry and Physiology Part A: Molecular and Integrative Physiology, 2002, 131(2): 243-255.
[4] LIPCIUS R N , HERRNKIND W F. Molt cycle alterations in behavior, feeding and diel rhythms of a decapod crustacean, the spiny lobster[J]. Marine Biology, 1982, 68(3): 241-252.
[5] 李旭光, 周刚, 谷孝鸿. 水生甲壳类蜕壳发生过程及其影响因素的研究与进展[J]. 动物学杂志, 2014, 49(2): 294-302.
[6] 黄东科, 梁华芳. 盐度和体质量对波纹龙虾耗氧率和排氨率的影响[J]. 广东海洋大学学报, 2012,32(4): 8-11.
[7] 黄东科, 梁华芳, 张志, 等. 温度对波纹龙虾存活、摄食、蜕壳和生长的影响[J]. 生态学报, 2017,37(18): 5973-5980.
[8] 黄东科, 梁华芳, 温崇庆, 等. 温度对波纹龙虾消化酶活力的影响[J]. 渔业现代化, 2017, 44(6): 32-36.
[9] RADHAKRISHNAN E V. Physiological and biochemical studies on the spiny lobster[D]. Kochi: Central Marine Fisheries Research Institute, 1989.
[10] 中华人民共和国国家质量监督检验检验总局, 中国国家标准化管理委员会. GB 17378. 7—2007海洋监测规范第4部分海水分析[S]. 北京: 中国标准出版社, 2007.
[11] 蒋岳文, 陈淑梅, 马英. 靛酚蓝分光光度法测定海水中氨氮最佳条件的选择[J]. 海洋环境科学, 1997(4): 44-48.
[12] 杨景山. 医学细胞化学与细胞生物技术[M]. 北京:北京医科大学、中国协和医科大学联合出版社, 1990.
13] 黄翔鹄, 李长玲, 刘楚吾. 光镜及扫描电镜下波纹龙虾血淋巴细胞的形态及其分类[J]. 水产学报, 2004,28(6): 645-650.
[14] 李贺水, 曾勇, 栾青. 注射白斑综合征病毒对克氏原螯虾酚氧化酶活力的影响[J]. 淡水渔业, 2017, 47(2): 30-35.
[15] DAGG M J. Complete carbon and nitrogen budgets for the carnivorous amphipod,(Krøyer) [J]. Internationale Revue der gesamten Hydrobiologie und Hydrographie, 1976, 61(3): 297-357.
[16] 王吉桥, 罗鸣, 张德治, 等. 水温和盐度对南美白对虾幼虾能量收支的影响[J]. 水产学报, 2004,28(2): 161-166.
[17] 邹李昶, 任夙艺, 王志铮, 等. 氨氮急性胁迫对日本沼虾()死亡率、耗氧率及窒息点的影响[J]. 海洋与湖沼, 2015, 46(1): 206-211.
[18] 王馨, 王芳, 路允良, 等. 光照强度对三疣梭子蟹呼吸代谢的影响[J]. 水产学报, 2014, 38(2): 237-243.
[19] CARVALHO P S M, PHAN V N. Oxygen consumption and ammonia excretion during the moulting cycle in the shrimp[J]. Comparative Biochemistry and Physiology Part A, 1998, 119(3): 839-844.
[20] REGNAULT M. Ammonia excretion of the sand-shrimp(L.) during the moult cycle[J]. Journal of Comparative Physiology, 1979, 133(3): 199-204.
[21] 牛东红. VC和VE对日本沼虾蜕皮周期中呼吸代谢和抗氧化酶的影响[D]. 保定:河北大学, 2004.
[22] STERN S, COHEN D. Oxygen consumption and ammonia excretion during the molt cycle of the freshwater prawn(De Man)[J]. Comparative Biochemistry and Physiology Part A: Physiology, 1982, 73(3): 417-419.
[23] REGNAULT M. Nitrogen excretion in marine and fresh-water crustacea[J]. Biological Reviews, 1987, 62(1): 1-24.
[24] UGLOW R F. Haemolymph protein concentrations in portunid crabs—II. The effects of imposed fasting on[J]. Comparative Biochemistry and Physiology, 1969, 31(6): 959-967.
[25] CHEN J C, CHIA P G. Oxyhemocyanin, protein, osmolality and electrolyte levels in the hemolymph ofin relation to size and molt cycle[J]. Journal of Experimental Marine Biology and Ecology, 1997, 217(1): 93-105.
[26] WILDER M N, IKUTA K, ATMOMARSONO M, et al. Changes in osmotic and ionic concentrations in the hemolymph ofexposed to varying salinities and correlation to ionic and crystalline composition of the cuticle[J]. Comparative Biochemistry & Physiology Part A: Molecular & Integrative Physiology, 1998, 119(4): 941-950.
[27] PASSANO L M. Molting and its control[M] // WATERMAN T H, ed. The physiology of Crustacea, 1. New York: Academic Press, 1960: 473-536.
[28] MERCALDO-ALLEN R. Changes in the blood chemistry of the American lobster,, H. Milne Edwards, 1837, over the molt cycle[J]. J Shellfish Res, 1991, 10(1): 147-156.
[29] ROER R, DILLAMAN R. The structure and calcification of the crustacean cuticle[J]. American Zoologist, 1984, 24(4): 893-909.
[30] GREENAWAY P. Calcium balance and moulting in the Crustacea[J]. Biological Reviews, 1985, 60(3): 425-454.
[31] VIJAYAN K K, DIWAN A D. Fluctuations in Ca, Mg and P levels in the hemolymph, muscle, midgut gland and exoskeleton during the moult cycle of the Indian white prawn,(Decapoda: Penaeidae)[J]. Comparative Biochemistry and Physiology Part A: Physiology, 1996, 114(1): 91-97.
[32] 丁森. 海水和淡水条件下不同蜕壳时期凡纳滨对虾()生理生态学的比较研究[D].青岛:中国海洋大学, 2010.
[33] TSING A, ARCIER J, BREHÉLIN M. Hemocytes of penaeid and palaemonid shrimps: morphology, cytochemistry, and hemograms[J]. Journal of Invertebrate Pathology, 1989, 53(1): 64-77.
[34] TRUSCOTT R, WHITE K N. The influence of metal and temperature stress on the immune system of crabs[J]. Functional Ecology, 1990, 4(3): 455-461.
[35] SÖDERHÄLL K, SMITH V J, JOHANSSON M W. Exocytosis and uptake of bacteria by isolated haemocyte populations of two crustaceans: evidence for cellular co-operation in the defence reactions of arthropods[J]. Cell and Tissue Research, 1986, 245(1): 43-49.
[36] VERGHESE B, RADHAKRISHNAN E V, PADHI A. Effect of environmental parameters on immune response of the Indian spiny lobster,(Linnaeus, 1758)[J]. Fish & Shellfish Immunology, 2007, 23(5): 928-936.
[37] GOMEZ-JIMENEZ S, UGLOW R F, GOLLAS-GALVAN T. The effects of cooling and emersion on total haemocyte count and phenoloxidase activity of the spiny lobster[J]. Fish & Shellfish Immunology, 2000, 10(7): 631-635.
[38] STEVENSON J R, ADOMAKO T Y. Diphenol oxidase in the crayfish cuticle. Localization and changes in activity during the moulting cycle[J]. Journal of Insect Physiology, 1967, 13(12): 1803-1811.
[39] ASHIDA M, SÖDERHÄLL K. The prophenoloxidase activating system in crayfish[J]. Comparative Biochemistry and Physiology Part B: Comparative Biochemistry, 1984, 77(1): 21-26.
[40] LIU C, YEH S, CHENG S, et al. The immune response of the white shrimpand its susceptibility to Vibrio infection in relation with the moult cycle[J]. Fish & Shellfish Immunology, 2004, 16(2): 151-161.
[41] LEE S G, MYKLES D L. Proteomics and signal transduction in the crustacean molting gland[J]. Integrative and Comparative Biology, 2006, 46(6): 965-977.
[42] MCDONALD A A , CHANG E S , MYKLES D L . Cloning of a nitric oxide synthase from green shore crab,: A comparative study of the effects of eyestalk ablation on expression in the molting glands (Y-organs) of, and blackback land crab,[J]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 2011, 158(1): 150-162.
[43] CHANG E S, MYKLES D L. Regulation of crustacean molting: a review and our perspectives[J]. General and Comparative Endocrinology, 2011, 172(3): 323-330.
[44] CHANG E S, BRUCE M J. Ecdysteroid titers of juvenile lobsters following molt induction[J]. Journal of Experimental Zoology, 1980, 214(2): 157-160.
[45] CHAKRAVORTTY D, HENSEL M. Inducible nitric oxide synthase and control of intracellular bacterial pathogens[J]. Microbes and Infection, 2003, 5(7): 621-627.
[46] 王广军, 谢骏, 余德光, 等. 一氧化氮及一氧化氮合酶在水生动物免疫系统中的研究进展[J]. 水产科技, 2009(3): 1-6.
Respiration,Excretion and Physiological Changes of Hemolymph ofDuring Molt Cycle
ZHUO Hong-biao1, ZHENG Qiu-yao1, LIANG Hua-fang, LIAO Yong-yan2, PAN Hai-yang1, LUO Jia-jun1, WEN Chong-qing1
(1.524088; 2.,,535009,)
【】To investigate the changes in respiration, excretion, hemolymph biochemical parameters, and immune enzyme activities ofduring molt cycle.【】The oxygen consumption rate and ammonia excretion rate ofin postmolt (stages A and B), intermolt (stage C) and premolt (stages D0, D1, D2and D3) were determined, as well as the ion content, total protein content, total hemocyte count in the hemolymph and immune enzyme activities.【】The oxygen consumption rate and ammonia excretion rate decreased significantly from the postmolt to intermolt, and the oxygen consumption rate increased significantly at stage D0(< 0.05), while the ammonia excretion rate decreased gradually and showed the lowest level at stage D3. The contents of calcium and potassium in the serum reached the peak at stage D1, and were significantly higher than stage A (< 0.05). The contents of potassium showed the lowest level at stage D1, but almost non-significant variation was detected during the molt cycle, as well as the magnesium and phosphorous (0.05). The total protein content of hemolymph fell sharply after molting, then rose significantly up to intermolt (< 0.05), while non-significant variation occurred between intermolt and premolt (0.05). The total hemocyte counts showed the highest level at stage D2, and the lowest level at stage B, which were 4.22×107and 2.40×107cell×mL-1, respectively. The phenoloxidase activities on the whole experienced the fluctuation of falling first, and then rising throughout the molt cycle. The nitric oxide synthase activities showed the lowest level at stage A, but non-significant variation was detected in other stages.【】The changes of respiration, excretion, hemolymph biochemical parameters and immune enzyme activities inare closely related to the molt cycle.
; al parameters; immune enzyme activities
Q959.19
A
1673-9159(2019)05-0024-07
10.3969/j.issn.1673-9159.2019.05.004
2019-03-26
广西北部湾海洋生物多样性养护重点实验室 ( 钦州学院) 开放课题 ( 2015KB03 ) ; 广东省科技厅农业攻关项目 ( 2013B020308009) ; 广东海洋大学校选项目(2016)
卓宏标(1994―),男,硕士研究生,研究方向为水产经济动物种子工程与增养殖。E-mail:1391290821@qq.com
梁华芳( 1965—) ,男,教授,研究方向为甲壳动物生物学及养殖技术。E-mail: hfliang@ 126.com
卓宏标,郑秋耀,梁华芳,等. 波纹龙虾蜕壳周期的呼吸排泄和血淋巴生理学[J]. 广东海洋大学学报,2019,39(5):24-30.
(责任编辑:刘庆颖)

