罗湖病毒实时荧光定量RT-PCR检测方法的建立
吴凤雷,黄瑜,黄郁葱,蔡双虎,简纪常,汤菊芬
罗湖病毒实时荧光定量RT-PCR检测方法的建立
吴凤雷,黄瑜,黄郁葱,蔡双虎,简纪常,汤菊芬
(广东海洋大学水产学院, 广东省水产经济动物病原生物学及流行病学重点实验室暨水产经济动物病害控制广东省普通高等学校重点实验室,广东 湛江 524088)
【】建立一种快速、灵敏、特异的罗非鱼(spp)罗湖病毒定量检测方法。根据罗湖病毒节段8保守区设计一对特异性引物,建立检测罗湖病毒的SYBR GreenⅠ实时荧光定量RT-PCR方法,并对该方法的特异性、灵敏度和重复性进行了评价。标准曲线在2.5×108~2.5×100拷贝数之间有良好的线性关系(相关系数2= 0.999),检测限为2.5×100个拷贝。试验内及试验间变异系数分别为0.11%~0.43%与0.54%~1.13%,重复性强;对水生动物其他病毒和细菌均无扩增反应,有很好的特异性。新建立的罗湖病毒实时荧光定量PCR检测方法特异性好、灵敏度高、重复性强,可用于TiLV的早期的快速诊断、流行病学调查和防控。
罗非鱼;罗湖病毒;检测;实时荧光定量RT-PCR;标准曲线
尼罗罗非鱼()又称白色三文鱼,是全球重要淡水养殖经济鱼种之一,有繁殖力强、生长速度快、产量高和抗病力强等优点[1],是联合国粮食及农业组织(FAO)推荐养殖鱼种。近年来,以色列、厄瓜多尔、哥伦比亚、泰国和埃及等国及中国台湾养殖和野生的罗非鱼相继暴发一种新病害[2-4],导致巨大的经济损失,引起国际上的广泛关注。该病主要症状为病鱼消瘦,体色发黑,眼球突出浑浊,体表充血、溃烂,腹部膨胀有积水。经研究证实,导致以色列罗非鱼大量死亡的病原体是一种新型RNA病毒[5]——罗湖病毒(Tilapia lake virus,TiLV)。罗湖病毒(Tilapia lake virus,TiLV)是一种新型的正黏病毒,由10个独特的基因节段组成,最大的节段1包含1个开放阅读框,与C型流感病毒PB1同源性较低,其他9个节段在GenBank中未发现与任何核酸、蛋白同源序列。最近研究发现,罗湖病毒还可感染与发病罗非鱼同池的 施氏高体鲃()[6],对其他鱼类同样造成了严重威胁。因此,开展罗湖病毒的快速检测和防控技术研究尤为重要和迫切。
迄今已有病毒分离细胞培养[7-8]、原位杂交和逆转录聚合酶链反应(RT-PCR)[9-10]等多种检测方法用于诊断TiLV。细胞培养和原位杂交操作过程复杂、耗时,并且需要专业技术人员进行测定,且结果不确定,常延误病情的诊断;一步RT-PCR和巢式RT-PCR虽有较高的灵敏度和特异性,但检测过程繁琐且无法实现实时定量的监控检测和样品之间的比较,难以掌握病情的发生和发展进程。实时荧光定量RT-PCR(qRT-PCR)具有操作简单、灵敏度高和特异性强等优点,整个反应过程一步完成,无需对反应产物进行后期处理,大大避免了后期污染和假阳性的发生,提高了检测效率及准确性,已越来越多地应用于水生动物病原检测[11-12]。本研究旨在建立一种可检测TiLV的实时荧光定量RT-PCR检测方法,为TiLV的早期快速诊断、流行病学调查提供技术支撑。
1 材料与方法
1.1 材料
实验用吉富罗非鱼购自茂名高州某养殖公司,罗湖病毒由本研究室保存。
主要试剂Premix Ex TaqTM(Probe qPCR)、pMD18-T 载体和反转录试剂盒均购自TaKaRa公司;琼脂糖凝胶DNA回收试剂盒、质粒提取试剂盒购自赛默飞世尔科技(Thermo Fisher Scientific)公司;RNA 提取试剂盒、One-Step gDNA Removal and cDNA Synthesis SuperMix反转录试剂盒、Easy Pure Plasmid MiniPrep Kit试剂盒和大肠杆菌()DH5α 感受态细胞,购自北京全式金生物技术有限公司。
主要仪器实时荧光定量 PCR仪(Light Cycler 96)、梯度PCR仪(S1000)、核酸定量仪(ND2000)均由本实验室提供。
1.2 方法
1.2.1 引物设计 应用DNAMAN软件对GenBank上已登录的罗湖病毒节段8节段进行比对分析,在保守区域设计一对特异引物:正向引物TiLV-F,5′-ATTCGTCCCAGCCTTTCCTC-3′;反向引物TiLV-R,5′ -GATTTCACGCTCAACGGCAT-3′,引物由生工生物工程(上海)股份有限公司(下简称“生工公司”)合成。
1.2.2 RNA的提取及cDNA一链的合成 按Trizol说明书提取病毒总RNA。通过凝胶电泳检测总RNA完整性,用核酸定量仪检测总RNA浓度和纯度。用One-Step gDNA Removal and cDNA Synthesis SuperMix试剂盒按照说明书合成cDNA一链,于-20℃保存待用。
1.2.3 DNA片段的克隆与标准品的制备 以反转的cDNA一链为模板和引物TiLV-F/TiLV-R扩增目的片段,反应条件:94 ℃4 min;94 ℃ 30 s,54 ℃ 30 s,72 ℃ 30 s,30 个循环;72 ℃5 min,4 ℃下保存。PCR 反应产物经琼脂糖凝胶电泳检测,切胶回收后,与pMD-18T连接构建重组质粒,将重组质粒转化DH5α,阳性克隆送至生工公司测序。将含有目的条带、经测序确认的阳性克隆大量培养后,用Plasmid MiniPrep Kit试剂盒提取重组质粒DNA,并用核酸分析仪测定重组质粒DNA的质量浓度。按照公式:质粒浓度( 拷贝/μL) = 6.02×1023(拷贝/mol) × 质粒质量浓度(g/μL) / 质粒分子数,换算出重组质粒浓度,将含有TiLV目的片段的重组质粒作为标准品。
1.2.4 灵敏度试验及标准曲线的绘制 通过对实时荧光定量PCR反应体系中最佳退火温度(生工公司设计合成上下游引物推荐平均值)和引物浓度(荧光定量酶推荐引物浓度),最终确定反应体系为:2×One StepRT-PCR Buffer Ⅲ 12.5 μL,Ex TaqHS 0.5 μL,PrimeScript RT Enzyme MixⅡ0.5 μL,模板及引物各1 μL,灭菌ddH2O补足25 μL。反应程序:94 ℃ 3 min;94℃ 15 s,57 ℃15 s,60 ℃ 30 s,共40个循环。将重组质粒进行10倍系列梯度稀释,共9个浓度梯度,分别为2.5×108~2.5×100拷贝/μL,进行qRT-PCR扩增,每个浓度梯度设3个重复。PCR结束后,利用Excel软件进行数据分析,包括查看扩增曲线和循环数。计算重组质粒不同稀释梯度与循环数的相关性,绘制标准曲线[13],并建立回归方程,用于定量分析。以每个浓度梯度重组质粒平均循环数为横坐标,各浓度梯度质粒模板浓度的对数值为纵坐标。
1.2.5 特异性实验 分别以大肠杆菌、金黄色葡萄球菌()、无乳链球菌()、海豚链球菌()、嗜水气单胞菌()、乳酸乳球菌()、肿大细胞虹彩病毒和神经坏死病毒(均由本实验室分离保存)等多种菌毒株的DNA为模板,进行实时荧光定量RT-PCR扩增,用无菌ddH2O作为阴性对照,观察结果确定引物特异性。
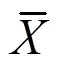
1.2.7 临床样品的检测 取TiLV采用注射法回归感染不同批次的吉富罗非鱼(50 ~ 100 g,健康,28℃养殖),共采集鱼3批次25尾,抽检7尾,提取各组织总RNA和合成cDNA链,分别利用1.2.4中建立的实时荧光定量PCR方法进行检测,比较分析结果。根据样品循环数和扩增曲线综合判定:无扩增曲线的判为阴性样品;循环数≤37.96,且扩增曲线呈“S”型者判为阳性;循环数≤37.96,但扩增曲线不规则或为陡直斜线者判为阴性;循环数> 37.96者为阴性。
2 结果
2.1 PCR扩增结果
以TiLV cDNA 为模板进行RT-PCR扩增,PCR产物经琼脂糖凝胶电泳检测,获得单一的203 bp目的条带,与预期大小相同(图1)。目的片段序列用Blast程序进行同源性比较和相似性分析,结果显示与TiLV泰国株(KU751821)节段8的同源率高达97.5%,扩增产物确证为TiLV节段8的部分序列。
M. DL500 DNA 分子标记;1. TILV 节段8部分序列
2.2 引物特异性
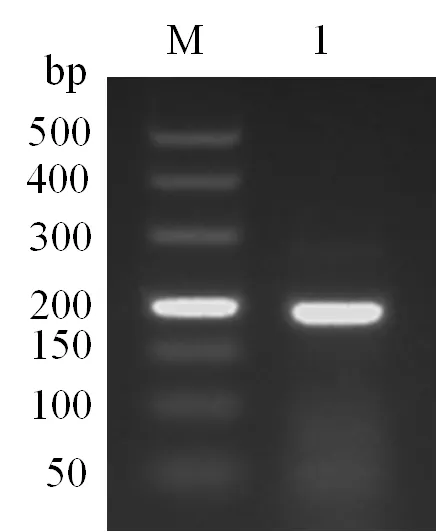
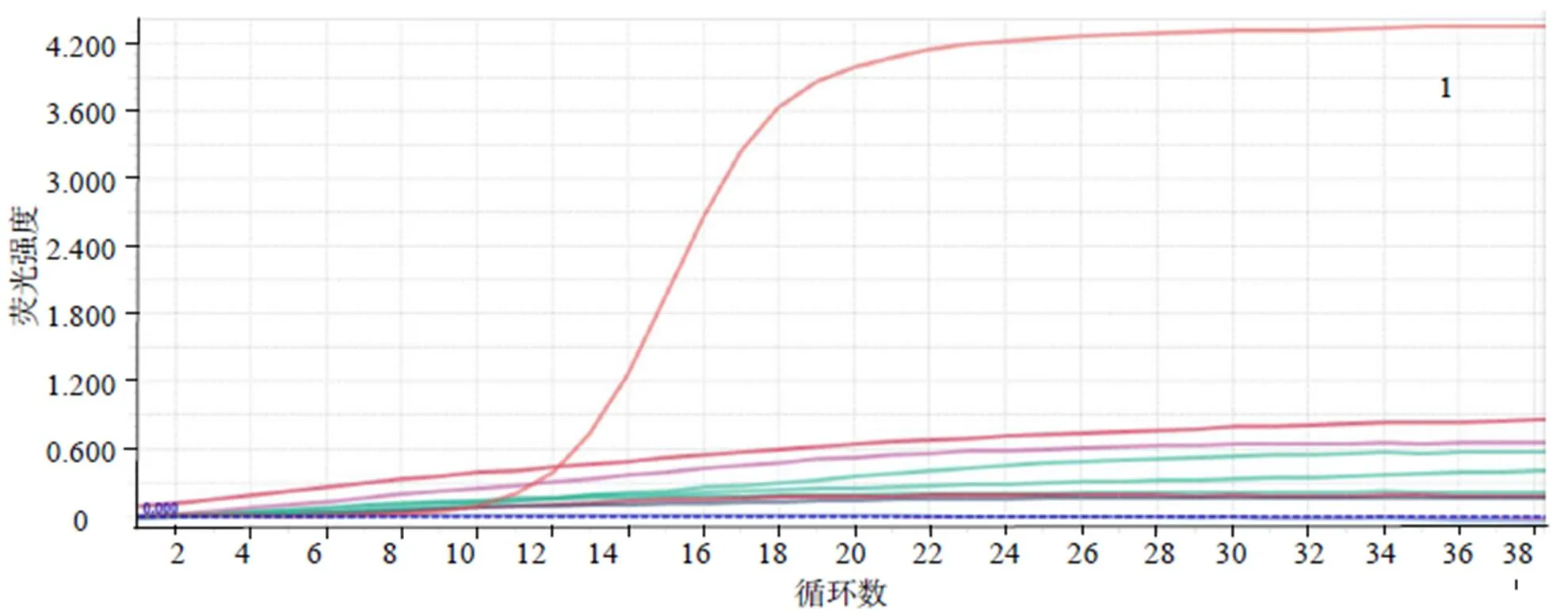
由图2可知,经qRT-PCR扩增,仅以TiLV反转录cDNA为模板出现典型的“S”型扩增曲线,而以大肠杆菌、金黄色葡萄球菌、无乳链球菌、海豚链球菌、嗜水气单胞菌、乳酸乳球菌、肿大细胞虹彩病毒的DNA和神经坏死病毒为对照模板时,出现不规则的折线形,而不是“S”型扩增曲线。由图3可知,不同浓度标准品进行定量荧光PCR,对其扩增产物作熔解曲线分析时,均只在熔解温度(82.53±0.1)℃处有一个特异性吸收峰,无其他非特异性杂峰。表明所设计引物有良好的特异性。
曲线1为TiLV,其余分别为神经坏死病毒、肿大细胞虹彩病毒、无乳链球菌、大肠杆菌、海豚链球菌、嗜水气单胞菌、金黄色葡萄球菌、乳酸乳球菌DNA
图3 TiLV节段8熔解曲线
2.3 标准曲线和灵敏度
经测定,提取的重组质粒起始质量浓度为80.64 ng/µL,经换算,重组质粒为2.5×1010拷贝/µL。以10倍系列稀释后重组质粒为标准品进行qRT-PCR,结果如图4所示,以2.5×108~2.5×100拷贝/μL 9 个浓度梯度质粒作为模板得到的扩增曲线呈典型的“S”型,随着模板量的减少,其对应的循环数相应增加,两者之间具有良好的线性关系。
根据RT-PCR实验要求扩增效率应处于90% ~ 110%之间,相关系数2等于0.999,符合RT-PCR要求,在实时荧光定量 PCR 方法所允许的误差范围内。
由标准曲线图可知,本研究开发的荧光定量检测技术最低检测限达2.5拷贝数,灵敏度较高。
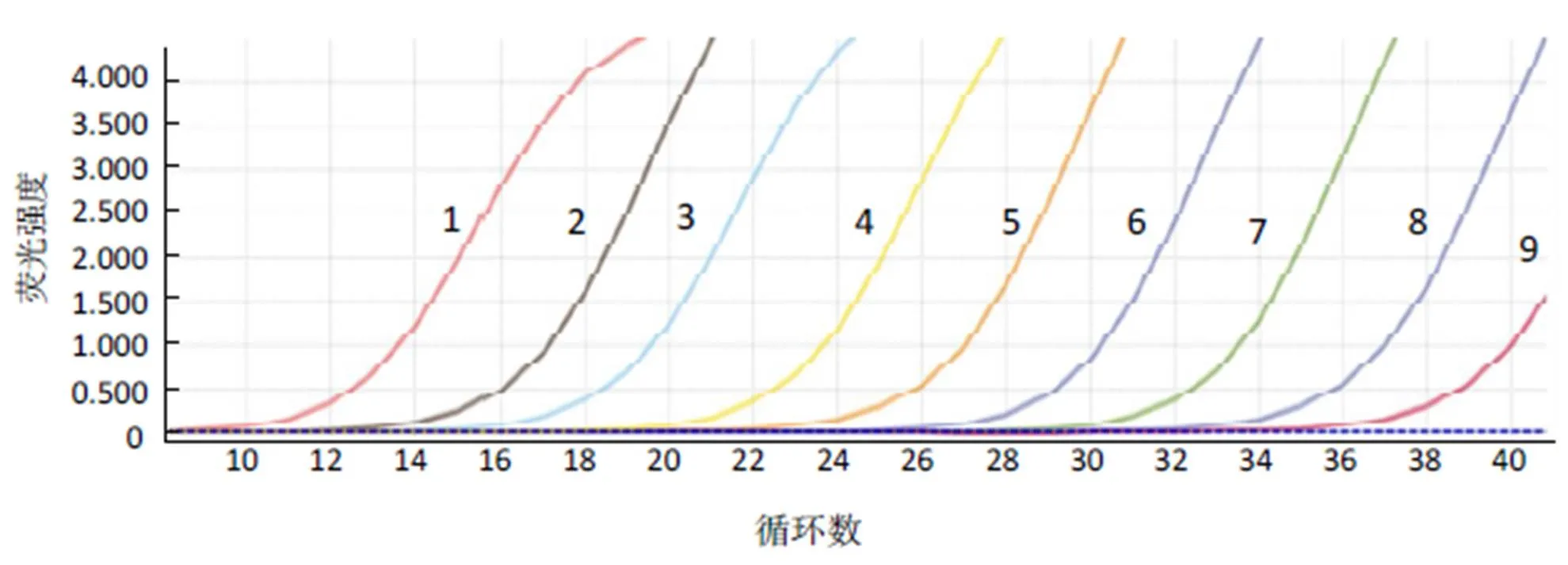
从左到右依次(1 ~ 9)为重组质粒拷贝数为2.5×108~ 2.5×100
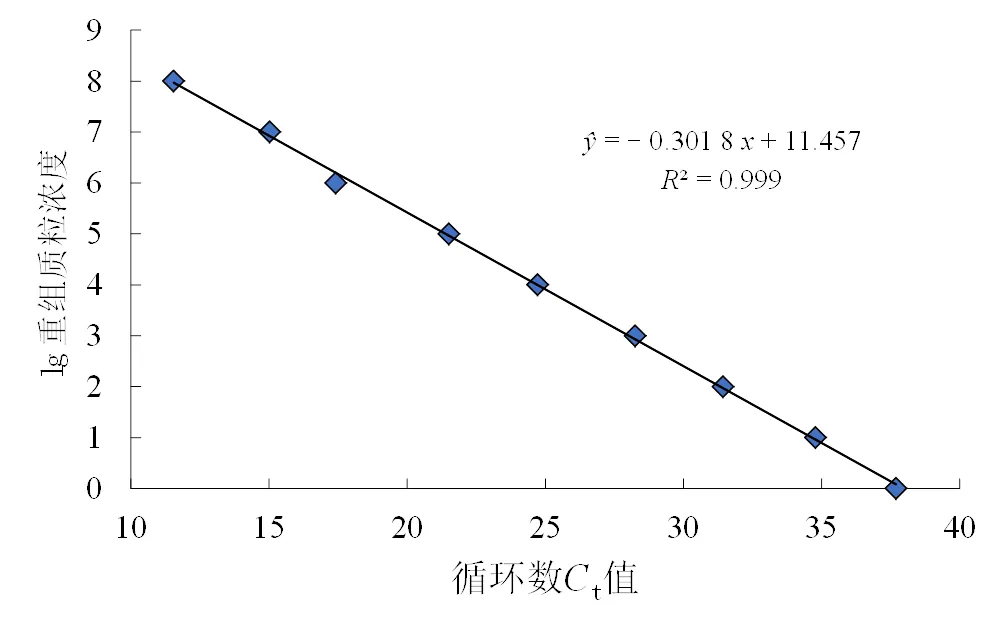
图5 定量PCR的标准曲线
2.4 重复性
用6种浓度的质粒标准品分别进行批内和批间重复性实验,结果表明,批内和批间重复性实验变异系数(CV)均< 2%(表1),表明该方法有良好的重复性与稳定性。
2.5 临床样品的检测
应用所建立的qRT-PCR检测方法对25份已攻毒临床病鱼进行检测,并与常规的RT-PCR作对比。抽检7尾鱼PCR扩增结果(图6、图7)显示,qRT-PCR法与常规RT-PCR均检测到阳性样品5条,qRT-PCR方法与常规RT-PCR方法检测结果一致。
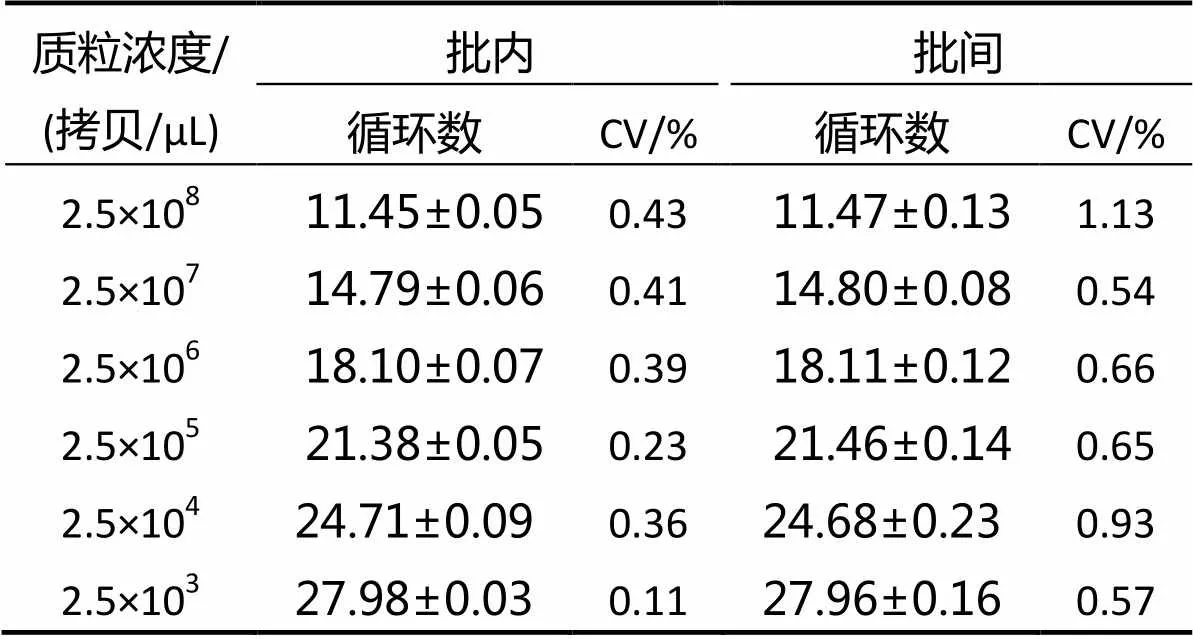
表1 TiLV实时荧光定量批内和批间重复性实验
说明:= 3
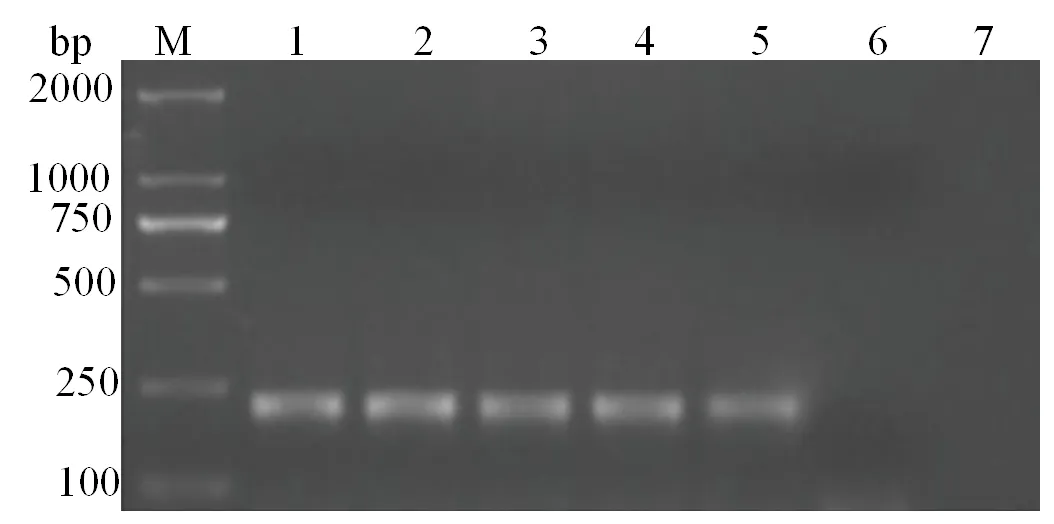
M:DL2000 DNA分子标记;1~7,取样标号
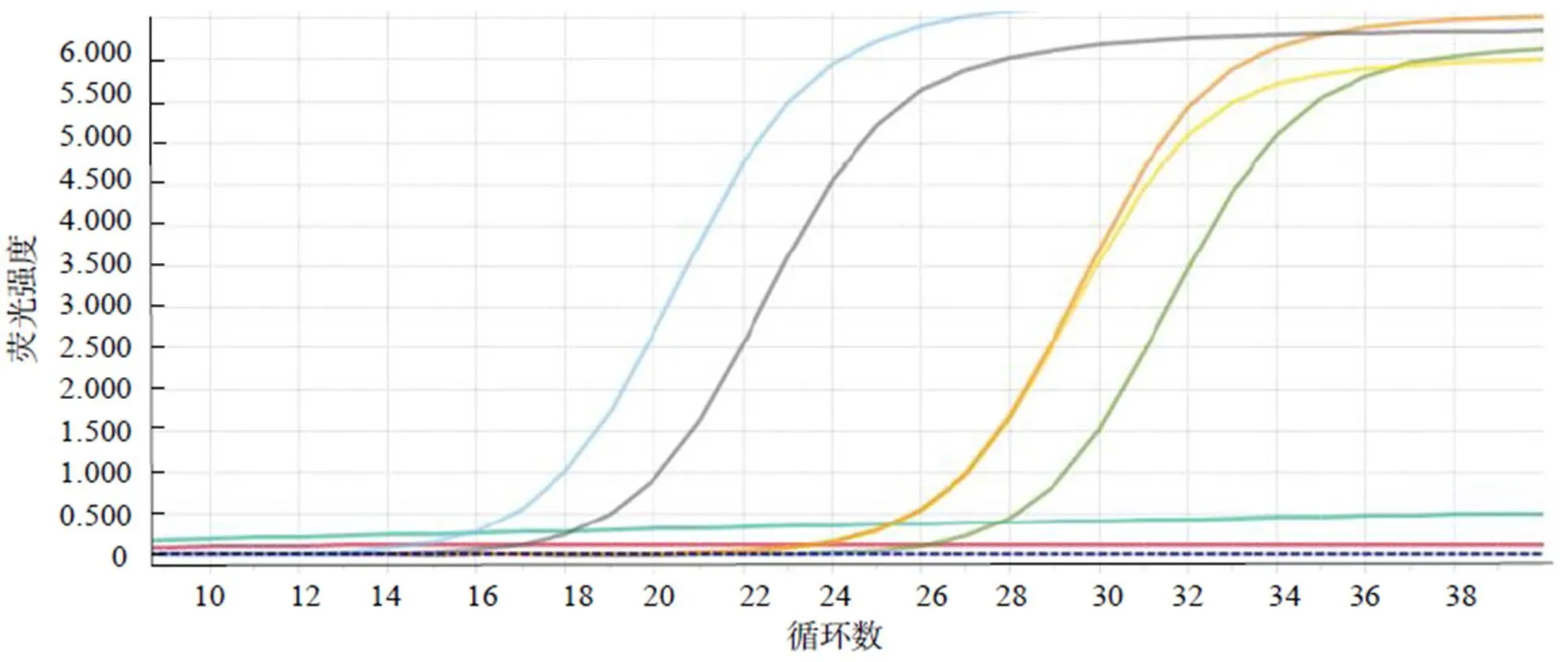
图7 攻毒鱼抽检荧光定量PCR扩增曲线
3 讨论
罗湖病毒自2009年首次在以色列发现以来,已经相继在厄瓜多尔、哥伦比亚、泰国、埃及、我国台湾地区、印度和马来西亚等多个国家或地区得到确认[14],目前还有进一步传播到其他地区的趋势,已经成为危害国内外罗非鱼养殖产业的重要病原。目前,由于对罗湖病毒病尚无有效的防治措施,其发病症状与气单胞菌感染症状相似,因此,快速、准确、灵敏的早期诊断对罗湖病毒病的预警预报与防控具有重要的意义。
与传统的细胞培养、原位杂交和RT-PCR检测方法相比,实时荧光定量PCR检测技术具有快速、灵敏度高、特异性强和定量组织样品中的病原体的优势,已被开发并验证用于检测其他鱼类病毒[15-16],例如使用荧光定量PCR检测含有淋巴囊肿病毒的无症状载体金头鲷()[17]和舌齿鲈()[18]中神经坏死病毒的组织分布和靶器官组织中的病毒复制。以前的研究显示,标准RT-PCR方法的检测限为70 000个病毒拷贝,而更敏感的巢式RT-PCR在鱼组织中检测到低至7个拷贝[19]。本研究建立基于罗湖病毒节段8的实时荧光定量PCR检测技术,该技术对于检测临床样品中的TiLV具有高度敏感性和特异性,最低检测限可以检测低至2.5拷贝/μL,其检测灵敏度是常规RT-PCR的100倍,与已报道的探针检测灵敏度相当[20]。
SYBR Green I是一种能结合到双链DNA小沟部位并发出荧光的染料,在PCR反应中任何的非特异性扩增都会影响结果的准确性。本意见所建立的用于检测TiLV的SYBR Green I实时荧光定量PCR 方法呈现出良好的S型扩增曲线,只出现特异扩增产物的单峰,产物的m值均一,表明无引物二聚体及非特异性扩增产物出现;特异性反应实验结果只出现单一特异性条带,与大肠杆菌、金黄色葡萄球菌、无乳链球菌、海豚链球菌、嗜水气单胞菌、乳酸乳球菌和肿大细胞虹彩病毒均无交叉反应,表明其具有良好的特异性。由标准曲线可见,该方法起始模板浓度与循环数之间呈良好的线性关系,直线回归方程的相关系数可达0.999(> 0.95),批内和批间差异系数分别为0.11% ~ 0.43%和0.54% ~ 1.13%。这些数据与先前的荧光定量PCR方案在其他鱼类病毒中的范围相当[21-22],说明建立的反应体系具有很高的精确度和良好的稳定性。
本研究使用TiLV片段8的实时荧光定量PCR的方法,以TiLV部分基因序列建立检测方法,为TiLV基因定量的有关研究提供参考,对早期罗湖病毒的快速检测以及罗非鱼罗湖病毒的预防及用药治疗提供技术支持。
[1] 卢迈新. 罗非鱼链球菌病研究进展[J]. 南方水产, 2010, 6(1): 75-79.
[2] 郭建红, 蔡颖, 吴松浩. 罗湖病毒研究进展[J]. 中国动物检疫, 2017, 34(8): 72-75.
[3] EYNGOR M, ZAMOSTIANO R, KEMBOU TSOFACK J E, et al. Identification of a novel RNA virus lethal to tilapia[J]. Journal of Clinical Microbiology, 2014, 52(12):4137-4146.
[4] FERGUSON H W, KABUUSU R, BELTRAN S, et al. Syncytial hepatitis of farmed tilapia,(L.): a case report[J]. Journal of Fish Diseases, 2014, 37(6): 583-589.
[5] DEL POZO J, BLOOM T, FERGUSON H, et al. Characterization of a novel Orthomyxo-like virus causing mass die-offs of Tilapia[J]. MBio, 2016, 7(2): e00431-16.
[6] FATHI M , DICKSON C, DICKSON M, et al. Identification of TILAPIA LAKE VIRUS in Egypt in Nile tilapia affected by ‘summer mortality’ syndrome[J]. Aquaculture, 2017, 473:430-432.
[7] KEMBOU TSOFACK J E, ZAMOSTIANO R, WATTED S, et al. Detection of Tilapia Lake Virus in clinical samples by culturing and nested reverse transcription-PCR[J]. Journal of Clinical Microbiology, 2017, 55(3): 759-767.
[8] SURACHETPONG W, JANETANAKIT T, NONTHABENJAWAN N, et al. Outbreaks of Tilapia Lake Virus infection, Thailand, 2015-2016[J]. Emerging Infectious Diseases, 2017, 23(6): 1031-1033.
[9] ABDULLAH A, RAMLY R, MOHAMMAD RIDZWAN M S, et al.. First detection of tilapia lake virus (TiLV) in wild river carp () at Timah Tasoh Lake, Malaysia[J]. Journal of Fish Diseases, 2018, 41(9): 1459-1462.
[10] 雷燕, 肖洋, 赵振峰, 等. 罗非鱼罗湖病毒RT-PCR检测方法的建立及初步应用[J]. 广东海洋大学学报, 2019, 29(3): 1-5.
[11] HODNELAND K, GARCÍA R, BALBUENA J A, et al. Real-time RT-PCR detection of betanodavirus in naturally and experimentally infected fish from Spain[J]. Journal of Fish Diseases, 2011, 34(3): 189-202.
[12] PURCELL M K, GETCHELL R G, MCCLURE C A, et al. Quantitative polymerase chain reaction (PCR) for detection of aquatic animal pathogens in a diagnostic laboratory setting[J]. Journal of Aquatic Animal Health, 2011, 23(3): 148-161.
[13] KIBENGE F S. Emerging viruses in aquaculture[J]. Current Opinion in Virology, 2019, 34: 97-103.
[14] CIULLI S, PINHEIRO A C, VOLPE E, et al. Development and application of a real-time PCR assay for the detection and quantitation of lymphocystis disease virus.[J]. Journal of Virological Methods, 2015, 213: 164-173.
[15] CURTO G, DALLAVALLE E, LAZZERI L. Life cycle duration of Meloidogyne incognita and host status of Brassicaceae and Capparaceae selected for glucosinate content[J]. Nematology, 2005, 7(2): 203-212.
[16] STARKEY W G, SMAIL D A, BLEIE H, et al. Detection of infectious salmon anaemia virus by real-time nucleic acid sequence based amplification[J]. Diseases of Aquatic Organisms, 2006, 72(2): 107-113.
[17] VALVERDE E J, CANO I, LABELLA A, et al. Application of a new real-time polymerase chain reaction assay for surveillance studies of lymphocystis disease virus in farmed gilthead seabream[J]. BMC Veterinary Research, 2016, 12(1): 71.
[18] LOPEZ-JIMENA B, ALONSO M D C, THOMPSON K D, et al. Tissue distribution of Red Spotted Grouper Nervous Necrosis Virus (RGNNV) genome in experimentally infected juvenile European seabass ()[J]. Veterinary Microbiology, 2011, 154(1/2): 86-95.
[19] KEMBOU TSOFACK J E, ZAMOSTIANO R, WATTED S, et al. Detection of Tilapia Lake Virus in Clinical Samples by Culturing and Nested Reverse Transcription-PCR[J]. Journal of Clinical Microbiology, 2017, 55(3): 759-767.
[20] 陈维多, 赵铁军, 杨运清. DNA荧光研究中标准曲线的制作[J]. 东北农业大学学报, 1995, 26 (3): 280-282.
[21] PANZARIN V, PATARNELLO P, MORI A, et al. Development and validation of a real-time TaqMan PCR assay for the detection of betanodavirus in clinical specimens[J]. Archives of Virology, 2010, 155(8): 1193-203.
[22] YUE T, ABBASBANDY S. Homotopy analysis method for quadratic Riccati differential equation [J]. Communications in Nonlinear Science & Numerical Simulation, 2008, 13(3): 539-546.
Development of Real-time Fluorescence Quantitative RT-PCR Detection Method for Tilapia Lake Virus
WU Feng-lei, HUANG Yu, HUANG Yu-cong, CAI Shuang-hu, JIAN Ji-chang, TANG Ju-fen
(,,524088,)
【】To establish a rapid, sensitive and specific quantitative detection method for Tilapia Lake Virus (TiLV).【】To design a pair of specific primers based on the conserved region of Lo Wu virus segment 8 and to establish SYBR Green I real-time quantitative RT-PCR for detection of TiLV. The specificity, sensitivity, and repeatability of the method were evaluated. 【】The standard curve had a good linear relationship between 2.5×108and 2.5×100copy number (correlation coefficient2= 0.999), and the detection limit was 2.5×100copy numbers. The intra- and inter-assay coefficients of variation were 0.11% - 0.43% and 0.54% - 1.13%, respectively. The repeatability was strong. There was no amplification reaction for other viruses and bacteria in aquatic animals, and it had good specificity. 【】The newly established real-time fluorescent quantitative PCR detection method of TiLV has good specificity, high sensitivity and high reproducibility, and can be used for early rapid diagnosis, epidemiological investigation, prevention and control of TiLV.
; Tilapia Lake Virus; detection; real-time fluorescence quantitative RT-PCR; standard curve
S943.125.41
A
1673-9159(2019)05-0031-07
10.3969/j.issn.1673-9159.2019.05.005
2019-03-05
广东省自然科学基金(2016A030313748);国家重点研发计划(2018YFD0900501)
吴凤雷(1994―),女,硕士研究生,主要从事水产动物病害防治研究。E-mail: 2352289350@qq.com
黄郁葱,副教授,主要从事水产动物免疫学及病害控制研究。E-mail: hyczjou@163.com
吴凤雷,黄瑜,黄郁葱,等. 罗湖病毒实时荧光定量RT-PCR检测方法的建立[J]. 广东海洋大学学报,2019,39(5):31-37.
(责任编辑:刘庆颖)

