镰形棘豆总黄酮理化性质及体外经皮渗透性的研究
蔡小辉,曾棋平,杨丽娜,曹毅祥,陈锦珊
(中国人民解放军联勤保障部队第九○九医院/厦门大学附属东南医院制剂科,福建 漳州 363000)
镰形棘豆OxytropisfalcataBunge,系豆科棘豆属多年生无茎草本植物。据《晶珠本草》记载,镰形棘豆以根及根茎或全草入药,被誉为“草药之王”,是我国青藏高原常用的民间草药之一[1]。研究表明镰形棘豆主要药理成分有黄酮类、生物碱类、甾体等,其中黄酮类具有镇痛抗炎、抗氧化、抑菌等生物活性,在抗肿瘤、抗2型糖尿病及防紫外线晒伤等领域已有较多的研究[2-4]。课题组前期研究发现镰形棘豆总黄酮(total flavonoids fromOxytropisfalcataBunge,TFOFB)干预大鼠深Ⅱ度烧伤具有良好效果[5-6]。而TFOFB的指标性成分之一——2′,4′-二羟基查尔酮也具有抗炎、镇痛、止血、抗肿瘤、抗菌等多种作用。因此,TFOFB具有良好的开发前景,但其与体内吸收、分布、代谢密切相关的溶解度(S)、表观油/水分配系数(LogP)、体外透皮性质等重要理化参数尚未见文献报道。本研究以TFOFB含量为指标,考察TFOFB的溶解度、油水分配系数等理化常数,其中包括2′,4′-二羟基查尔酮的溶解度、油水分配系数,并研究TFOFB体外经皮渗透性能,为下一步经皮给药剂型设计和制备提供实验依据。
1 仪器与试药
1.1 仪器
AUW120D电子分析天平(精确至0.01 mg,日本岛津公司);UV-2550紫外可见光分光光度计(日本岛津公司);LD5-2A离心机(北京医用离心机厂);SHZ-B水浴恒温振荡器(常州科迈实验仪器有限公司);DLF30连续性粉碎机(温州顶历医疗器械有限公司);PHS-3C型pH计(杭州雷磁分析仪器厂);TP-3A型智能药物透皮扩散实验仪(巩义市科瑞仪器有限公司)。
1.2 试药
镰形棘豆(购自青海西宁,经联勤保障部队909医院/厦门大学附属东南医院郑绍忠副主任药师鉴定为豆科棘豆属植物镰形棘豆);芦丁对照品(纯度:92.6%,中国食品药品检定研究院,批号:100080-200707),2′,4′-二羟基查尔酮对照品(纯度:99.5%,湖北巨胜科技有限公司,批号:20171121),甲醇、乙醇、正丁醇、正辛醇、乙酸乙酯、氯仿、石油醚、磷酸氢二钾、磷酸二氢钾、磷酸氢二钠、氯化钠、氢氧化钠、三氯化铝、醋酸钠、硫化钠(分析纯),生理氯化钠溶液为灭菌制剂(科室自制),水为纯化水(科室自制)。
1.3 实验动物
清洁级Wistar大鼠,雄性,体重(225±25)g,购自上海斯莱克实验动物有限责任公司,实验动物许可证号:SCXK(沪)2012-0002。
2 方法与结果
2.1 TFOFB含量测定方法学的建立[7]
2.1.1对照品溶液的制备
取干燥至恒重的芦丁对照品约10 mg,精密称定,置50 ml量瓶中。加60 %乙醇适量,置 80 ℃水浴中加热,使溶解,放冷,加 60% 乙醇稀释至刻度,摇匀,制成0.2 mg/ml的对照品溶液,备用。
2.1.2线性关系考察
精密量取“2.1.1”项下不同体积的对照品溶液1.0、2.0、3.0、4.0、5.0、6.0 ml分别置入6支25 ml量瓶中,各加0.1 mol/L三氯化铝溶液3 ml与1 mol/L醋酸钠溶液5 ml,甲醇定容至刻度,摇匀,放置5 min,同时以相应试剂为空白,在273 nm波长处测定吸光度。以浓度(X,μg/ml)为横坐标,吸光度值(Y)为纵坐标,绘制标准曲线,得回归方程为Y=0.035X-0.127(r=0.999 9)。结果表明,芦丁对照品溶液在8.0~48.0 μg/ml范围内与吸光度呈良好的线性关系。
2.1.3TFOFB含有量测定
精密移取TFOFB纯化液1.0 ml置25 ml量瓶中,按照标准曲线的制作方法进行显色,即加入0.1 mol/L三氯化铝溶液3 ml及1 mol/L醋酸钠溶液5 ml,加甲醇定容至刻度,摇匀,放置5 min,以相应试剂为空白,在273 nm 波长处测定吸光度。
2.1.4精密度试验
精密量取对照品溶液3.0 ml,按照“2.1.2”项下方法显色,连续测定6次,根据标准曲线计算TFOFB含量,计算RSD (n=6),结果RSD为0.98%,表明仪器精密度良好。
2.1.5稳定性试验
精密量取待测溶液1.0 ml置25 ml量瓶中,依“2.1.3”项下方法显色,在120 min内,每隔20 min测定一次吸光度,计算RSD。结果RSD为1.21%,表明TFOFB纯化液在120 min内稳定性良好。
2.1.6重复性试验
称取6份TFOFB上样液,在优化工艺条件下上样和洗脱,并按“2.1.3”项下方法操作,测得TFOFB含有量RSD为1.03%,表明该方法重复性良好。
2.1.7加样回收率试验
将芦丁对照品溶液加到最优提取工艺条件下得到的样品溶液(TFOFB含量为23.21 mg/g) 中,然后按“2.1.3”项下方法显色,测定溶液吸光度,测得平均回收率为100.70%,RSD 为1.24% (n=6)。
2.2 HPLC测定2′,4′-二羟基查尔酮
2.2.1对照品溶液的制备
取2′,4′-二羟基查尔酮对照品适量,精密称定,置于50 ml棕色量瓶中,加甲醇溶解并稀释至刻度,制成164.0 μg/ml的对照品溶液。摇匀,经0.45 μm微孔滤膜滤过,即得。
2.2.2供试品溶液的制备
精密吸取TFOFB纯化液1 ml,置10 ml量瓶中,加甲醇适量,超声5 min,摇匀并以甲醇稀释至刻度,经0.45 μm滤膜滤过,即得。
2.2.3色谱条件
采用Zorbax SB-C18色谱柱(4.6 mm×250 mm,5 μm),以乙腈-0.2%甲酸(50∶50)为流动相,流速1.0 ml/min;进样量10 μl;柱温30℃,检测波长365 nm。
2.2.4线性关系考察
精密吸取对照品溶液0.5、1.0、2.0、4.0、8.0、10.0 ml至10 ml量瓶中,加甲醇稀释至刻度,摇匀,按“2.2.3”项下色谱条件进样分析,记录色谱峰面积,以峰面积对质量浓度(μg/ml)进行线性回归,得2′,4′-二羟基查尔酮的回归方程Y=84.108X-20.184,r=0.999 9,表明2′,4′-二羟基查尔酮在8.2~164.0 μg/ml范围内与峰面积呈良好的线性关系。
2.2.5精密度试验
分别取低、中、高质量浓度的2′,4′-二羟基查尔酮对照品溶液(15.8、126.4、252.8 μg/ml),用HPLC法在365 nm波长处连续测定6次峰面积,计算日内精密度,分别在5 d内每天用HPLC测定峰面积,计算日间精密度。结果2′,4′-二羟基查尔酮低、中、高3个质量浓度的日内精密度分别为1.58%、0.86%、0.75%;日间精密度分别为1.98%、0.95%、1.03%,表明仪器精密度良好。
2.2.6稳定性试验
取同一供试品溶液,按“2.2.3”项下色谱条件在0、1、2、4、6、12 h进样测定峰面积,共测定6次,分别测定2′,4′-二羟基查尔酮峰面积值,结果2′,4′-二羟基查尔酮峰面积值RSD为1.08%,表明供试品溶液在12 h内稳定。
2.2.7重复性试验
按供试品溶液的制备方法制备6份TFOFB-CPL溶液,每份测定3次,记录色谱峰面积,计算得2′,4′-二羟基查尔酮质量分数的RSD为0.78%。
2.2.8回收率试验
分别精密吸取供试品溶液1 ml共9份,置于10 ml量瓶中,分别加入3份1 ml低、中、高质量浓度的(32.5、75.0、150 μg/ml)对照品溶液,混匀,再加入甲醇稀释至刻度,超声5 min,经0.45 μm滤膜滤过,用HPLC测定峰面积并计算加样回收率。结果低、中、高质量浓度的2′,4′-二羟基查尔酮的回收率分别为102.35%、101.08%、100.05%,RSD分别为0.78%、1.25%、1.32%(n=3)。
2.3 TFOFB的提取及纯化[7-8]
精密称取适量镰形棘豆粗粉,置圆底烧瓶中,加入20倍量66%乙醇回流提取2次,每次84 min,过滤,合并滤液,作为上样液。以D-101大孔树脂上柱,上样浓度为275 mg/g,洗脱剂为80%乙醇,洗脱液减压浓缩真空干燥,得纯度为69.08%的总黄酮粉末。
2.4 TFOFB溶解度的测定
精密称定TFOFB粉末或2′,4′-二羟基查尔酮0.1 g,分别加入水、甲醇、乙醇、正丁醇、乙酸乙酯、氯仿、石油醚和不同pH的磷酸盐缓冲液各10 ml制成过饱和溶液,于(37±1)℃、100 r/min恒温水浴中机械振荡,24 h后取样,分别进行含量测定,计算TFOFB及2′,4′-二羟基查尔酮在不同溶剂中的溶解度,结果见表1。由结果可知,与纯化水相比,TFOFB在甲醇、乙醇及pH 5.0~7.4的磷酸盐缓冲液中溶解度较好;2′,4′-二羟基查尔酮难溶于水,在乙醇等有机试剂中溶解度显著提高。

表1 TFOFB在不同溶剂中的溶解度
2.5 TFOFB表观油水分配系数的测定
取适量水或不同pH的磷酸盐缓冲液于锥形瓶中,加入等量的正辛醇,在振荡器上常温振荡24 h,使其互相饱和,静置分层后,分离两相,分别保存备用。取适量的TFOFB 7份及2′,4′-二羟基查尔酮1份,分别加入被正辛醇饱和的水或缓冲溶液中,静置后于4 000 r/min离心15 min,精密吸取上清液5 ml置于锥形瓶中,再分别加入被水/缓冲溶液饱和的正辛醇5 ml,于快速混匀器上混匀10 min,静置1 h,静置后取下层水相溶液以及混合前的水相溶液进行含量测定,分析TFOFB及2′,4′-二羟基查尔酮在平衡前后的质量浓度,计算表观油水分配系数(P)公式为:
P=(C0-C1)/C1
式中,C0和C1分别为混合前后下层水相中TFOFB的质量浓度。结果见表2。由结果可知,当pH值在2.5~7.4时,随着pH值的增加,总黄酮的logP值逐渐减小。TFOFB的logP值在0.38~1.34之间。而2′,4′-二羟基查尔酮的logP值为2.50。
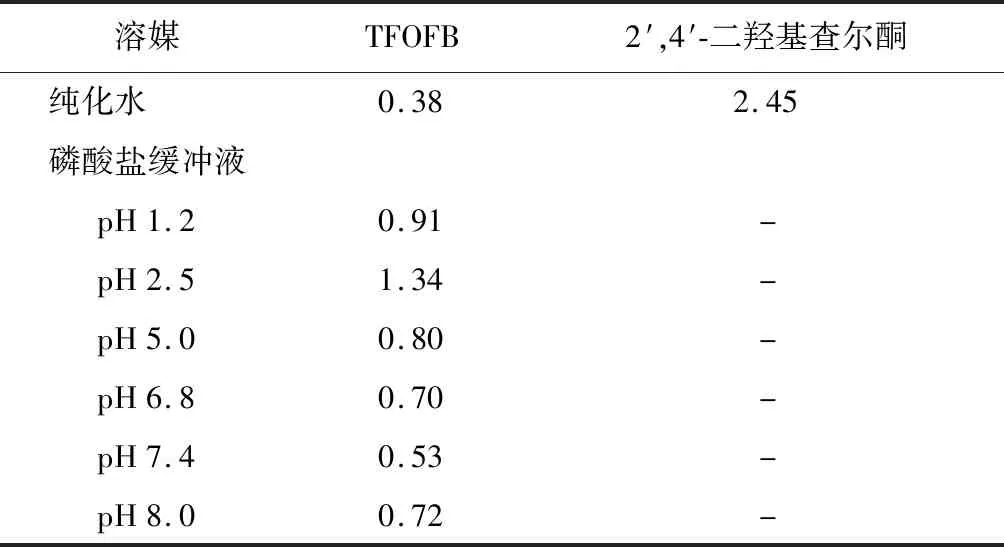
表2 TFOFB在不同pH缓冲液中的表观油水分配系数(LogP)
2.6 TFOFB体外经皮渗透性能研究[9]
2.6.1供试品的制备
取TFOFB适量,精密称定,加60%乙醇制备浓度为10 mg/ml的供试品溶液。
2.6.2接收液的选择
以不同溶剂作为接收液,通过考察供试品经皮渗透后的浓度,从而选出适宜的接收液,结果见表3。
2.6.3离体皮肤的制备
取同一批次的健康大鼠,适应性喂养1周后,用6%Na2S溶液将大鼠胸腹部脱毛,断颈处死,剪下腹部皮肤,去除皮下组织和黏液组织后洗净,置于生理盐水中,放置于冰箱4℃保存备用。
2.6.4经皮渗透性实验
将制备好的大鼠皮肤角质层朝上固定在改良的Franz扩散池上,保持真皮层和接受液密切接触,并确保接收室中无气泡,接收池(扩散面积为3.4 cm2,容积为20 ml)中加入50%乙醇生理盐水作为接收液,内置一磁力搅拌棒,将接收池置于磁力搅拌器上,搅拌速率为300 r/min,水浴温度为(37±1)℃。分别于1、2、4、6、8、12、24 h从接收池中吸取5 ml,同时补充等量接收液,以满足漏槽条件。取出的接收液依法测定,计算药物累积透过量(Qn)。透皮实验结束后,取下皮肤,用接收液将皮肤表面残留的供给液洗净,剪碎,加甲醇5 ml超声提取2次,每次30 min,取上清液进行紫外分析测定,计算药物的皮肤滞留量(Qs)和累积透过率(Q),平行操作3份,以不同时间的药物累积透过量(Qn,μg/cm2)对取样时间(t)作曲线,并对曲线中的直线部分进行线性回归,求出的直线斜率即为稳态透皮速率[JS,μg/(cm2·h)],直线与X轴的交点为时滞(tlag,h)。结果见表4。药物累积透过量Qn的计算公式为:
式中,A为有效扩散面积,V为接收液总体积,ρn为第n次取样时接收液中药物的质量浓度,ρi为第i次取样时接收液中药物的质量浓度,Vi为取样体积;
QS=Vρ/A;Q=(Q24·A) /M
式中,V为皮肤提取液总体积,ρ为皮肤提取液中药物的质量浓度,M为供给室药液质量。

表3 接收液的考察试验(n=3,μg/ml)

表4 TFOFB由体外经皮渗透参数(n=3)
3 讨论
黄酮类化合物是镰形棘豆的主要活性成分,目前已分离得到的黄酮类化合物多达20余种。TFOFB具有抗氧化、抗纤维化、抑菌等作用,还可作为药效成分用于开发抗紫外线晒伤及抗深Ⅱ度烧伤的外用制剂[2,6]。药物理化性质的研究是药物制剂设计的基本要素之一,因此,研究TFOFB的溶解度与表观油水分配系数具有重要意义,溶解度可影响制剂的吸收和生物利用度,而表观油水分配系数与制剂活性成分的溶解、吸收、分布、转运密切相关。
本次研究表明,TFOFB溶液的亲脂性强于亲水性,且在弱酸及中性条件下的溶解度较好;其单体成分2′,4′-二羟基查尔酮也具有较好的亲脂性。有研究报道,若化合物的logP值过低(logP<-2)则无法穿过脂质膜,logP值过高(logP>3)则会因为脂溶性强而难以从细胞另一侧的膜释放出来,最适宜经皮吸收的logP值为2.6[10]。本研究中,TFOFB的logP值在0.38~1.34之间,表明其具有一定的皮肤透过性,但透过性不高,无法实现最适宜经皮吸收的目标。而其单体成分2′,4′-二羟基查尔酮的logP值为2.24,表明透皮吸收性较好。此外,体外透皮实验得出TFOFB累积透过率较低,且有一定的时滞,表明TFOFB经皮渗透性能差。
综上所述,若将TFOFB开发成经皮给药制剂,必须综合考察药效成分特点、制剂剂型及制备工艺等进行系统研究。比如,可加入一定量的表面活性剂、增溶剂、透皮促进剂或物理方法来增强药物的经皮吸收,也可考虑脂质体、微乳、纳米粒等经皮给药新型载体。其中,脂质体具有类脂双分子层结构,可携带药物渗透进入不规则的脂质双分子层,促进药物透过皮肤,增加药物的经皮渗透量;微乳是一种胶体分散体系,可增加药物溶解度,提高药物浓度梯度,促进角质层脂质双层的流动性,并且其分散相可作为药物储库;纳米粒是用适宜的高分子材料制成的固态胶体分散系统,除了可在皮肤形成储库外,还可通过改变药物在载体-皮肤中的分配系数调控药物的透皮吸收过程。总之,新型载体可增加药物溶解性,促进药物的透皮吸收,同时具有药物储库功能,有助于活性成分透过表皮层,滞留于真皮层,进而提高制剂的生物利用度。

