巨噬源性泡沫细胞中p62蛋白上调作用和机制的研究
林张军,李 倩,章越凡,芮耀诚
(1.海军军医大学药学院药理学教研室,上海 200433;2.中国人民解放军联勤保障部队第九〇一医院药剂科,安徽 合肥 230031)
动脉粥样硬化(atherosclerosis,AS)是一种慢性炎症反应,其特征为大动脉和中动脉血管壁上形成的脂质斑块[1]。巨噬细胞是AS斑块的重要组成部分,在AS的进展中发挥重要作用。从早期斑块的巨噬细胞浸润、吞噬堆积的脂质和细胞碎片,到最终形成泡沫细胞,巨噬细胞的状态决定了斑块的发展[2]。
自噬现象在降解细胞内的长寿命蛋白、受损细胞器和堆积的脂滴中起关键作用[3]。自噬功能缺陷会诱发泡沫细胞形成,从而促进AS的发展[4-5]。p62/SQSTM1是一种多功能的支架蛋白,它不仅参与自噬过程,还涉及多个细胞信号转导通路[6-9]。在选择性自噬中,p62将泛素化的蛋白携带到自噬小体内降解,同时自身也被降解[6]。然而,在小鼠和人类的AS斑块中检测到了大量堆积的p62蛋白[10-11],这是一种自噬功能缺陷导致的病理现象,还是一种抗AS的应激反应,目前尚存在争议[12]。并且,p62是否参与了脂滴的自噬性降解暂无定论[13]。因此,本研究拟在氧化低密度脂蛋白(oxidized low density lipoprotein,Ox-LDL)诱导的巨噬源性泡沫细胞中探讨p62蛋白对脂质代谢相关的自噬以及炎症因子表达的影响。
1 材料与方法
1.1 细胞
Raw264.7细胞购自ATCC,GFP-LC3B稳转RAW264.7细胞系由本研究室参照文献方法构建[14]。
1.2 试剂及仪器
DMEM培养基(Hyclone公司),胎牛血清、青链双抗、胰蛋白酶(Gibco);兔抗小鼠p62抗体、兔抗小鼠LC3B抗体、兔抗小鼠Nrf2抗体(Cell Signaling Technology),CF555标记的驴抗兔二抗(Biotium),兔抗小鼠PEX2抗体(Abgent),兔抗小鼠Plin2抗体(Abcam),HRP(辣根过氧化酶)标记的二抗和β-Actin抗体(上海康成生物工程有限公司);低密度脂蛋白(Low density lipoprotein,LDL)、乙酰化低密度脂蛋白(acetylated lipoprotein low density,Ac-LDL)、Ox-LDL和DiI标记的Ox-LDL(北京协生生物科技有限公司);DAPI(上海碧云天生物技术有限公司),抗淬灭封片剂(Thermo Fisher);siRNA转染试剂INTERFERinR(Polyplus);Nrf2 siRNA(Santa Cruz),p62 siRNA(5′-GCUAUGUCCUAUGUGAAAGAU-3′)和对照siRNA (5′-UUCUCCGAACGUGUCACGU-3′)由苏州吉玛基因股份有限公司合成;RNA提取试剂盒、逆转录试剂盒以及qPCR检测试剂(Takara);雷帕霉素、氯喹和巴佛洛霉素A1(Sigma);玻底培养皿(无锡耐思生物科技有限公司)。
Real-time qPCR仪(Thermo Fisher ABI7500),激光共聚焦显微镜(蔡司LSM700),CO2细胞培养箱(美国Forma Scientific)。
1.3 细胞培养及siRNA转染
Raw264.7细胞培养于DMEM培养基中,内含10%灭活胎牛血清及100 U/ml青霉素和100 mg/L链霉素,置于37 °C、5.0% CO2饱和湿度的培养箱中培养。
RAW264.7细胞按1×105个/孔的密度加到12孔板中培养过夜,按照INTERFERin说明书进行转染。转染36 h后给予终浓度为40 mg/L的Ox-LDL刺激,24 h后提取细胞总蛋白;或转染48 h后给予终浓度为40 mg/L的Ox-LDL刺激,4 h后提取细胞总RNA。
1.4 巨噬源性泡沫细胞模型的建立
参照文献中泡沫细胞模型的建立方法[15-16],使用终浓度为40 mg/L Ox-LDL刺激Raw264.7细胞24 h,建立巨噬源性泡沫细胞模型。
1.5 细胞中LC3和p62斑点的观察
稳转GFP-LC3B的RAW264.7细胞按 2×105个/孔的密度加到玻底培养皿中培养过夜,24 h后更换含终浓度为40 mg/L Ox-LDL的培养基继续培养24 h;取出玻底培养皿,弃去培养基,加PBS洗涤2次;再加4%的多聚甲醛溶液进行固定30 min,PBS漂洗3次,每次5 min;用封闭液(1× PBS/5%正常驴血清/0.3% TritonTMX-100)室温封闭60 min;吸去封闭缓冲液,加入稀释后的p62一抗(1∶250),4°C 孵育过夜;取出用 1× PBS 漂洗3次,每次5 min;加入荧光二抗(1∶500),室温下避光孵育标本1~2 h;用 1× PBS 漂洗3次,每次5 min;滴上抗淬灭封片剂,于激光共聚焦显微镜下观察LC3和p62斑点。
RAW264.7细胞按1×105个/孔的密度加到玻底培养皿中培养过夜,使用终浓度均为40 mg/L的LDL、Ac-LDL或Ox-LDL刺激24 h。取出玻底皿,p62抗体孵育过程同前所述,在荧光二抗孵育结束后,滴加DAPI染液室温孵育5 min,用 1× PBS 漂洗3次,每次5 min;滴上抗淬灭封片剂,于激光共聚焦显微镜下观察p62斑点。
1.6 Western blot
使用碧云天RIPA试剂盒提取细胞内总蛋白,经BCA法测定蛋白浓度后进行蛋白变性。提取的蛋白用SDS-PAGE法分离,使用半干转法将分离的蛋白转移到硝酸纤维素膜上。用含5%的脱脂奶粉常温封闭2 h后,进行p62、LC3、PEX2和Nrf2一抗(1∶1 000)4℃孵育过夜,取出后使用TBST洗涤3次后,HRP标记的二抗(1∶5 000)室温孵育1 h,TBST洗涤3次,滴加ECL发光液后于Tanon5200成像系统上成像。使用Quantity One软件分析灰度值。
1.7 Real-time qPCR
使用RNAiso Reagent提取总RNA,采用逆转录酶试剂盒将mRNA逆转录成cDNA。使用qPCR检测试剂以及p62、IL-6、TNFα和β-Actin引物进行扩增,其中,β-Actin作为内参。详细序列见表1。

表1 qPCR引物序列
1.8 数据统计
2 结果
2.1 Ox-LDL同时上调巨噬细胞中自噬水平和p62蛋白水平
在激光共聚焦显微镜下观察发现,与对照组相比,Ox-LDL处理组的细胞中出现更多的LC3和p62斑点,并且存在共定位(图1A)。LC3斑点增多说明Ox-LDL诱导的泡沫细胞中自噬体数量增多,p62斑点增多有可能是自噬溶酶体降解途径受到影响导致的。利用自噬抑制剂氯喹与Ox-LDL共刺激或分别刺激Raw264.7细胞24 h后,Western blot结果显示Ox-LDL提高了巨噬细胞中LC3-Ⅱ/ACTB比值,与氯喹共刺激后能进一步升高该比值(图1B),说明Ox-LDL上调了巨噬细胞的自噬水平。为了研究Ox-LDL对p62蛋白水平的影响是否通过了自噬途径,将Ox-LDL与自噬诱导剂(雷帕霉素)或自噬抑制剂(巴佛洛霉素A1、氯喹)共刺激巨噬细胞24 h,通过Western blot检测细胞中p62蛋白水平。结果显示雷帕霉素能抑制Ox-LDL对p62蛋白的上调作用,巴佛洛霉素A1和氯喹均能增加Ox-LDL对p62蛋白的上调作用(图1C)。这说明Ox-LDL对p62蛋白的上调作用并不是抑制自噬溶酶体降解途径导致的。

图1 Ox-LDL对巨噬细胞中自噬水平和p62蛋白水平的影响 A.共聚焦显微镜下观察LC3(绿色)和p62(红色)斑点;B.Ox-LDL上调Raw264.7细胞自噬水平;C.不同处理组细胞中p62蛋白水平;Ox-LDL(40 mg/L)、雷帕霉素(Rap)100 nmol/L、氯喹(CQ)50 μmol/L和巴佛洛霉素A1(Baf A1)100 nmol/L;ACTB(β-actin)
2.2 LDL、Ac-LDL和Ox-LDL 上调巨噬细胞中p62蛋白和 mRNA水平
在激光共聚焦显微镜下观察到,LDL、Ac-LDL或Ox-LDL刺激后,细胞内p62斑点均增多(图2A)。Western blot 结果显示:LDL、Ac-LDL和Ox-LDL均能上调p62蛋白水平,其中Ox-LDL的上调能力最强(图2B)。分别使用终浓度均为40 mg/L LDL、Ac-LDL和Ox-LDL刺激2、4、6 h后,用Real-time qPCR检测p62 mRNA水平,结果显示:3种低密度脂蛋白均能使p62 mRNA水平呈现时间依赖性上调,其中Ox-LDL上调作用最强,与LDL组(4、6 h,P<0.01)和Ac-LDL组(4 h,P<0.05;6 h,P<0.01)相比,均有统计学差异(图2C)。
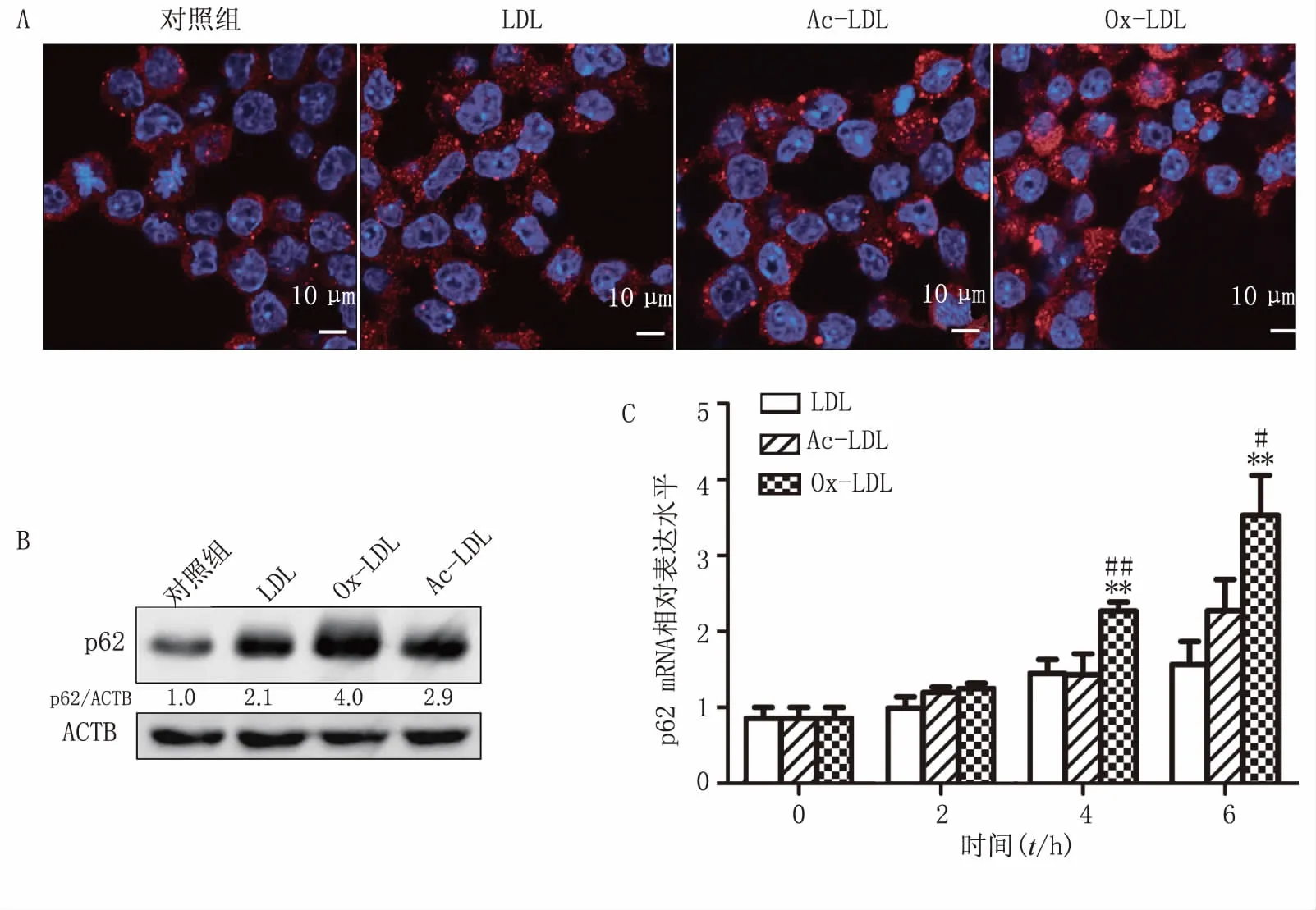
图2 LDL、Ac-LDL和Ox-LDL对巨噬细胞中p62蛋白和mRNA水平的影响 A.共聚焦显微镜下观察p62(红色),细胞核(蓝色);B.LDL、Ac-LDL和Ox-LDL对Raw264.7细胞中p62蛋白水平的影响,ACTB(β-actin);C.LDL、Ac-LDL和Ox-LDL对p62 mRNA水平的影响(n=3)**P<0.01,与同一时间点中LDL组比较;#P<0.05,##P<0.01,与同一时间点中Ac-LDL组比较
2.3 沉默p62对巨噬源性泡沫细胞中自噬的影响
使用p62 siRNA转染RAW264.7细胞36 h后,再给予终浓度为40 mg/L的Ox-LDL刺激24 h,Western blot检测到p62 siRNA组LC3II/β-actin比值低于对照组(图3A),而脂滴相关蛋白Plin2蛋白水平没有明显变化(图3B),提示下调p62虽然削弱了Ox-LDL诱导的自噬水平,但是未对细胞中脂滴自噬性降解产生明显影响。另外,Western blot结果还显示Ox-LDL刺激后的p62 siRNA组PEX2蛋白水平高于对照组(图3A)。PEX2主要位于过氧化物酶体膜上[17],PEX2水平的变化提示沉默p62可能影响了泡沫细胞中过氧化物酶体的自噬性降解。
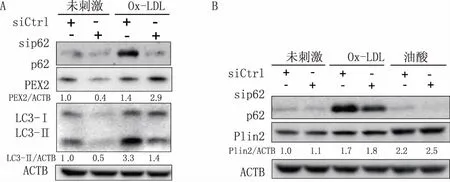
图3 沉默p62对巨噬源性泡沫细胞中自噬的影响 A.沉默p62对LC3、PEX2蛋白水平的影响;B.沉默p62对Plin2的影响;油酸200 μmol/L;ACTB(β-actin)
2.4 p62抑制Ox-LDL诱导的炎症因子表达
为了确认p62是否影响了Ox-LDL诱导的炎症因子的表达,本研究中对比了p62 siRNA组和对照组Raw264.7细胞经Ox-LDL刺激4 h后胞内的TNFα和IL-6 mRNA水平。Real-time qPCR结果显示,p62 siRNA 组TNFα(P<0.05)和IL-6 mRNA(P<0.01)表达明显升高(图4),说明沉默p62促进了Ox-LDL诱导的炎症因子的表达。
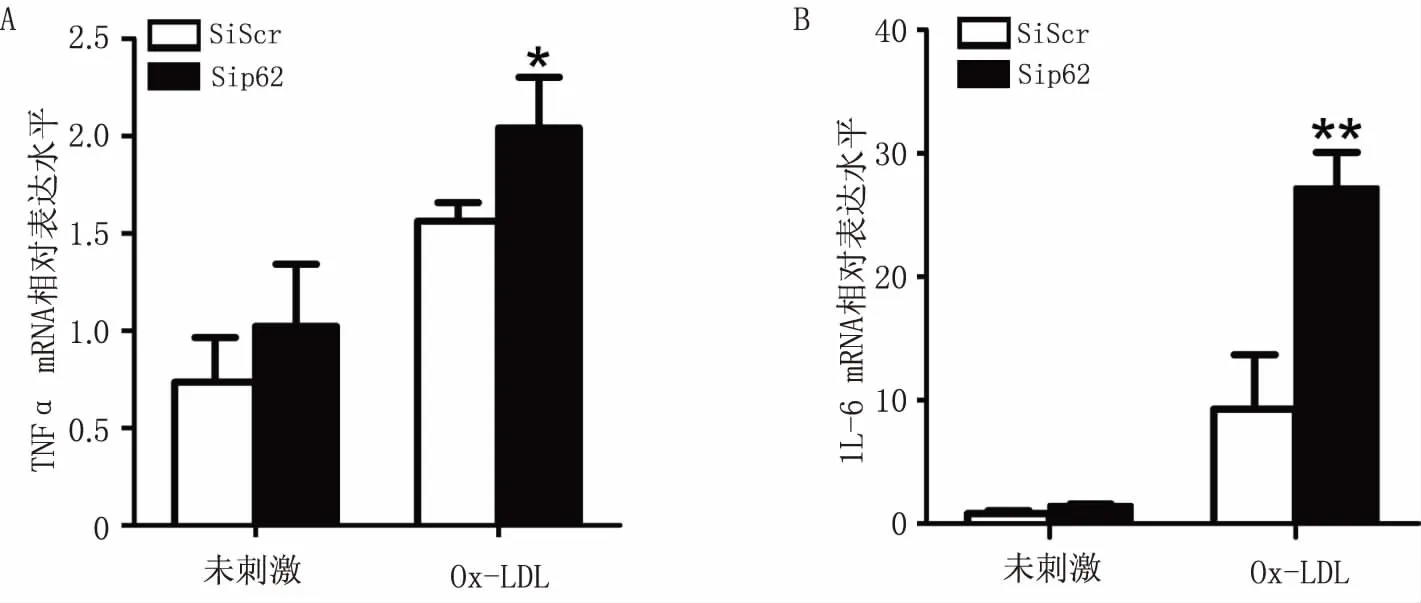
图4 沉默p62对Ox-LDL诱导的炎症因子表达的影响 A.对Ox-LDL诱导的TNFα mRNA水平的影响;B .对Ox-LDL诱导的IL-6 mRNA水平的影响(n=3)*P<0.05,**P<0.01,与Ox-LDL刺激后的对照组比较
2.5 Ox-LDL在巨噬细胞中通过Nrf2介导p62上调
当细胞应对氧化应激时,腹腔巨噬细胞中p62可以被Nrf2诱导表达,敲除Nrf2显著抑制p62的表达水平[18]。为了进一步探讨Ox-LDL对Raw264.7细胞中p62蛋白的上调是否与Nrf2相关,使用Nrf2 siRNA转染Raw264.7细胞36 h后,再给予终浓度为40 mg/L的Ox-LDL刺激24 h,Western blot结果显示,Nrf2 siRNA组中Ox-LDL对p62蛋白的上调受到了明显抑制(图5)。这说明Ox-LDL诱导巨噬细胞中p62蛋白水平上调是通过Nrf2介导的。
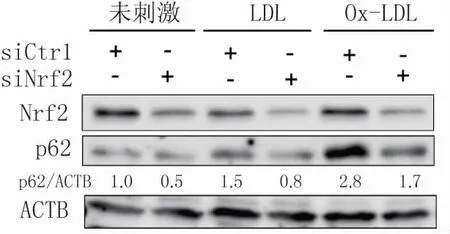
图5 Nrf2介导Ox-LDL诱导的巨噬源性泡沫细胞中p62蛋白的上调
3 讨论
修饰的低密度脂蛋白是一类重要的致AS因子,包括Ac-LDL、Ox-LDL等。巨噬细胞通过CD36受体摄取修饰的低密度脂蛋白后,大量的脂质以胆固醇酯的形式储存在于脂滴中[19]。过量的脂质负荷能够触发脂滴的自噬性降解,内质网应激和过氧化物酶体增殖物激活受体γ等通路激活[19-23]。本研究发现了Ox-LDL具有极强的上调p62蛋白的作用。虽然Ox-LDL对p62蛋白的上调作用已有文献报道[10,24],但是通过本研究发现,LDL和Ac-LDL也有上调p62蛋白作用,并且探索了Ox-LDL上调p62表达的机制,为p62在抗AS中的应用研究提供了理论基础。
本研究还发现Ox-LDL刺激后的巨噬细胞中自噬功能没有明显改变,但p62 的转录水平有显著的上调,说明Ox-LDL主要在转录水平上调p62,同时也提示p62蛋白水平升高不是自噬溶酶体功能受损的充分依据。研究同时发现沉默p62后能够影响炎症因子的表达,推测在巨噬源性泡沫细胞中p62上调可能是一种保护机制,即p62通过抑制IL-6和TNFα mRNA的表达避免可能继发的更强的炎症反应,这与既往文献报道一致[25]。
p62可以结合细胞器表面泛素化的蛋白,将这些细胞器拖入自噬小体中,利用自噬溶酶体途径实现细胞器的更新[6]。与p62功能类似的还有NBR1[26]。脂滴通过p62或NBR1途径降解目前还缺乏充分的证据,没有报道发现脂滴上存在p62或NBR1蛋白[27-28]。已有研究发现,在脂质负荷时自噬小体优先与脂滴结合[29],但具体机制还不明确。本研究发现,沉默p62对巨噬细胞中脂质负荷的程度无明显影响,也提示p62不是巨噬细胞中脂滴自噬性降解的必需蛋白。过氧化物酶体是胞内脂肪酸代谢的重要场所,过氧化物酶体的数量与细胞内氧化应激水平密切相关,细胞可以通过自噬来调节过氧化物酶体数量从而控制细胞内活性氧水平[30]。当p62被沉默后,过氧化物酶体的自噬性降解会受到影响,表现为细胞内过氧化物酶体数量增多[30]。本研究还发现沉默p62会上调Ox-LDL处理组细胞中PEX2蛋白水平,提示p62与过氧化物酶体自噬性降解存在相关性。PEX2作为一种E3泛素连接酶,可以增强对底物蛋白的泛素化作用,从而提高经NBR1途径的自噬性降解[31]。推测沉默p62后出现的PEX2蛋白上调可能是一种代偿机制。
Keap-Nrf2通路是细胞内主要的抗氧化反应途径之一。上调的p62蛋白与Nrf2竞争性结合Keap1,导致更多的Nrf2游离出来进入细胞核,从而介导p62的转录[32]。p62既是该通路的诱导产物,又能反作用于该通路,促进细胞内活性氧的清除和DNA修复等。推测在AS斑块区细胞中,大量表达的p62蛋白参与泛素化的蛋白和受损细胞器的降解,从而维持细胞内部稳态,这种p62的上调是否一种自我保护机制,还需要进一步的研究。

